血清外泌体miR-496与HPV阳性口咽鳞状细胞癌预后的相关性*
黄云竹,张福军,舒治利,黎黎
随着吸烟及饮酒人群占比降低,头颈部鳞状细胞癌(HNSCC)的发病率逐渐下降,但口咽鳞状细胞癌(OPSCC)的发病率却呈上升趋势[1]。OPSCC 主要影响老年人群,尤其对于患有心血管、内分泌和肌肉骨骼疾病等合并症的老年患者,治疗决策尤其具有挑战性[2]。高危人乳头状瘤病毒(HR-HPV)的持续感染被认为是OPSCC 发展的主要因素。例如HPV E6 和E7 癌蛋白分别与抑癌基因p53 和pRb 结合,导致其失活,从而破坏细胞增殖周期的正常调节,最终导致细胞永生化和持续恶性增殖[3]。最近的研究表明,E6 和E7 的异常增加可以调节微小RNA(miRNA)的转录或转录后[4]。HPV 阳性HNSCC 具有独特的miRNA 图谱,研究与E6 和E7 相关的miRNA,对于筛选一些潜在的OPSCC 治疗靶点和生物标志物具有重要意义。miR-496 在各种肿瘤中异常调节,在癌症发生中起重要作用[5-8]。据报道,miR-496 可被HPV-16 E6 癌蛋白下调,进而影响E2F 核转录因子2(E2F2)的转录后控制,E2F2 被证实是HNSCC中重要的促癌分子[8]。因此,我们推测miR-496可作为HPV 阳性OPSCC 的生物标志物。为了证实该推测,我们通过检测了≥60 岁OPSCC 患者血清外泌体miR-496 表达水平以及肿瘤HPV 状态,并进一步分析miR-496 与总生存率(OS)的关系。
1 对象与方法
1.1 研究对象 在这项前瞻性队列研究中,共纳入2012 年1 月至2021 年12 月期间新诊断的≥60岁原发性OPSCC 患者119 例,男性77 例,女性42 例,年龄60~88(65.53±5.69)岁,包括84 例HPV 阳性患者和35 例HPV 阴性患者。纳入标准:(1)通过术中快速病理检查或内镜检查诊断的原发性OPSCC;(2)年龄≥60 岁;(3)无手术、放疗或化疗史;(4)存档组织库中足够的组织进行免疫组织化学染色。排除标准:(1)诊断时患有其他同时活动性恶性肿瘤或缺乏随访的患者;(2)血样采集前1 个月内的糖皮质激素或免疫抑制剂治疗史;(3)风湿性疾病、肾功能不全或透析,或肝/心力衰竭。收集人口统计资料(年龄、性别)、临床病理学[吸烟史、饮酒史、TNM 分期、美国癌症联合会(AJCC)分期、肿瘤位置、HPV 状态、主要治疗方式]。HPV 状态是通过Smeets 算法结合p16 免疫组织化学法(IHC)检测确定的,所有石蜡包埋的组织样本都用p16-INK4a 抗体进行免疫染色,≥70%的肿瘤细胞为阳性则认为HPV 阳性。另外招募60 例健康个体作为对照,性别、年龄与OPSCC 患者相匹配(P >0.05)。该研究根据《赫尔辛基宣言》的指导方针进行,并得到当地医院机构审查委员会的批准。所有患者均获得书面知情同意书。根据批准的研发方案完成数据分析。
1.2 血清外泌体的提取及鉴定 在任何治疗之前,从每位参与者身上采集静脉血(约5 mL),离心所有血液样本,分离血清,并将分离的上清液储存在-80℃下,直至进一步分析。分析前,血清在4℃下以3000 r/min 离心10min。然后用等体积的无菌磷酸盐缓冲液(pH 7.4)稀释上清液,并在4℃下以10000 r/min 再次离心30min。所得上清液通过0.22μm 过滤器(美国Millipore)过滤,转移至无菌超离心管,然后在4℃下以200000 r/min离心2h(Beckman Optima XE-90,美国Beckman Coulter)。为了进行胞外体纯化,将颗粒洗涤后,在4℃下以200000 r/min 离心1h。在此步骤之后,收集含有外泌体的颗粒,将其重悬,用于后续研究。分离后,通过透射电子显微镜(TEM;Tecnai G2 Spirit TWIN;美国Thermo Fisher Scientific)观察外泌体的超微结构、浓度和大小分布。为了进一步确定分离的外泌体的尺寸分布特征,使用ZetaView 纳米粒子跟踪分析仪(德国Particle Metrix)进行纳米粒子跟踪分析(NTA)。蛋白标记物如TSG101、CD9、CD63 通过Western blot 进行评估。
1.3 逆转录定量聚合酶链式反应(RT-qPCR)检测miR-496 通过mirVana PARIS 试剂盒(美国Thermo Fisher Scientific)提取血清外泌体miRNA,提取的总miRNAs 的OD260/280 值在1.8 到2.0 之间。然后根据制造商(美国ThermoFisher)的方案,使用TaqManTM MicroRNA 逆转录试剂盒将RNA转化为cDNA。使用Taqman®MicroRNA 分析(包括引物和探针,美国ThermoFisher)对外泌体miR-496 水平进行定量,并将miR-16 用作内部对照。我们使用LightCyler®96 实时PCR 检测系统(瑞士罗氏)进行所有PCR 反应。
1.4 随访观察 所有OPSCC 患者治疗后均以电话访问或门诊复查的方式进行随访。期间电话随访连续3 次失败视为失访。记录患者的总生存期(OS)及无进展生存期(PFS),OS 定义为从治疗开始到患者死亡或随访截止随访日期的时间间隔;PFS从治疗开始到患者疾病进展、发生死亡或随访截止随访日期的时间间隔。
1.5 统计学方法 SPSS19.0 统计学软件被用于数据处理,经Kolmogorov-Smirnov 正态性检验,血清外泌体miR-496 表达水平不符合正态分布,以中位值和四分位值表示,进行Mann-WhitneyU 检验。计数资料以例(百分比)表示,进行卡方检验。绘制受试者工作特征(ROC)曲线以确定血清外泌体miR-496 的诊断价值。采用单因素及多因素COX 回归分析影响HPV 阳性OPSCC 患者预后不良的临床因素。绘制Kaplan-Meier 生存曲线,并对OPSCC患者中位生存时间进行Log Rank 2检验。P 值<0.05 被认为具有统计学意义。
2 结 果
2.1 血清外泌体提取和鉴定 TEM 图像显示了外泌体的杯状形态和双膜囊泡状结构,直径为30-150nm。如NTA 所示,外泌体峰值直径约为110nm。Western blot 分析表明,外泌体标记蛋白TSG101、CD63和CD9在外泌体样本中呈阳性表达,而在外泌体缺失的上清液中没有特异性条带。这些结果表明,从血清中分离的小泡是外泌体(图1)。

图1 血清外泌体TEM 下观察囊泡形态(49000×)和外泌体标志蛋白表达情况
2.2 OPSCC 患者血清外泌体miR-496 表达水平及其诊断价值 采用RT-qPCR 检测,与健康受试者相比,HPV 阳性患者血清外泌体miR-496 表达水平均显著下调[0.58(0.31,0.81)vs.1.08(0.75,1.33),P <0.05],且低于HPV 阴性患者[0.58(0.31,0.81)vs.1.01(0.72,1.25),P <0.05],但是HPV 阴性患者血清外泌体miR-496 表达水平与健康受试者相比无统计学差异(P >0.05)。经ROC 曲线分析,血清外泌体miR-496 水平可以良好地区分HPV 阳性OPSCC 患者和健康受试者,AUC 值为0.918(95%CI:0.874 ~0.962),特异性和敏感性分别为79.80%和95.0%(图2)。
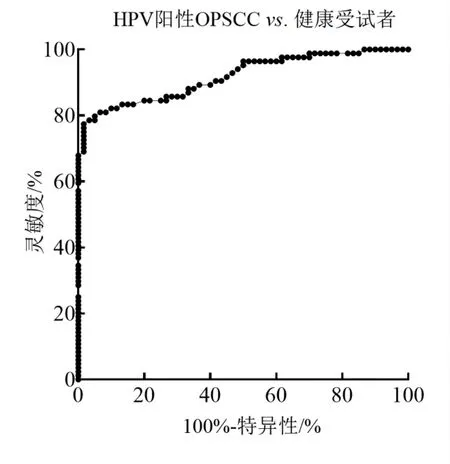
图2 ROC 曲线分析HPV 阳性OPSCC 患者血清外泌体miR-496 的诊断价值
2.3 血清外泌体miR-496 表达与HPV 阳性OPSCC患者临床病理特征的关系 根据血清外泌体miR-496表达的中位值(0.58),将HPV 阳性OPSCC 患者分为低miR-496 表达亚组(≤0.58,n=42)及高miR-496 表达亚组(>0.58,n=42)。经分析,不同血清外泌体miR-496 表达亚组之间的诊断年龄、吸烟史、饮酒史、或治疗方式等都没有显著差异(P >0.05),但是高miR-496表达亚组T分期更低(P<0.05,表1)。

表1 血清外泌体miR-106a 表达与HPV 阳性OPSCC 患者临床病理特征的关系
2.4 血清外泌体miR-496 表达与OPSCC 患者预后的关系
2.4.1 整体预后 本研究共有41 例患者发生疾病进展,38 例患者发生死亡。低miR-496 表达亚组OPSCC 患者的中位PFS 显著低于高miR-496 表达亚组(25.3 个月vs.35.1 个月,2=4.245,P=0.039),但2 组的OS 中位值无显著差异(27.8 个月vs.40.7 个月,2=0.027,P=0.870)(图3A)。
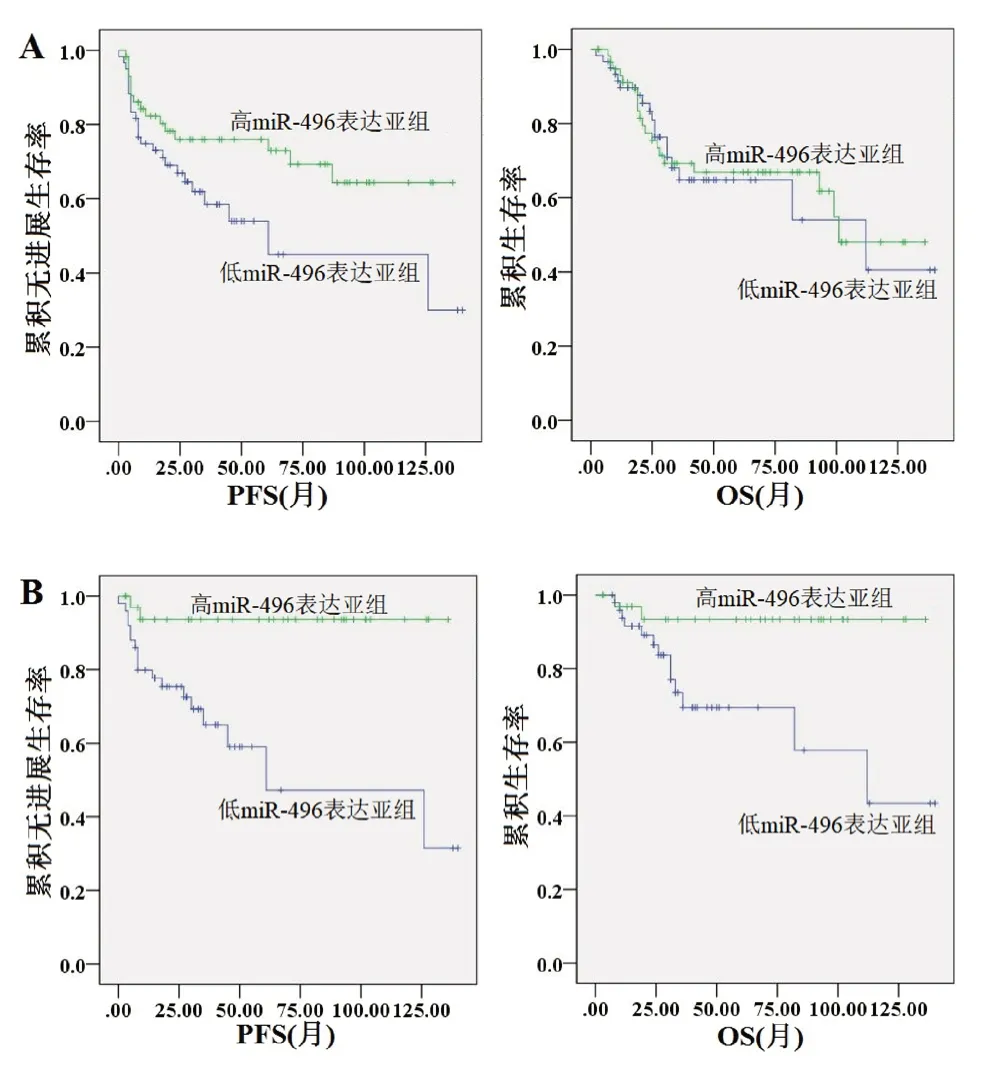
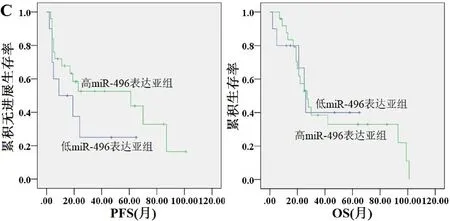
图3 血清外泌体miR-496 表达与(A)总体OPSCC 患者、(B)HPV 阳性OPSCC 患者、(C)HPV 阴性OPSCC患者预后的关系
2.4.2 HPV 阳性OPSCC 患者预后 HPV 阳性患者中,共有20 例患者发生疾病进展,15 例患者发生死亡。低miR-496 表达亚组HPV 阳性OPSCC 患者的中位PFS(27.6 个月vs.65.8 个月,2=11.448,P=0.001)、OS(29.5 个月vs.69.2 个月,2=6.948,P=0.008)均显著低于高miR-496 表达亚组(图3B)。
2.4.3 HPV 阴性OPSCC 患者预后 HPV 阴性患者中,共有21例患者发生疾病进展,23例患者发生死亡。低miR-496 表达亚组HPV 阴性OPSCC 患者的中位PFS(27.6个月vs.65.8个月,2=1.593,P=0.207)、OS(29.5个月vs.69.2 个月,2=0.013,P=0.909)均与高miR-496表达亚组无显著差异(图3C)。
2.5 单因素及多因素COX 分析影响HPV 阳性OPSCC 患者预后不良的临床因素 经单因素及多因素COX 分析,血清外泌体miR-496 表达水平降低是HPV 阳性OPSCC 患者疾病进展、死亡的独立危险因素(P <0.05,表2,表3)。
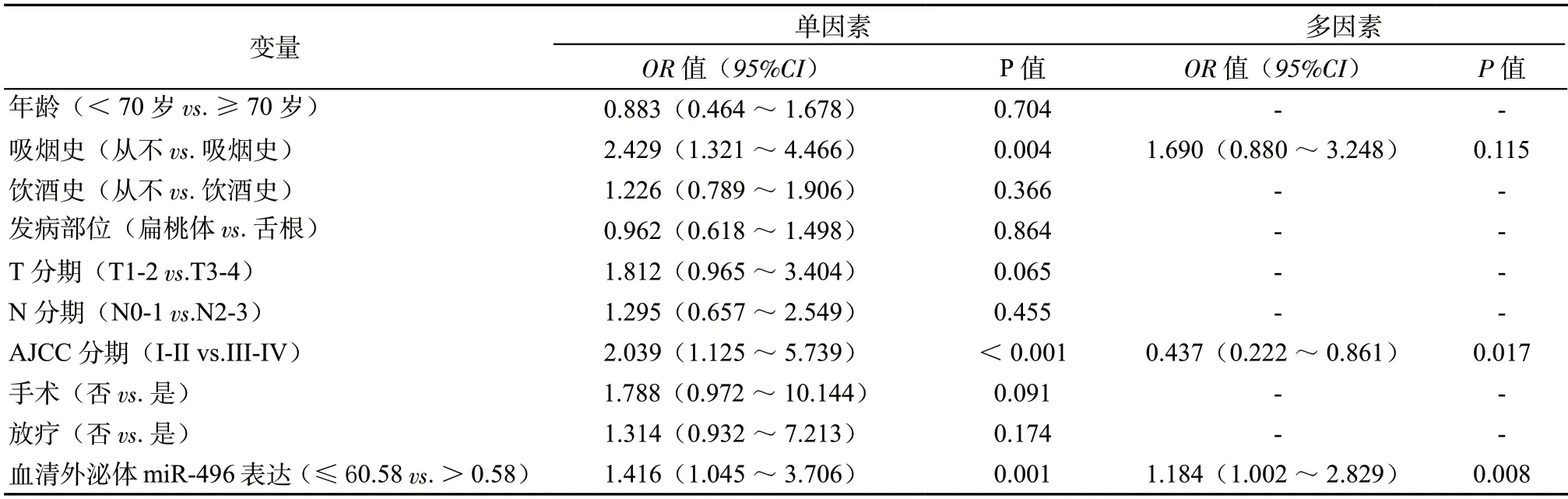
表2 单因素及多因素COX 分析影响HPV 阳性OPSCC 患者PFS 的临床因素
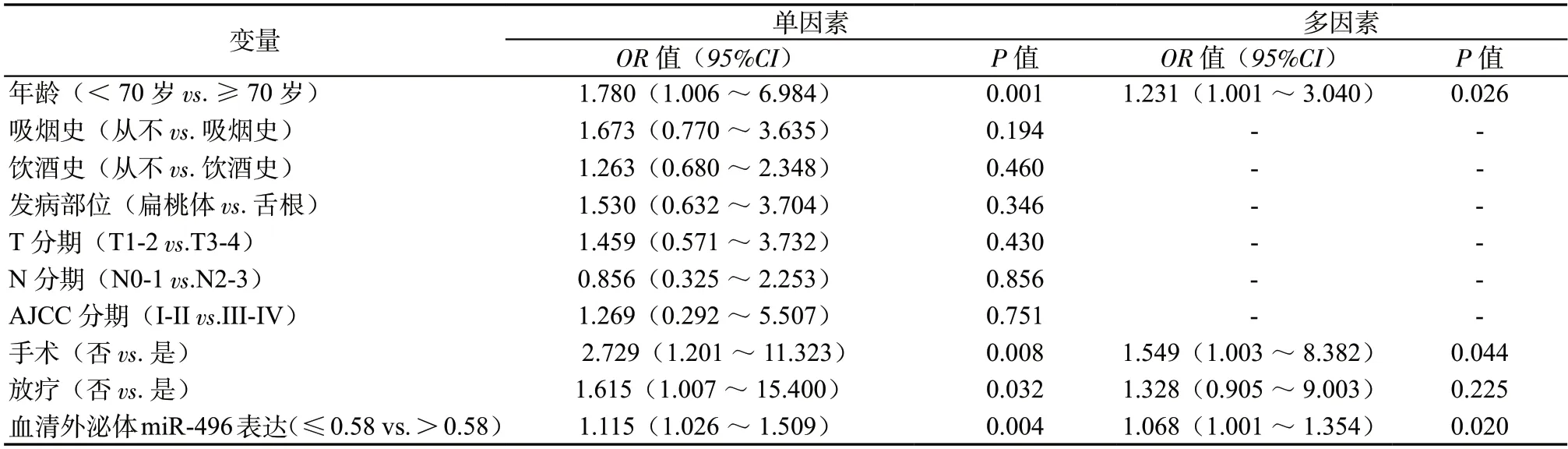
表3 单因素和多因素COX 分析影响HPV 阳性OPSCC 患者OS 的临床因素
3 讨 论
本研究是首次对OPSCC 患者血清外泌体中miR-496 表达进行分析,研究结果显示,HPV 阳性OPSCC 患者血清外泌体miR-496 表达水平均较健康受试者和HPV 阴性患者高,ROC 曲线分析表明,血清外泌体miR-496 能够以相对高的准确性区分HPV 阳性OPSCC 患者和健康受试者。最后,血清外泌体miR-496 水平被证实是HPV 阳性OPSCC患者的独立预后指标。综上所述,我们的结果表明miR-496 可能在HPV 阳性OPSCC 中作为一种癌症相关miRNA 发挥作用。
HNSCC 是高度异质性疾病,其发生、发展机制由遗传、环境等因素共同影响[9]。HPV 相关癌症的主要解剖部位是口咽,据报道,老年人群OPSCC的HPV 阳性率高达75%[1,10]。HPV16 已被确定为主要致病亚型,在过去二十年中,我国HPV16 阳性HNSCC 发病率有所增加[11]。尽管患病率和风险有所增加,但众所周知,HPV 阳性患者的中位生存期明显长于HPV 阴性患者[12]。已知HPV16 通过其两种主要癌蛋白E7 和E6 的产生诱导细胞转化,这两种早期基因都可以改变肿瘤抑制因子视网膜母细胞瘤蛋白(pRb)和p53 的表达。生物信息学研究表明,超过一半的蛋白质编码基因受miRNA 控制,异常表达的miRNA 会破坏正常细胞中严格控制的RNA网络,进而造成机体疾病状态[13]。识别感兴趣的肿瘤组织中差异表达的miRNA 是揭示癌症发病机新分子机制的第一步。
既往的研究已经证实,特异性miRNA 的失调可能在HNSCC 的发展中起着至关重要的作用[14],外泌体在细胞之间可传递多种生物活性分子,从而参与多种生物学进程,包括肿瘤生长、侵袭、转移和化学抗性[15]。因外泌体良好的结构稳定性及生物学特性,本研究主要分析了血清外泌体miR-496 表达的生物学作用。最近,发现miR-496 在癌症的进展中起着关键作用,例如在肺腺癌[5]、胃癌[6]、结肠癌[16]中miR-496 呈高表达。miR-496 通过抑制Ras 关联结构域家族成员6(RASSF6)的表达,随后促进结肠癌细胞Wnt 信号激活以及细胞增殖和上皮间充质转化[16]。然而,miR-496 在口腔鳞状细胞癌中表现出不同的作用。Mason 等[8]通过对HPV16阳性和HPV16 阴性口咽癌进行了全基因组miRNA筛选,使用严格的阈值,在HPV 阳性癌症中发现13 种miRNA 被解除调控,其中包括miR-496。此外,对于HPV16 复制至关重要的转录因子E2F2 直接受miR-496 水平的影响。E2F2 是E2F 转录因子家族的一部分,与pRb 蛋白相互作用以促进肿瘤细胞的增殖[17]。pRb 通过与HPV 癌蛋白相互作用的降解释放E2F,允许DNA 复制所需的蛋白质的募集,从而通过反馈环导致p16 的过度表达。有趣的是,上调miR-496 表达可显著抑制E2F2 mRNA 表达,双荧光素酶报告基因结果也显示,当共转染miR-496 模拟物时,荧光素酶活性显著降低30%,说明miR-496对口咽癌细胞中E2F2 的表达起转录后控制作用。因此,miR-496 在癌症发展中的功能似乎是组织或细胞特异性的。上述机制可解释本研究中低miR-496 表达亚组HPV 阳性OPSCC 患者的中位PFS 和OS 显著低于高miR-496 表达亚组的原因[8]。
对于这项观察性回顾性研究,需要考虑偏差或混杂因素对结果的潜在影响。研究人群中的患者均来自同一家医院,主要有吸烟和饮酒史。HPV 阳性和阴性患者之间生活方式、治疗方案和系统差异不是本研究分析的因素,但这些因素可能是OS 的影响因子。同样,接受手术作为唯一治疗方式的患者的疾病分期较低,因此,单独手术与其他治疗方式的比较在生存分析中存在偏差。这些都是本研究的局限性所在,我们希望在将来的工作中可以进一步完善或校正这些偏差。
总之,我们发现≥60 岁HPV 阳性OPSCC 患者血清外泌体miR-496 表达显著上调,且在区分HPV阳性OPSCC 患者与健康受试者方面具有良好的灵敏度和特异性。此外,血清外泌体miR-496 表达不足与HPV 阳性OPSCC 患者更差的临床结局和更短的生存期密切相关。因此,血清外泌体miR-496 可作为HPV 阳性OPSCC 患者诊断和预后的一个有前景的标志物。

