利拉鲁肽基于NF-κB/NLRP3通路对超重/肥胖糖尿病前期的干预研究
傅莉萍,王保法,金剑虹
·药物研究·
利拉鲁肽基于NF-κB/NLRP3通路对超重/肥胖糖尿病前期的干预研究
傅莉萍,王保法,金剑虹
杭州市中医院内分泌科,浙江杭州 310007
探讨利拉鲁肽基于核因子κB(nuclear factor-κB,NF-κB)/核苷酸结合寡聚化结构域样受体蛋白(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)通路对超重/肥胖糖尿病前期患者的作用。选取2020年4月至2021年3月杭州市中医院收治的超重/肥胖糖尿病前期患者60例,根据随机数字表法将其分为对照组和观察组,每组各30例。对照组患者进行生活方式干预,观察组患者在此基础上给予利拉鲁肽皮下注射。两组患者均干预12周。比较两组患者干预前后的体质量指数(body mass index,BMI)、血糖相关指标[糖化血红蛋白(glycosylated hemoglobin,HbA1c)、空腹血糖(fasting blood glucose,FBG)、餐后2h血糖(2h postprandial blood glucose,2hPBG)、空腹胰岛素(fasting insulin,FINS)、餐后2h胰岛素(2h postprandial insulin,2hPINS)、稳态模型评估的胰岛素抵抗(homeostasis model assessment of insulin resistance,HOMA-IR)指数]、血脂指标[三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)]、炎症因子[白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)]、NF-κB、NLRP3蛋白表达水平。观察组患者的BMI、FBG、2hPBG、FINS、2hPINS、HbA1c、HOMA-IR指数、TG、TC、LDL-C、IL-6、IL-1β、TNF-α及NF-κB、NLRP3蛋白表达水平均显著低于同期对照组(<0.05),HDL-C显著高于同期对照组(<0.05)。观察组患者的IL-6、IL-1β、TNF-α与HOMA-IR指数均呈正相关(=0.615,0.327,0.343,<0.05)。利拉鲁肽通过抑制NF-κB/NLRP3通路减轻炎症反应,可降低超重/肥胖糖尿病前期患者的体质量,改善糖脂代谢紊乱。
利拉鲁肽;糖尿病前期;超重;肥胖;NF-κB/NLRP3通路
糖尿病发病率日益攀升,其引起的大血管、微血管并发症,严重影响患者的生活质量,甚至威胁生命。目前,我国成年人糖尿病患病率达12.8%,其中90%以上为2型糖尿病,糖尿病已成为中国第一大慢性疾病[1]。糖尿病前期是介于糖尿病和正常血糖之间的一种状态,被认为是糖尿病的必经阶段,是糖尿病的预警信号。积极改善糖尿病前期患者的代谢状态,防止或延缓其进展为糖尿病是当前糖尿病防治工作成功的关键。利拉鲁肽属于人胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)类似物,能够结合GLP-1受体并使其激活,通过促进胰岛素释放、抑制胰高血糖素分泌、抑制食欲等多种机制实现降糖、改善代谢的作用。但利拉鲁肽的研究大多集中在2型糖尿病的治疗,对糖尿病前期的干预研究少见报道。基于此,本文通过对超重/肥胖糖尿病前期患者进行利拉鲁肽干预,观察其对糖脂代谢、炎症因子的影响,以期为糖尿病前期患者的治疗提供新的思路。
1 资料与方法
1.1 一般资料
选取2020年4月至2021年3月杭州市中医院收治的超重/肥胖糖尿病前期患者60例。纳入标准:①年龄18~65岁;②符合糖尿病前期标准:a.空腹血糖(fasting blood glucose,FBG)受损。6.1mmol/L ≤FBG<7.0mmol/L,口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)2h血糖<7.8mmol/L。b.糖耐量异常。FBG<7.0mmol/L且7.8mmol/L≤OGTT 2h血糖<11.1mmol/L;③超重/肥胖:体质量指数(body mass index,BMI)≥24kg/m2。排除标准:①因使用激素类药物或自身内分泌失衡导致的肥胖;②肝肾功能异常者;③患有心、肺、甲状腺、垂体疾病者;④有胰腺相关疾病史者;⑤近半年内服用过减肥类药物者;⑥有精神疾病、肿瘤相关疾病者;⑦妊娠期或计划妊娠的女性;⑧对受试药物过敏者。根据随机数字表法将其分为对照组和观察组,每组各30例。对照组患者男15例,女15例;年龄18~56岁,平均(33.80±10.22)岁;体质量64.15~97.96kg,平均(82.69±8.66)kg。观察组患者男16例,女14例;年龄19~58岁,平均(34.47±11.61)岁;体质量71.19~95.43kg,平均(83.99±6.82)kg。两组患者的一般资料比较,差异均无统计学意义(>0.05)。本研究经杭州市中医院伦理委员会批准(伦理审批号:2020LH001),患者及家属均签署知情同意书。
1.2 治疗方法
两组患者均进行生活方式干预,观察组患者在此基础上每日给予利拉鲁肽(注册证号:S20160004,生产厂商:Novo Nordisk A/S,规格:3ml∶18mg)0.6mg皮下注射。两组患者均干预12周。
1.3 观察指标
分别收集患者干预前及干预后12周的体质量、BMI、FBG、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、空腹胰岛素(fasting insulin,FINS)。生化指标采用AU5800型全自动生化仪(美国贝克曼库尔特公司)进行测定;HbA1c采用VARIANT-Ⅱ型糖化血红蛋白仪(美国伯乐公司)进行测定;胰岛素采用Centaur XP全自动化学发光分析仪(德国西门子)进行测定。计算稳态模型评估的胰岛素抵抗(homeostasis model assessment of insulin resistance,HOMA-IR)指数。利用酶联免疫吸附试验检测血清炎症因子白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)浓度,试剂盒购自美国R&D公司,操作按试剂盒说明书进行。
干预前及干预后12周采集两组患者的空腹静脉血,梯度离心分离外周血单核细胞(peripheral blood monocyte,PBMC),细胞浓度调整为1×106个/ml,接种于24孔板,4h后,冲洗掉未贴壁细胞,得到贴壁PBMC。37℃、5% CO2的条件下培养24h,收获细胞加入裂解液冰上裂解细胞,提取总蛋白,蛋白质印迹法检测核因子κB(nuclear factor-κB,NF-κB)、核苷酸结合寡聚化结构域样受体蛋白(nucleotide-bindingoligomerization domain-like receptor protein 3,NLRP3)水平。
1.4 统计学方法
2 结果
2.1 两组患者干预前后的临床资料比较
干预前,两组患者的临床资料比较,差异均无统计学意义(>0.05)。干预后12周,两组患者的BMI、FBG、餐后2h血糖(2h postprandial blood glucose,2hPBG)、FINS、餐后2h胰岛素(2h postprandial insulin,2hPINS)、HbA1c、HOMA-IR指数、TG、TC和LDL-C均显著低于本组干预前(<0.05),HDL-C显著高于本组干预前(<0.05);观察组患者的BMI、FBG、2hPBG、FINS、2hPINS、HbA1c、HOMA-IR指数、TG、TC和LDL-C均显著低于同期对照组(<0.05),HDL-C显著高于同期对照组(<0.05),见表1。
2.2 两组患者干预前后的血清炎症因子比较
干预前,两组患者的IL-6、IL-1β、TNF-α比较,差异均无统计学意义(>0.05);干预后12周,两组患者的IL-6、IL-1β、TNF-α均显著低于本组干预前(<0.05);观察组患者的IL-6、IL-1β、TNF-α均显著低于同期对照组(<0.05),见表2。
2.3 两组患者干预前后的NF-κB、NLRP3蛋白表达水平比较
干预前,两组患者的NF-κB、NLRP3蛋白表达水平比较,差异均无统计学意义(>0.05);干预后,观察组患者的NF-κB、NLRP3蛋白表达水平均显著低于对照组(<0.05),见图1。
2.4 炎症因子与HOMA-IR指数的相关性分析
相关性分析结果显示,观察组患者的IL-6、IL-1β、TNF-α与HOMA-IR指数均呈正相关(=0.615,0.327,0.343,<0.05)。
3 讨论
利拉鲁肽通过结合GLP-1受体抑制食欲、抑制胰高血糖素分泌、延缓胃排空、促进胰岛素分泌等机制改善糖尿病患者的血糖、血脂,减轻体质量。本研究结果表明,糖尿病前期在生活方式干预的基础上予以利拉鲁肽12周后能明显降低患者的体质量、BMI,说明利拉鲁肽对糖尿病前期患者具有减重作用。同时发现观察组患者的HbA1c、FBG、2hPBG、HOMA-IR指数、TG、TC和LDL-C水平显著降低,而HDL水平显著升高,与文献报道结论一致[2]。在真实世界研究中,利拉鲁肽可明显降低肥胖患者的体质量,改善脂代谢,且亚组分析显示与奥利司他相比,利拉鲁肽可明显延缓糖尿病前期向糖尿病的进展[3]。一项来自印度的青少年肥胖患儿的研究表明,经过12周干预,利拉鲁肽可减轻患儿的体质量,改善血糖水平,降低患儿的空腹及OGTT试验中餐后胰岛素水平,从而改善胰岛素抵抗[4]。
表1 两组患者干预前后的临床资料比较()
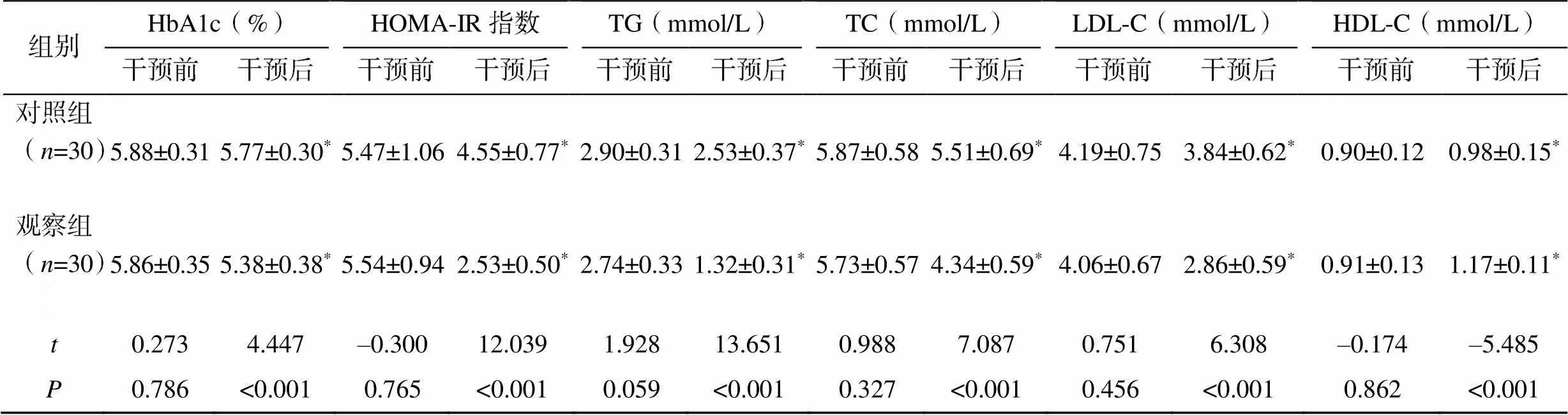
组别HbA1c(%)HOMA-IR指数TG(mmol/L)TC(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L) 干预前干预后干预前干预后干预前干预后干预前干预后干预前干预后干预前干预后 对照组(n=30)5.88±0.315.77±0.30*5.47±1.064.55±0.77*2.90±0.312.53±0.37*5.87±0.585.51±0.69*4.19±0.753.84±0.62*0.90±0.120.98±0.15* 观察组(n=30)5.86±0.355.38±0.38*5.54±0.942.53±0.50*2.74±0.331.32±0.31*5.73±0.574.34±0.59*4.06±0.672.86±0.59*0.91±0.131.17±0.11* t0.2734.447–0.30012.0391.92813.6510.9887.0870.7516.308–0.174–5.485 P0.786<0.0010.765<0.0010.059<0.0010.327<0.0010.456<0.0010.862<0.001
注:与本组干预前比较,*<0.05
表2 两组患者干预前后的血清炎症因子比较(,ng/L)
注:与本组干预前比较,*<0.05
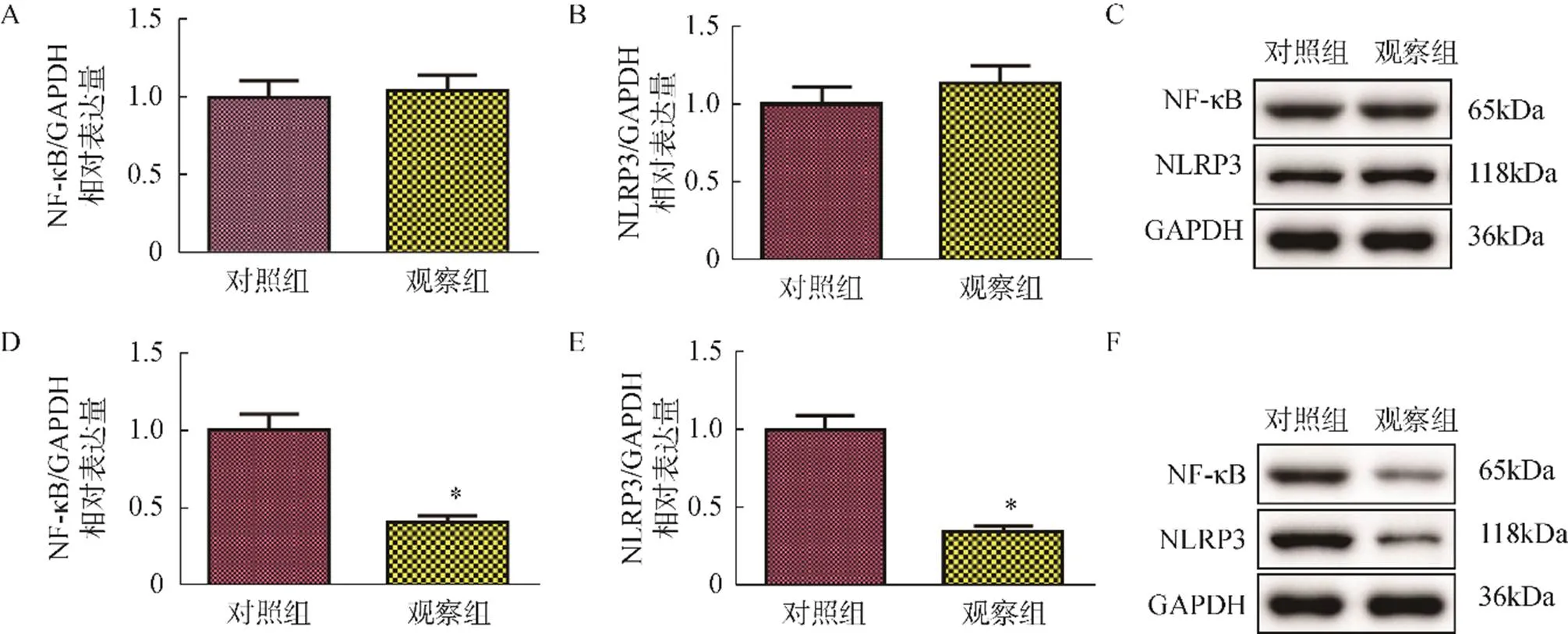
图1 两组患者干预前后的NF-κB、NLRP3蛋白表达水平比较
A.干预前两组患者的NF-κB蛋白表达水平比较;B.干预前两组患者的NLRP3蛋白表达水平比较;C.干预前NF-κB、NLRP3蛋白条带; D.干预后两组患者的NF-κB蛋白表达水平比较;E.干预后两组患者的NLRP3蛋白表达水平比较;F.干预后NF-κB、NLRP3蛋白条带
注:与对照组比较,*<0.05
2型糖尿病的发病机制中,胰岛素抵抗往往先于糖尿病发生,具有复杂的临床表现。在其作用下,早期胰岛素代偿性分泌增加以保持正常糖耐量,当胰岛素抵抗进一步加重、胰岛素代偿性分泌减少或二者同时出现时,则会逐渐向糖尿病发展。
胰岛素抵抗被广泛认为是慢性炎症性疾病[5-6]。NF-κB是真核细胞中重要的核转录因子,其通路是炎症反应中关键的信号转导途径,在胰岛素抵抗中起重要作用。当NF-κB水平升高时可激活大量促炎细胞因子,产生TNF-α、IL-1β、IL-6和IL-8等炎症因子。炎症因子通过促进胰岛素受体底物-1丝氨酸磷酸化,抑制其正常的酪氨酸磷酸化,减少胰岛素受体与胰岛素受体底物的结合,致胰岛素抵抗持续发展[7]。既往研究表明,GLP-1类似物能改善动物模型的IL-6、IL-1β、TNF-α等细胞因子的水平,从而抑制炎症,改善胰岛素抵抗[8-10]。本研究结果表明,糖尿病前期患者经利拉鲁肽干预后,血清IL-6、IL-1β、TNF-α水平显著下降,表明利拉鲁肽治疗可降低机体的炎症反应水平。
NLRP3炎症小体由多种胞浆蛋白组成,是重要的炎症核转录调控因子,可作为NF-κB的下游信号分子参与信号转导。研究表明NLRP3活化可影响外周组织胰岛素信号转导,并影响胰岛β细胞功能及胰岛素分泌导致胰岛素抵抗[11]。抑制NLRP3炎症小体活性能够抑制炎症通路的一系列级联反应,从而改善相关炎症疾病及胰岛素抵抗[12]。本研究结果显示观察组患者的NF-κB、NLRP3蛋白表达水平显著降低,由此可知利拉鲁肽可有效抑制NF-κB、NLRP3蛋白活性,改善患者体内的炎症因子水平,对患者起到一定的保护作用。相关性分析表明,血清IL-6、IL-1β、TNF-α水平与HOMA-IR指数变化呈显著正相关,进一步表明糖尿病前期患者的机体炎症改善与胰岛素抵抗存在正向关联。脂肪组织尤其是腹部脂肪组织过多会导致大量炎症因子合成和释放,引发慢性炎症反应[13]。Lee等[14]研究显示,GLP-1可抑制脂多糖诱导的3T3-L1脂肪细胞分泌TNF-α等炎症因子,控制炎症反应,降低机体脂肪含量,本研究结论与之相符。
综上所述,利拉鲁肽能安全有效地降低超重/肥胖糖尿病前期患者的体质量,改善患者的糖脂代谢,降低机体胰岛素抵抗和炎症反应,从而起到有效的治疗作用。
[1] LI Y, TENG D, SHI X, et al. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: National cross sectional study[J]. BMJ, 2020, 369: m997.
[2] ZHAO N, WANG X, WANG Y, et al. The effect of liraglutide on epicardial adipose tissue in type 2 diabetes[J]. J Diabetes Res, 2021, 2021: 5578216.
[3] GORGOJO-MARTÍNEZ J J, BASAGOITI-CARREÑO B, SANZ-VELASCO A, et al. Effectiveness and tolerability of orlistat and liraglutide in patients with obesity in a real-world setting: The XENSOR study[J]. Int J Clin Pract, 2019, 73(11): e13399.
[4] KOCHAR I S, SETHI A. Efficacy and safety of liraglutide in Indian adolescents with obesity[J]. Obes Sci Pract, 2019, 5(3): 251–257.
[5] KRAAKMAN M J, MURPHY A J, JANDELEIT- DAHM K, et al. Macrophage polarization in obesity and type 2 diabetes: Weighing down our understanding of macrophage function?[J]. Front Immunol, 2014, 5: 470.
[6] AGARWAL A, HEGDE A, YADAV C, et al. Association of interleukin-6 and myeloperoxidase with insulin resistance in impaired fasting glucose subjects[J]. Indian J Clin Biochem, 2017, 32(1): 33–38.
[7] LUO C, YANG H, TANG C, et al. Kaempferol alleviates insulin resistance via hepatic IKK/NF-κB signal in type 2 diabetic rats[J]. Int Immunopharmacol, 2015, 28(1): 744–750.
[8] ZHOU J Y, POUDEL A, WELCHKO R, et al. Liraglutide improves insulin sensitivity in high fat diet induced diabetic mice through multiple pathways[J]. Eur J Pharmacol, 2019, 861: 172594.
[9] LI Z, ZHU Y, LI C, et al. Liraglutide ameliorates palmitate-induced insulin resistance through inhibiting the IRS-1 serine phosphorylation in mouse skeletal muscle cells[J]. J Endocrinol Invest, 2018, 41(9): 1097–1102.
[10] 刘云涛, 刘慧, 董国锋, 等. IKKε在糖尿病大鼠肝脏的表达及利拉鲁肽对其干预作用的研究[J]. 中国糖尿病杂志, 2018, 26(10): 856–859.
[11] RALSTON J C, LYONS C L, KENNEDY E B, et al. Fatty acids and NLRP3 inflammasome-mediated inflammation in metabolic tissues[J]. Annu Rev Nutr, 2017, 37: 77–102.
[12] 陈金晖, 陈青青, 梅统, 等. 利拉鲁肽基于NF-κB/ NLRP3通路介导的焦亡途径对小鼠动脉粥样硬化的干预作用研究[J]. 浙江医学, 2021, 43(17): 1835–1840.
[13] 张晨, 万海霞, 孙月飞. 利拉鲁肽对老年2型糖尿病患者糖脂代谢胰岛功能及骨密度的影响[J]. 浙江临床医学, 2019, 21(10): 1312–1314.
[14] LEE Y S, PARK M S, CHOUNG J S, et al. Glucagon- like peptide-1 inhibits adipose tissue macrophage infiltration and inflammation in an obese mouse model of diabetes[J]. Diabetologia, 2012, 55(9): 2456–2468.
Intervention study of liraglutide in overweight/obese prediabetes based on NF-κB/NLRP3 pathway
Department of Endocrinology, Hangzhou Hospital of Traditional Chinese Medicine, Hangzhou 310007, Zhejiang, China
To investigate the effect of liraglutide on overweight/obese prediabetes patients based on nuclear factor-κB (NF-κB)/nucleotide-binding oligomerization domain-like receptor protein 3 (NLRP3) pathway.Sixty overweight/obese prediabetes patients admitted to Hangzhou Hospital of Traditional Chinese Medicine from April 2020 to March 2021 were selected and divided into control group and observation group according to random number table method, with 30 cases in each group. The control group received lifestyle intervention, and the observation group received subcutaneous injection of liraglutide on this basis. Both groups were treated for 12 weeks. Body mass index (BMI), blood glucose related indexes [glycosylated hemoglobin (HbA1c), fasting blood glucose (FBG), 2h postprandial blood glucose (2hPBG), fasting insulin (FINS), 2h postprandial insulin (2hPINS), homeostasis model assessment of insulin resistance (HOMA-IR) index], blood lipid indexes [triglyceride (TG), total cholesterol, (TC), high density lipoprotein-cholesterol (HDL-C), low density lipoprotein-cholesterol (LDL-C)], inflammatory factors [interleukin (IL)-1β, IL-6, tumor necrosis factor-α (TNF-α)], NF-κB, NLRP3 protein expression levels were compared between the two groups before and after intervention.BMI, FBG, 2hPBG, FINS, 2hPINS, HbA1c, HOMA-IR index, TG, TC, LDL-C, IL-6, IL-1β, TNF-α, and expression levels of NF-κB and NLRP3 in observation group were significantly lower than those in control group (<0.05), HDL-C was significantly higher than that of control group (<0.05). IL-6, IL-1β, TNF-α were positively correlated with HOMA-IR index in observation group (=0.615, 0.327, 0.343,<0.05).Liraglutide reduces inflammation by inhibiting the NF-κB/NLRP3 pathway, reduces body weight in overweight/obese prediabetes patients, and improves glucose and lipid metabolism disorders.
Liraglutide; Prediabetes; Overweight; Obese; NF-κB/NLRP3 pathway
R589.1
A
10.3969/j.issn.1673-9701.2023.19.018
(2022–09–19)
(2023–06–19)
浙江省医药卫生科技计划项目(2020KY226)
傅莉萍,电子信箱:lipingfu@hotmail.com

