阻塞性睡眠呼吸暂停与肥胖低通气综合征患者的肺功能特点分析
马青青,王楚,朱麒霖
·论 著·
阻塞性睡眠呼吸暂停与肥胖低通气综合征患者的肺功能特点分析
马青青,王楚,朱麒霖
南通市第三人民医院呼吸内科,江苏南通 226000
研究阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)与肥胖低通气综合征(obesity hypoventilation syndrome,OHS)患者的肺功能变化。选取2020年10月至2022年4月于南通市第三人民医院呼吸内科就诊的成人肥胖患者83例,将其分为OHS组(26例)、肥胖OSA组(47例)和单纯肥胖组(10例)。比较各组患者的一般资料、多导睡眠图参数、动脉血气分析和肺功能相关指标。OHS组和肥胖OSA组患者的呼吸暂停低通气指数显著高于单纯肥胖组,夜间最低动脉血氧饱和度(lowest arterial oxygen saturation,LSaO2)、平均动脉血氧饱和度(mean arterial oxygen saturation,MSaO2)均显著低于单纯肥胖组,最长呼吸暂停时间和最长低通气时间均显著长于单纯肥胖组(<0.05)。OHS组患者的动脉血氧分压(arterial partial pressure of oxygen,PaO2)显著低于肥胖OSA组和单纯肥胖组,动脉血二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)、HCO3-显著高于肥胖OSA组和单纯肥胖组(<0.05)。OHS组患者的第一秒用力呼气量(forced expiratory volume in first second,FEV1)占预计值百分比(FEV1%)、最大自主通气量(maximal voluntary ventilation,MVV)、用力呼气中段流量(forced expiratory flow during middle half of forced vital capacity,FEF)50%均显著低于肥胖OSA组和单纯肥胖组(<0.05)。相关性分析显示,除FEV1/用力肺活量(forced vital capacity,FVC)外,其他肺功能参数均与PaO2呈正相关,与PaCO2呈负相关;MVV和FEF25%与LSaO2呈正相关;FEV1/FVC与最长呼吸暂停时间呈负相关;最长低通气时间与FEV1%、FEV1/FVC、MVV、FEF75%、FEF50%、FEF25%均呈负相关(0.05)。OHS患者比肥胖OSA患者更易发生限制性通气功能障碍和小气道功能受损,肺功能受损的严重程度与日间缺氧、二氧化碳潴留、夜间睡眠时呼吸暂停和低通气时间有关。
睡眠呼吸障碍;肺功能;动脉血气分析;严重程度
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是指上气道反复塌陷从而引起白天嗜睡、通气不足与呼吸暂停等症状的疾病。肥胖低通气综合征(obesity hypoventilation syndrome,OHS)是与肥胖[体质量指数(body mass index,BMI)≥30kg/m2]相关的睡眠呼吸紊乱疾病。OHS是一种排他性诊断,需同时满足睡眠呼吸紊乱和清醒状态下的二氧化碳潴留[动脉血二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)>45mmHg(1mmHg=0.133kPa)或动脉血氧分压(arterial partial pressure of oxygen,PaO2)<70mmHg]。OSA和OHS是两种独立疾病,其主要区别是后者存在日间清醒状态下低氧血症或高碳酸血症。虽然两者均有打鼾、夜间憋气、被目击的呼吸暂停、日间过度嗜睡等相似症状,但OHS患者所花医疗费用更高、生活质量更低、预后更差,更易出现心脑血管疾病、糖尿病及睡眠相关事故等并发症,早期病死率更高[1-2]。反复上气道塌陷、长期睡眠呼吸紊乱及炎症反应等可导致OSA和OHS患者肺功能损害,其主要表现为限制性通气功能障碍及小气道功能异常[3]。与OSA相比,OHS患者的肺功能受损更严重,主要表现为第一秒用力呼气量(forced expiratory volume in first second,FEV1)和用力肺活量(forced vital capacity,FVC)的降低[4-5]。本研究拟探讨OSA与OHS患者的肺功能变化及其特点,现报道如下。
1 资料与方法
1.1 一般资料
选取2020年10月至2022年4月于南通市第三人民医院呼吸内科就诊的成人肥胖患者。所有纳入患者均排除以下情况:①合并严重的阻塞性肺及气道疾病、间质性肺病、胸壁疾病、神经肌肉疾病等;②上气道解剖结构异常,近1个月有创伤、手术等应激史;③长期服用镇静、催眠或肌肉松弛类药物,或接受免疫抑制剂、激素治疗者;④合并恶性肿瘤。肥胖OSA组纳入标准:经多导睡眠图(polysomnography,PSG)检查符合《阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)》[6]的诊断标准;呼吸暂停低通气指数(apnea-hypopnea index,AHI)≥5次/h,BMI≥30kg/m2,PaCO2<45mmHg。OHS组纳入标准:满足日间高碳酸血症和睡眠呼吸紊乱;AHI≥5次/h,BMI≥30kg/m2,PaCO2≥45mmHg或PaO2<70mmHg。单纯肥胖组纳入标准:AHI<5次/h,BMI≥30kg/m2,PaCO2<45mmHg。本研究经南通市第三人民医院医学伦理委员会批准(伦理审批号:JD-LK-2018-004-02),所有受试者均签署知情同意书。
1.2 研究方法
1.2.1 一般资料和PSG监测 记录患者的个人史和既往史,测量身高、体质量、颈腰围,计算BMI,进行艾普沃斯嗜睡量表(Epworth sleepiness scale,ESS)评分。所有受试者均进行至少连续7h的PSG监测。嘱所有受试者当天停用镇静剂,禁饮酒及咖啡,使用澳大利亚瑞思迈公司生产的多导睡眠监测仪进行PSG监测,睡眠期AHI≥5次/h,则诊断为OSA。
1.2.2 肺功能检查 采用德国耶格MS Diffusion肺功能仪进行肺功能检查。记录患者的肺活量(vital capacity,VC)、FVC、FEV1占预计值百分比(FEV1%)、FEV1/FVC、用力呼气中段流量[forced expiratory flow during middle half of FVC,FEF(25%~75%)]、弥散量(diffusing capacity,DL)、最大自主通气量(maximal voluntary ventilation,MVV)、残气量(residual volume,RV)/肺总量(total lung capacity,TLC)等指标。
1.2.3 动脉血气分析 于清醒状态下,抽取患者桡动脉血1ml,标本采集后立即送检。
1.3 统计学方法
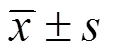
2 结果
2.1 三组患者的一般资料比较
OHS组患者的体质量、BMI、颈围、胸围、腰围、臀围均显著大于肥胖OSA组和单纯肥胖组(<0.05)。各组患者的性别、年龄和身高比较差异均无统计学意义(>0.05),见表1。
2.2 三组患者的PSG指标比较
OHS组和肥胖OSA组患者的AHI显著高于单纯肥胖组,夜间最低动脉血氧饱和度(lowest arterial oxygen saturation,LSaO2)、平均动脉血氧饱和度(mean arterial oxygen saturation,MSaO2)均显著低于单纯肥胖组,最长呼吸暂停时间和最长低通气时间均显著长于单纯肥胖组(<0.05);但OHS组和肥胖OSA组患者的上述指标比较差异均无统计学意义(>0.05),见表2。
2.3 三组患者的动脉血气分析比较
OHS组患者的PaO2显著低于肥胖OSA组和单纯肥胖组,PaCO2、HCO3–显著高于肥胖OSA组和单纯肥胖组(<0.05);肥胖OSA组和单纯肥胖组患者的PaO2、PaCO2、HCO3–比较差异均无统计学意义(>0.05),见表3。
2.4 三组患者的肺功能参数比较
OHS组患者的FEV1%、MVV、FEF50%均显著低于肥胖OSA组和单纯肥胖组(<0.05);OHS组患者的FEV1/FVC、FEF75%、FEF25%均显著低于单纯肥胖组(<0.05),见表4。

表3 三组患者的动脉血气分析比较()
注:与OHS组比较,*<0.05;1mmHg=0.133kPa
2.5 肺功能参数与动脉血气分析、PSG指标的相关性分析
除FEV1/FVC外,其他肺功能参数均与PaO2呈正相关,与PaCO2呈负相关;MVV和FEF25%与LSaO2呈正相关;FEV1/FVC与最长呼吸暂停时间呈负相关;最长低通气时间与FEV1%、FEV1/FVC、MVV、FEF75%、FEF50%、FEF25%均呈负相关(<0.05),见表5。
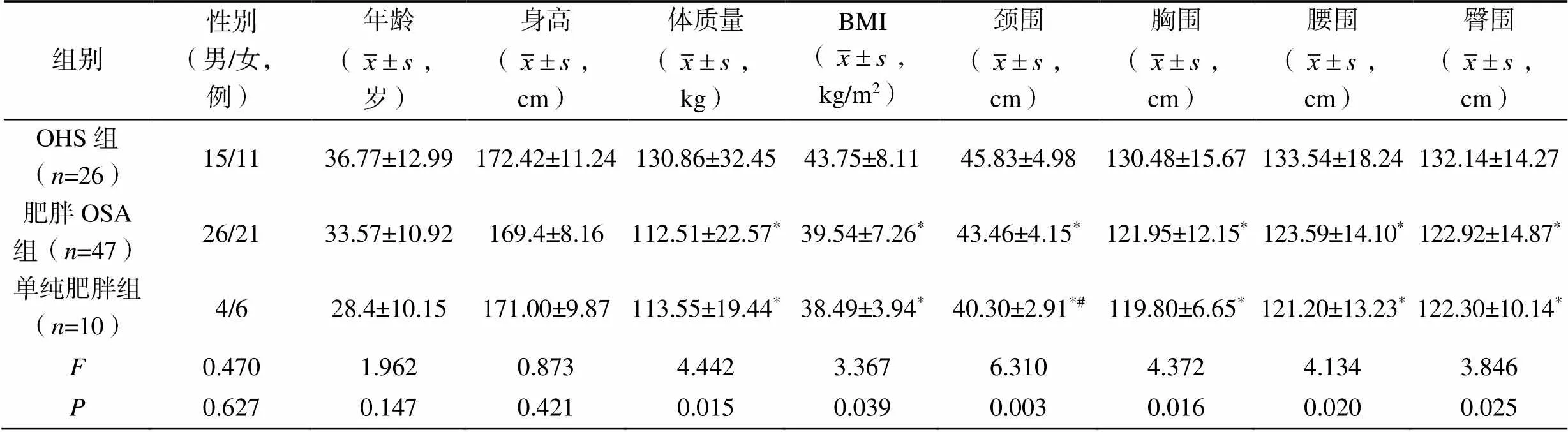
表1 三组患者的一般资料比较
注:与OHS组比较,*<0.05;与肥胖OSA组比较,#<0.05

表2 三组患者的PSG指标比较()
注:与OHS组比较,*<0.05;与肥胖OSA组比较,#<0.05

表4 三组患者的肺功能参数比较()
注:与OHS组比较,*<0.05;与肥胖OSA组比较,#<0.05
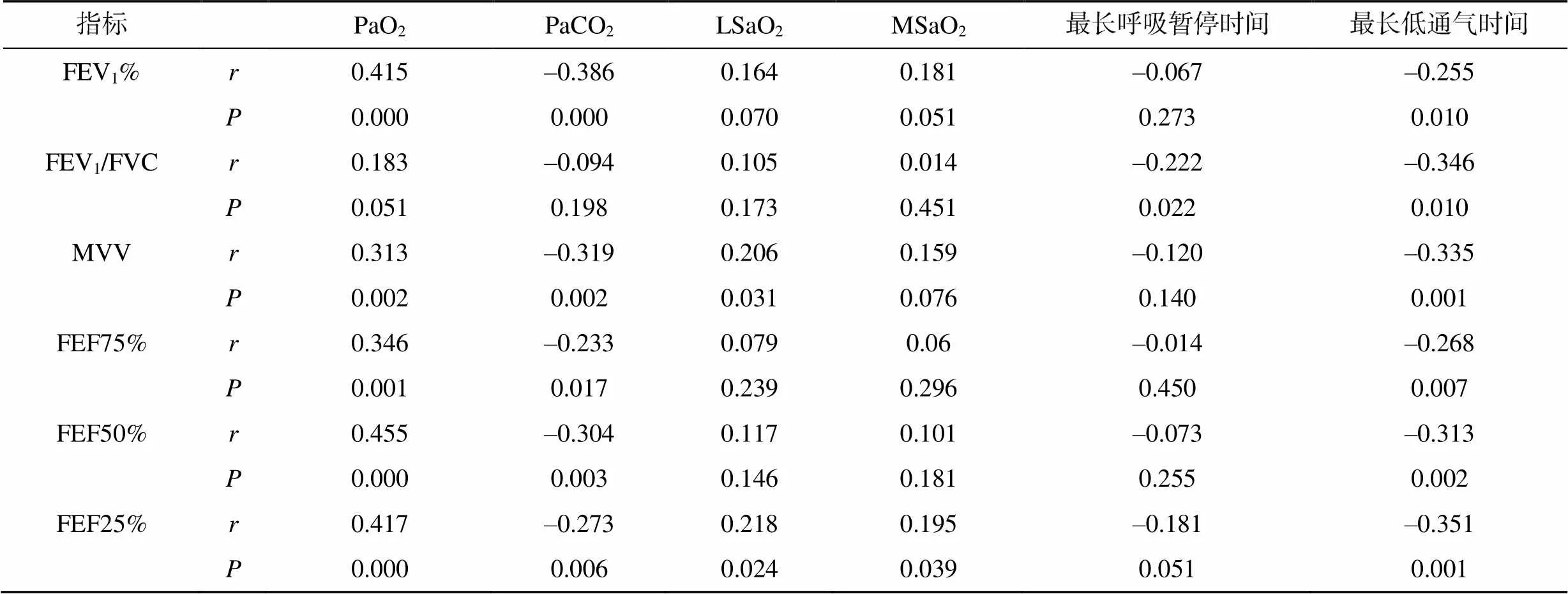
表5 肺功能参数与动脉血气分析、PSG指标的相关性分析
3 讨论
目前肥胖已对人类健康构成严重威胁。最近一项针对全球200多个国家的人口统计研究发现,全球肥胖人群明显增加,其中我国男性和女性肥胖患者分别占全球肥胖人数的16.3%和12.4%[7]。肥胖可引起高血压、糖尿病、冠心病、脑梗死等代谢性和心脑血管疾病,对人类身体健康造成极大伤害。睡眠呼吸障碍(sleep-disorder breathing,SDB)是指上呼吸道狭窄和睡眠过程中正常呼吸模式丧失引起的多种疾病的总称,其在人群中非常普遍[8]。随着肥胖人群越来越多,SDB发病率越来越高。OSA和OHS均属于SDB疾病,均可引起一系列并发症,但其对肺功能影响的相关研究甚少,本研究就OSA与OHS患者的肺功能进行探索。
既往研究发现,SDB多伴随肥胖发生[5-9]。本研究发现OHS组患者的体质量和BMI均高于肥胖OSA组和单纯肥胖组,但肥胖OSA组和单纯肥胖组患者的体质量和BMI比较差异无统计学意义,可能因为单纯肥胖组入组的人数较少,未来需要增加样本量来进行验证。
虽然OHS与OSA患者的临床表现大多相似,但OHS和OSA是两种独立疾病,主要区别在于OHS合并日间清醒状态下的高碳酸血症和(或)低氧血症[5]。本研究发现,OHS组与其他两组相比,除清醒状态下缺氧程度更严重、二氧化碳潴留更明显之外,OHS组患者睡眠时LSaO2低于OSA组,虽然差异无统计学意义,但也提示OHS患者夜间缺氧更为严重。同时,本研究也发现OHS组患者的AHI和最长低通气时间高于OSA组,MSaO2和最长呼吸暂停时间低于OSA患者,可能由于样本量较少,两组间比较无统计学意义。
OSA患者长期睡眠状态下呼吸紊乱,从而引起肺功能、呼吸道功能损伤,SDB严重的患者通气和换气功能长期处于病态,因此肺功能损伤程度严重[10-11]。Masa等[12]研究发现OHS患者FEV1%和FEV1/FVC明显降低,说明OHS可导致限制性通气功能障碍和阻塞性通气功能障碍。本研究发现OHS患者与肥胖OSA患者相比,FEV1%、MVV、FEF50%更低,提示OHS患者比肥胖OSA患者更易出现限制性通气功能障碍和小气道功能受损。
既往研究发现OSA患者的FEV1和VC与高碳酸血症相关,与PaCO2正常的OSA患者相比,合并高碳酸血症的OSA患者的FEV1和VC更低,这也间接证明OHS患者的FEV1和VC明显低于OSA患者。研究发现OHS患者的肺功能损害与高碳酸血症严重程度呈正相关[13-14]。结果显示,SDB患者出现肺功能损伤与PaO2、PaCO2、LSaO2、最长呼吸暂停时间、最长低通气时间有关,说明缺氧、二氧化碳潴留越严重、夜间睡眠时呼吸暂停时间和低通气时间越长,患者越易出现肺功能损害。由于OHS与OSA患者的主要区别是存在日间持续性低氧血症和高碳酸血症,因此OHS患者比OSA患者更易出现肺功能损害。
综上,肺功能测定作为一种非侵入性检查,可在未行动脉血气分析的情况下,尽早识别OHS,从而及时确诊OHS及合并高碳酸血症的OSA,早期干预,减少并发症、降低死亡率,改善患者的生活质量和预后。
[1] IFTIKHAR I H, ROLAND J. Obesity hypoventilation syndrome[J]. Clin Chest Med, 2018, 39(2): 427–436.
[2] KIRSCH D B. Obstructive sleep apnea[J]. Continuum (Minneap Minn), 2020, 26(4): 908–928.
[3] 袁晨阳, 刘燕. 儿童阻塞性睡眠呼吸暂停低通气综合征对肺功能的影响[J]. 山东大学耳鼻喉眼学报, 2022, 36(1): 143–148.
[4] 姜珊, 王彦, 张静, 等. OSAHS合并肥胖低通气综合征患者的临床特征分析[J]. 天津医科大学学报, 2021, 27(1): 17–21.
[5] 夏雪梅, 李殿明, 胡俊锋, 等. 肥胖低通气综合征在阻塞性睡眠呼吸暂停低通气综合征患者中的发病特征及预测因素分析[J]. 临床内科杂志, 2017, 34(1): 26–28.
[6] 中华医学会呼吸病学分会睡眠呼吸障碍学组. 阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)[J]. 中华结核和呼吸杂志, 2012, 35(1): 9–12.
[7] NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in body-mass index, underweight, overweight, and obesity from 1975 to 2016: A pooled analysis of 2416 population-based measurement studies in 128.9 million children, adolescents, and adults[J]. Lancet, 2017, 390(10113): 2627–2642.
[8] FIETZE I, LAHARNAR N, OBST A, et al. Prevalence and association analysis of obstructive sleep apnea with gender and age differences - Results of SHIP-trend[J]. J Sleep Res, 2019, 28(5): e12770.
[9] MEURLING I J, SHEA D O, GARVEY J F. Obesity and sleep: A growing concern[J]. Curr Opin Pulm Med, 2019, 25(6): 602–608.
[10] 刘艳霞, 刘浩. 阻塞性睡眠呼吸暂停综合征患者肺功能的研究[J]. 实用中西医结合临床, 2021, 21(9): 64–65.
[11] 刘小行, 朱述阳. 不同严重程度的阻塞性睡眠呼吸暂停低通气综合征患者的肺功能分析[J]. 临床肺科杂志, 2020, 25(4): 510–514.
[12] MASA J F, PÉPIN J L, BOREL J C, et al. Obesity hypoventilation syndrome[J]. Eur Respir Rev, 2019, 28(151): 180097.
[13] LEE Y Y, TSAO Y C, YANG C K, et al. Association between risk factors of metabolic syndrome with lung function[J]. Eur J Clin Nutr, 2020, 74(5): 811–817.
[14] 卞宏, 朱述阳, 张晓娇. 阻塞性睡眠呼吸暂停低通气综合征发生日间高碳酸血症的相关因素分析[J]. 徐州医科大学学报, 2019, 39(12): 902–905.
Analysis of pulmonary function characteristics in patients with obstructive sleep apnea and obesity hypoventilation syndrome
Department of Respiratory Medicine, Nantong Third People’s Hospital, Nantong 226000, Jiangsu, China
To study the changes of pulmonary function in patients with obstructive sleep apnea (OSA) and obesity hypoventilation syndrome (OHS).Eighty-three adult obese patients admitted to Department of Respiratory Medicine, Nantong Third People’s Hospital from October 2020 to April 2022 were selected and divided into OHS group (26 cases), obese OSA group (47 cases) and simple obesity group (10 cases). The general data, parameters of polysomnography, arterial blood gas analysis and pulmonary function were compared among all groups.The apnea-hypopnea index of OHS group and obese OSA group were significantly higher than those of simple obesity group, lowest arterial oxygen saturation (LSaO2) and mean arterial oxygen saturation (MSaO2) at night were significantly higher than those of simple obesity group, and the longest apnea time and longest hypopnea time were significantly longer than that in simple obesity group (<0.05). The arterial partial pressure of oxygen (PaO2) in OHS group was significantly lower than that in obese OSA group and simple obesity group, arterial partial pressure of carbon dioxide (PaCO2) and HCO3-were significantly higher than those of obese OSA group and simple obesity group (<0.05). The percentage of forced expiratory volume in first second in predicted value (FEV1%), maximal voluntary ventilation (MVV) and forced expiratory flow during middle half of forced vital capacity (FEF) 50% in OHS group were significantly lower than those in obese OSA group and simple obesity group (<0.05). Correlation analysis showed that except FEV1/forced vital capacity (FVC), other pulmonary function parameters were positively correlated with PaO2and negatively correlated with PaCO2, MVV and FEF25% were positively correlated with LSaO2, FEV1/FVC was negatively correlated with the longest apnea duration, longest hypopnea time was negatively correlated with FEV1%, FEV1/FVC, MVV, FEF75%, FEF50%, FEF25% (<0.05).Patients with OHS are more likely than obese OSA to develop restrictive ventilation dysfunction and impaired small airway function, and the severity of impaired pulmonary function is associated with daytime hypoxia, carbon dioxide retention, sleep apnea at night, and low ventilation time.
Sleep-disorder breathing; Pulmonary function; Arterial blood gas analysis; Severity
R563.9
A
10.3969/j.issn.1673-9701.2023.19.011
(2022–09–13)
(2023–06–11)
南通市卫生健康委员会科研立项课题(QA2021042)
马青青,电子信箱:ma1211111012@qq.com

