守恒法在硝酸与金属的氧化还原反应中的应用
刘 娟
(江苏省射阳中学,江苏 盐城 224300)
守恒法是利用化学反应前后某些量的等量关系,如原子守恒、电子守恒、电荷守恒等构建方程式,进而分析得到正确答案的一种解题方法.守恒法作为高中化学计算过程中的重要解题方法,也是高考中常考的基础知识点,尤其常见于金属与酸的氧化还原反应中.基于此,本文以常见的铜与硝酸反应为例,讨论守恒法在金属与硝酸的氧化还原反应中的实际应用[1].
1 解题思路
1.1 原子守恒法
反应前所有的N只存在于HNO3中,反应后含N的物质包括HNO3的还原产物(假设有NO2、NO)和Cu(NO3)2,若HNO3过量,则过量HNO3中也含有N,则有
n(N)=n(NO2)+n(NO)+2n[Cu(NO3)2]+n(HNO3)(N原子守恒)
1.2 电子守恒法

1.3 电荷守恒法

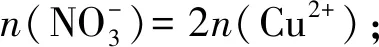

1.4 离子方程式计算法
2 实例分析
例题1 将Fe粉与Cu粉的混合物均分四等份,各自添加相同浓度的HNO3,等到充分反应之后,在标准状况下生成的NO的体积与剩余金属的质量见表1(假定硝酸的还原产物仅有NO).

表1 标准状况下生成的NO的体积与剩余金属的质量
则下列选项中错误的是( ).
A. ①中溶解了8.4 g Fe
B. 原混合物总质量为105.6 g
C.硝酸的浓度为4 mol/L
D.④中V=6 720 mL
解析A选项:①②有金属剩余,①②反应结束溶液中铁元素以Fe2+的形式存在,②在①的基础上反应,又加入100 mL的硝酸,消耗金属的质量为18 g-9.6 g=8.4 g,产生的气体体积为4480 mL-2240 mL=2240 mL,即n(NO)=0.1 mol,根据3M+8HNO3(稀)=3M(NO3)2+2NO↑+4H2O,此时消耗金属的物质的量为3×0.1 mol÷2=0.15 mol,M的摩尔质量为8.4 g÷0.15 mol=56 g/mol,①②之间消耗的铁,即①消耗的是铁,A不符合题意;
B选项:根据A的分析,消耗100 mL的硝酸,消耗8.4 g的Fe,因此一份合金的质量为18 g+8.4 g=26.4 g,即原混合物总质量为4×26.4 g=105.6 g,B不符合题意;
C选项:根据A的分析,100 mL溶液中含硝酸物质的量为8×0.1 mol÷2=0.4 mol,则硝酸的浓度为0.4 mol÷0.1L=4 mol/L,C不符合题意;

例题2在工业领域,由含铜废料(包括Cu、CuS、CuSO4等)制得硝酸铜晶体的步骤如图1所示.

图1 制备硝酸铜的流程
(1)“焙烧”在600℃时进行,写出CuS转化为CuO与SO4的化学式:____.
(2)写出“酸化”时反应的离子方程式____.
(3)“淘洗”所用的溶液可以是____(填字母).
A.稀硫酸 B.浓硫酸
C.稀硝酸 D.浓硝酸
(4)“反应”这一环节选择的试剂为20% HNO3与10% H2O2,反应环节不会出现红棕色气体,该反应的化学方程式为: ____.
(5)根据图2分析从“反应”所得溶液中析出Cu(NO3)2·3H2O的方法为____.

图2 硝酸铜晶体的溶解度
分析在工业领域,由含铜废料(带有Cu、CuS、CuSO4等)制备硝酸铜晶体,废料进入空气焙烧后铜制得氧化铜,硫化铜转换成CuO与SO2,添加硫酸酸化形成硫酸铜,添加过量的铁发生置换反应产生铜,通过过滤后产生滤渣铁与铜,经过冷水淘洗后添加20% HNO3与10% H2O2发生反应,蒸发浓缩,降温到略超过26.4℃出现结晶现象,由“反应”所得溶液中产生Cu(NO3)2·3H2O.
解析(1)CuS焙烧和氧气反应转化为CuO和SO2,反应的化学方程式为:
故答案为:
(2)废料进入空气焙烧后铜产生氧化铜,硫化铜转换成成CuO和SO2,加入硫酸酸化生成硫酸铜,反应化学方程式为:

离子方程式为:

故答案为:

(3)淘洗添加的酸应不具备强氧化性,不然就会使铜不断溶解.
A.稀硫酸,无法与铜反应,所以选择A;
B.浓硫酸与铜常温条件下不会发生任何反应,但遇到水溶解释放很多热,浓硫酸将与铜发生反应,所以不选B;
C.稀硝酸具备氧化性,会使铜发生氧化反应,所以不选C;
D.浓硝酸能与铜进行反应,所以不选D.
因此最终答案是:A
(4)“反应”这一步骤选择的试剂为20% HNO3与10% H2O2,硝酸作酸性条件,过氧化氢作为氧化剂,氧化铜生成硝酸铜,反应的化学方程式是:

所以,最终答案是:

(5)由图像中结晶水合物的溶解度随着温度变化曲线能够发现,温度超过26.4℃由“反应”所得溶液里产生Cu(NO3)2·3H2O,所得溶液里产生的Cu(NO3)2·3H2O方法为:蒸发浓缩,降温到略超过26.4℃出现结晶现象,所以答案是:蒸发浓缩,降温到略超过26.4℃时出现结晶现象[3].
总的来说,金属与硝酸的氧化还原反应作为高中化学中的常考题型,学生一定要灵活把握题目中的关键信息,抓住反应过程中的始态和终态,巧借守恒法构建等量关系,从而找到解题突破口.

