阿帕替尼联合TACE术治疗原发性肝癌患者的疗效评价
周连杰 张怀亮 张 丽 韩丽娜
开封市肿瘤医院 介入放射科 (河南 开封 475000)
原发性肝癌是一种高发性恶性肿瘤,主要发生于肝细胞或肝内的胆管细胞,每年新发病例占全球一半以上,但因为初期表现并不明显,多数患者确诊时已发展为中晚期、晚期,病死率极高,严重威胁患者生命安全[1]。目前肝动脉经导管动脉栓塞化疗(TACE)是治疗晚期原发性肝癌的有效方法,但存在无法根治、多次复发、长期疗效不高等问题,给患者带来很大的困扰[2]。阿帕替尼是一种小分子型的多靶点靶向药物,能够有效对肿瘤组织的构建过程进行抑制,同时可阻碍肿瘤部位的血管形成,进而达到一定的抗肿瘤目的,临床上主要将其用于治疗胃腺癌、肝细胞癌等病症[3]。近年来以阿帕替尼为主要药物的抗癌治疗方案受到临床的广泛关注。本研究主要探讨阿帕替尼联合TACE术治疗原发性肝癌的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料本研究已经由院内所设置的医学伦理委员会部门审批。回顾性分析本院2017年1月至2019年1月收治的102例原发性肝癌患者的临床资料,根据不同的治疗方法将其分为对照组(51例)和观察组(51例)。对照组:男29例,女22例,年龄46~71岁,平均(60.98±4.88)岁;体重指数18~24kg/m2,平均体重指数(22.13±1.38)kg/m2。观察组:男30例,女21例,年龄45~72岁,平均(62.08±4.52)岁;体重指数18~24kg/m2,平均体重指数(21.93±1.24)kg/m2。对两组以上所描述的基线资料使用统计学软件进行比较后可发现,P>0.05,提示其数据差异在无统计学意义,故两组可进行后续比较。纳入标准:符合《原发性肝癌诊疗规范(2017年版)》[4]中诊断标准者;预计生存时间>3个月者;精神状态与语言沟通能力正常者等。排除标准:严重肝、心功能障碍者;凝血功能失调者;心脑血管疾病者;中途放弃研究或随访脱落者等。
1.2 方法对照组行TACE治疗,以改良Selding er技术经皮股动脉穿刺造影插管方式,在DS引导下进行腹腔内干动脉、经皮肠系膜动脉下腔上门和动脉血管造影等超声检查,精确判断两组患者肿瘤部位、大小、数量与分布状态等临床影像信息,随后将导管放入两组患者的脑供氧动脉血管腔壁中,向导管及其导管口内分别均匀滴注射奥沙利铂50mg、5-氟尿喀啶1000mg,8.0%碘化油10~20mL制成的混合乳化物进行栓塞,术中可根据肿瘤情况,选择性添加明胶海绵,以确保供血动脉栓塞满意。术后给予常规的抗炎保肝等对症治疗。观察组在对照组基础上,联合阿帕替尼(江苏恒瑞医药股份有限公司,国药准字H20140103,规格:250mg/片)口服治疗,术后第1d开始500mg/次,1次/d;用药期间,患者若出现严重的不良反应时可适当减少用量至250mg/d,症状缓解之后可逐渐恢复至原剂量;治疗3个月后来院复查,根据客观缓解率调整治疗方案或用药剂量。两组患者均以4周为1个周期,持续治疗3个周期,并随访3年。
1.3 观察指标(1)客观缓解率:统计两组患者治疗后的客观缓解率。完全缓解:经CT扫描图像显示病灶组织完全坏死;部分缓解:经CT扫描图像显示病灶组织坏死范围缩小>80%;病情稳定:经CT扫描图像显示病灶组织坏死范围缩小50~79%,且经观察短期病灶无进展;进展:经CT扫描图像显示出现新病灶或病灶增大。客观缓解率=完全缓解率+部分缓解率+病情稳定率。(2)血清肿瘤标志物:甲胎蛋白(AFP)、癌胚抗原(CEA)。分别在治疗前和治疗后,采集两组空腹静脉血4mL,待其凝固后,进行离心(转速:3000r/min,时间:10min),而后得到血清,采用全自动化学发光免疫分析仪检测血清AFP、CEA水平。(3)肝功能评价指标:使用丙氨酸底物法,将丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(生产厂家:北京九强生物技术有限公司,编号:20162400544)严格按照说明书处理后进行ALT检测;采用磁微粒化学发光法,将血清甲胎蛋白(alpha-fetoprotein,AFP)试剂盒(生产厂家:郑州安图生物工程股份有限公司,编号:20153400055)严格按照说明处理后测定AFP;使用改良JENDRASSIK-GROF微板法,严格按照说明书将总胆红素(total bilirubin,TBIL)检测试剂盒(生产厂家:北京九强生物技术有限公司,编号:20020023)处理后测定TBIL值。(4)无进展生存时间、生存率。统计两组治疗后的无进展生存时间与随访3年后的生存率。
1.4 统计学方法数据进行计算与分析的软件为SPSS 21.0。计量资料用t进行检验以(±s)表示,计数资料用χ2进行检验以[例(%)]表示,经计算,P<0.05,提示其数据差异在统计学研究中,有意义。
2 结 果
2.1 客观缓解率治疗后,观察组患者的客观缓解率82.35%较对照组的47.06%相比,更高(P<0.05),见表1。
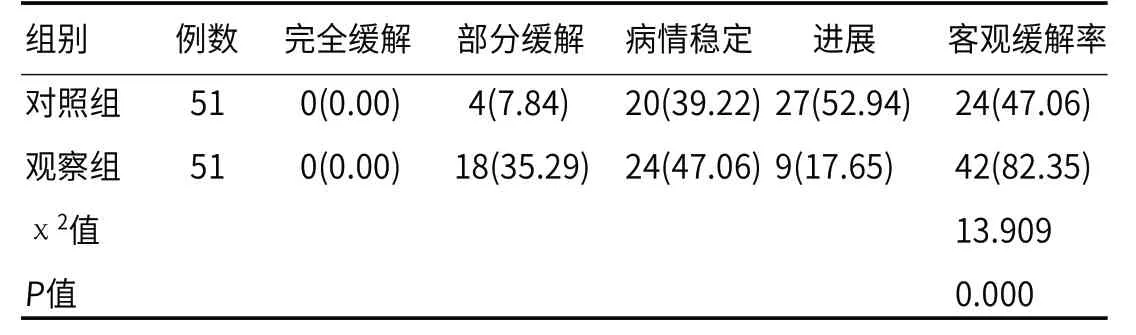
表1 客观缓解率[例(%)]
2.2 血清肿瘤标志物水平相较于治疗前,治疗后两组患者血清AFP、CEA水平均降低,且较对照组相比,观察组更低(均P<0.05),见表2。
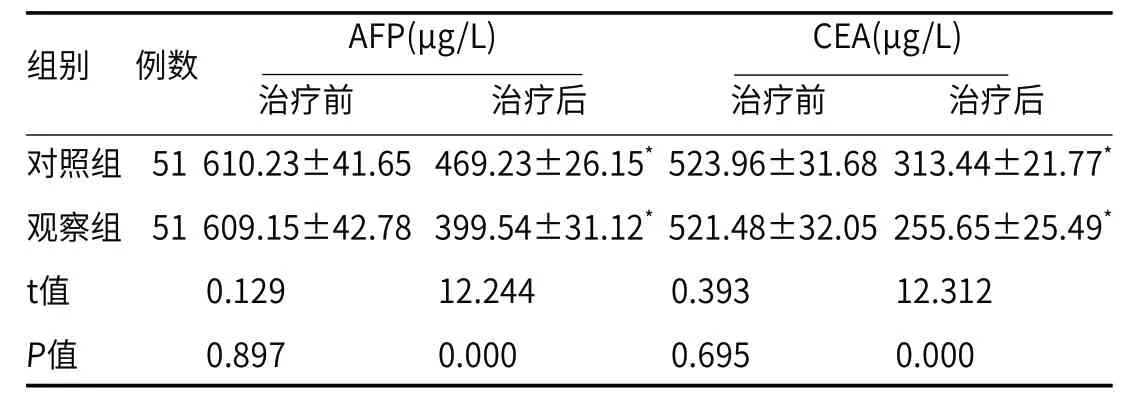
表2 血清肿瘤标志物水平
2.3 肝功能相较于治疗前,治疗后两组患者血清TB、ALT水平均升高(均P<0.05),组间差异没有统计学意义(均P>0.05),见表3。
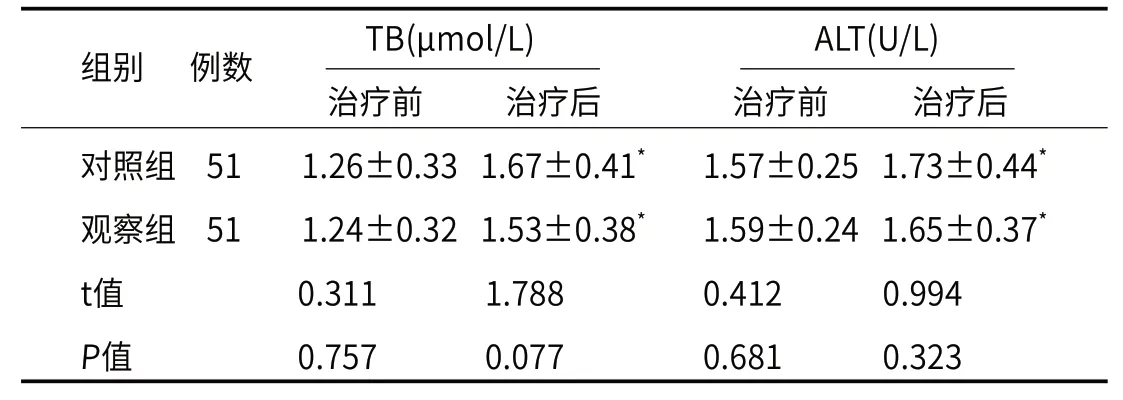
表3 肝功能
2.4 无进展生存时间、生存率治疗后,对照组无进展生存时间(6.32±1.15)个月,观察组为(6.37±1.12)个月,两组比较差异无统计学意义(t=0.222,P>0.05);随访3年后,观察组生存率94.12%(48/51)高于对照组的78.43%(40/51)(χ2=5.299,P<0.05)。
3 讨 论
原发性肝癌多发于过量饮酒、感染肝炎病毒、肝癌家族史等人群,且近年来其发病率逐年升高,严重威胁患者的生命健康。由于早期症状较轻,患者并不重视,因此往往错过最佳治疗时间。TACE能够阻断肿瘤供血,并持续释放较高浓度的化疗药物,进而抑制肿瘤组织的生长,但在治疗过程中会影响患者的肝功能,常出现腹泻、发热、食欲不佳等综合征,总体治疗效果不佳[5]。
阿帕替尼具有高度选择性的特点,可通过抑制肿瘤新生血管组织的生成而发挥一定的抗肿瘤作用,同时能够有效避开其他血管靶向小分子抑制剂的脱靶效应,可用于原发性肝癌的综合治疗,利于降低肿瘤微血管密度,进而抑制肿瘤生长,提升其缓解率,减轻患者病情[6-7]。TB和ALT水平是反映肝功能的标志物,与治疗前相比,治疗后两组患者的TB和ALT水平均升高,说明TACE术会对患者的肝功能造成一定损伤,观察组略低于对照组,说明阿帕替尼可起到改善机体肝功能的作用。另外,进入机体循环的阿帕替尼主要经由肝酶分解代谢,部分晚期患者肝脏储备功能较差,体内阿帕替尼的代谢过程可受到一定影响,进而对不良反应的耐受程度有所欠缺。临床上可根据患者的实际情况为其制定最佳的个体化治疗方案,从中小剂量开始进行治疗,减轻患者的不良反应,提升用药依从性。本研究结果显示:治疗后组间的TB和ALT水平无显著差异,观察组的客观缓解率高于对照组,提示阿帕替尼联合TACE术可有效提高原发性肝癌患者的客观缓解率、无进展生存率,改善肝功能,与杨庆等[8]研究一致。
血清中的肿瘤标志物水平变化与恶性肿瘤细胞增殖有较为密切的关系,其能够对肝癌组织的特异性及恶性程度进行有效判断。AFP主要存在于胚胎组织中,其在一般机体组织中的浓度相对较低,但癌症细胞的活化能够产生大量的AFP,并随着病变组织逐渐生长,在一般恶性肿瘤组织中的水平相对较高;CEA是肿瘤指标的一种,若其水平持续升高表明肿瘤细胞活性增强,可以作为一些肿瘤预后和复发评估的指标之一[9]。阿帕替尼能够纠正肿瘤细胞因子、刺激因子及血管内皮生长因子的异常分泌与表达,调控多项凋亡促进基因与凋亡抑制基因的表达,稳定病灶周围的代偿性侧支循环,进而降低肿瘤病灶的复发、转移概率,利于患者的预后恢复。本研究结果显示,治疗后观察组的血清AFP、CEA水平均低于对照组,无进展生存率高于对照组,提示阿帕替尼联合TACE术可有效稳定原发性肝癌患者各项血清肿瘤标志物水平,提高生存质量,与赵凯等[10]研究一致。
综上所述,阿帕替尼联合TACE术治疗原发性肝癌可有效缓解患者的病情,提高生存机率,稳定各项血清肿瘤标志物水平,改善肝功能。
——评《卵巢恶性肿瘤诊疗手册》

