阿克苏野生牛肝菌多糖提取优化及不同组分抗氧化活性分析
冯 倩,何 齐,李 雪,易鸳鸯,孙 建,朱 静,顾美英,谭慧林,张志东,
0 引 言
【研究意义】新疆阿克苏地区位于天山南麓,杨树资源丰富,每年的7~9月大量牛肝菌子实体成熟,有关该地区野生牛肝菌相关研究报道较少。多糖是牛肝菌中的主要次生代谢产物之一,加大对相关牛肝菌多糖的提取和功能评价,对于进一步开发和利用阿克苏地区野生牛肝菌资源具有重要意义。【前人研究进展】蘑菇多糖提取一般采用水提醇沉,其中,随着乙醇浓度的增加,不同组分多糖的相对分子质量降低,抗氧化活性增强[1]。同时,乙醇分级沉淀可使分子量大小有差别的多糖在浓度不同的乙醇中析出,获得不同组分多糖,表现出不同活性[2]。【本研究切入点】目前,有关阿克苏野生牛肝菌鲜有报道,为皱皮疣柄牛肝菌(Leccinumduriusculum)[3],其多糖的提取和理化特性、抗氧化活性等尚无报道。需研究野生牛肝菌多糖提取优化及不同组分抗氧化活性分析。【拟解决的关键问题】采用热水提取法,优化牛肝菌粗多糖最佳工艺条件,研究不同醇沉多糖组分的水溶性、持水力、粘度及体外抗氧化活性,为野生牛肝菌的进一步开发利用提供依据。
1 材料与方法
1.1 材 料
野生牛肝菌,采自阿克苏市拜城县赛里木镇(E 82°11′55",N 41°47′10")。新鲜牛肝菌子实体经清洗干净后切片,80℃烘干6 h,粉碎,过60目筛,备用。 图1

图1 阿克苏杨树林下野生牛肝菌
1.2 方 法
1.2.1 粗多糖提取的初始条件
称取一定量的牛肝菌子实体粉末,以水为提取液,按料液比1∶ 20,80℃下提取2 h后,8 000 r/min,离心5 min,收集上清液,加入无水乙醇至终浓度为80%,于4℃静置过夜,以6 000 r/min,离心5 min,收集沉淀,并将沉淀用80%乙醇洗涤两次;于-80℃冷冻干燥,得到牛肝菌粗多糖。
多糖提取率(%)=(多糖质量/菌粉质量)×100%。
(1)
1.2.2 多糖含量测定
多糖含量测定采用“苯酚-硫酸法”[4],以葡萄糖为标准品制作标准曲线。
1.2.3 牛肝菌粗多糖提取的工艺优化
1.2.3.1 单因素试验
选取料液比、浸提温度和浸提时间为因素,分别分析不同料液比(1∶ 20、1∶ 25、1∶ 30、1∶ 35、1∶ 40 g/mL)、不同浸提温度(50、60、70、80、90℃)和不同浸提时间(1、2、3、4、5 h)对野生牛肝菌总多糖提取率的影响。在每个因素不同处理中,除了考察的单因素数值变动外,其他考察因素取固定值。
1.2.3.2 正交试验
在单因素实验的基础上,选取料液比(A)、提取温度(B)和提取时间(C)3个因素,设置L9(33)正交试验,优化提取工艺。表1
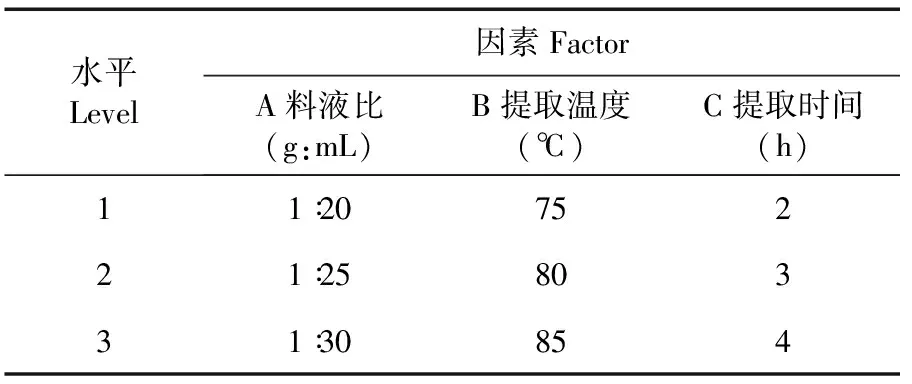
表1 牛肝菌粗多糖提取条件优化正交试验因素与水平
1.2.4 牛肝菌不同组分多糖的制备
取一定量的粗多糖,充分溶解于水中,配制成一定浓度的多糖溶液,加入无水乙醇使体系终浓度达到40%,于 4℃ 醇沉过夜,6 000 r/min离心5 min,收集下层沉淀,获得LD-40多糖。向处理后的上清液中继续添加无水乙醇,使体系终浓度为80%,于4℃冰箱醇沉过夜,6 000 r/min 离心5 min,收集下层沉淀,获得LD-80多糖。将获得的LD-40和LD-80冷冻干燥,备用,计算各多糖组分提取率。
1.2.5 多糖水合特性的测定
1.2.5.1 水溶性
参照文献方法[5],准确称取0.2 g不同组分粗多糖样品,置于50 mL的烧杯中,再加入20 mL的去离子水, 90℃连续搅拌水浴30 min,水浴结束后,6 000 r/min,离心10 min,取上清液,于105℃烘干至恒重,记录质量,计算多糖的水溶性。

(2)
式中,M0表示烘干后固体的质量,M表示样品质量。
1.2.5.2 持水力(WHC)测定
参照文献方法[6]略做修改,准确称取0.2 g不同组分多糖样品,于50 mL的离心管中,加入40 mL的蒸馏水,振荡摇匀后室温静置24 h,转速为6 000 r/min条件下离心10 min,去除上清液,并使用滤纸吸取沉淀中的剩余水分,然后称量沉淀重量并作记录。

(3)
式中,M1表示样品恒重后的质量,M表示样品质量。
1.2.5.3 粘度测定
分别配制浓度为5、10、20 mg/mL的2种多糖组分溶液各30 mL,置于烧杯中,使用SNB-2数字式粘度计测定,采用3号转子,转速为12 r/min,室温测定,记录数据。
1.2.6 不同多糖组分的抗氧化试验
1.2.6.1 DPPH 自由基清除率测定
参照文献方法[7]略作修改,以水溶性VC作阳性对照,蒸馏水作空白对照。加不同浓度的多糖溶液,再加0.1 mmol/L 的DPPH溶液,涡旋混匀。避光反应0.5 h,5 000 r/min,离心5 min,用酶标仪于517 nm处测定吸光度值。以上步骤3个平行,取均值。

(4)
式中,A0表示空白对照的吸光度值;A1表示样品的吸光度值。
1.2.6.2 羟自由基清除率测定
参考文献[8]方法略作修改,以水溶性VC作阳性对照,蒸馏水作空白对照。加入不同浓度的多糖溶液, 9 mmol/L FeSO4,9 mmol/L水杨酸无水乙醇,8.8 mmol/L H2O2,涡旋混匀,37℃反应0.5 h,5 000 r/min,离心5 min,用酶标仪测定510 nm处吸光度值,以上步骤3个平行,取均值。

(5)
式中,A0表示空白对照的吸光度值;A1表示样品的吸光度值;A2表示蒸馏水替代H2O2的吸光值。
1.2.6.3 还原能力测定
参考文献[9]方法,配制不同浓度多糖溶液,将0.2 mol/L PBS(pH=6.6)和多糖溶液混匀,再加入1%(W/V)的铁氰化钾溶液,涡旋混匀后50℃水浴保温30 min,流水冷却后加入10%(W/V)的三氯乙酸,混匀后10 000 r/min,离心5 min,取上清液,加入蒸馏水和0.1%的氯化铁,静置10 min,700 nm比色,记录其吸光度值。
1.3 数据处理
使用Excel2019整理数据, 用SPSS.25对试验数据进行分析。
2 结果与分析
2.1 多糖测定标准曲线的绘制
研究表明,以葡萄糖含量为横坐标、吸光度值(A)为纵坐标绘制标准曲线,得出线性回归方程为y=7.256 5x-0.005 3,R2=0.999 1,标准曲线呈现良好的线性关系。图2

图2 多糖测定工作曲线
2.2 牛肝菌粗多糖提取工艺单因素
2.2.1 提取温度对多糖得率的影响
研究表明,在提取时间为2 h,料液比为1∶ 20的条件下,多糖得率与提取温度之间存在正相关关系,即随着温度的增加多糖的提取率也增加,其中80℃时多糖得率为9.9%,90℃时得率最高,达到 10.72%,仅较80℃时多糖得率高出0.82%,后续试验选取80℃。图3
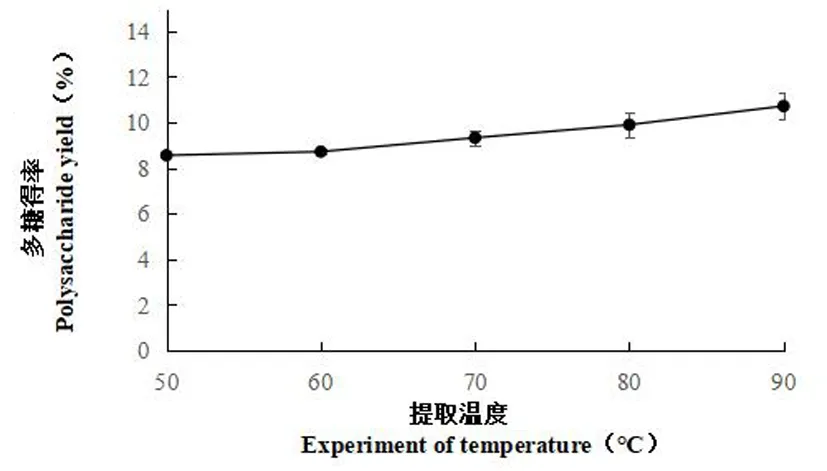
图3 不同提取温度下多糖得率变化
2.2.2 提取料液比对多糖得率的影响
研究表明,在浸提时间为 2 h、提取温度为80℃的条件下,料液比1∶ 20~1∶ 30,多糖得率明显上升,到1∶ 30时到达顶峰,水量增多有助于多糖的扩散传质,当料液比超过1∶ 30后,多糖得率反而下降。选取1∶ 25为较好料液比。图4
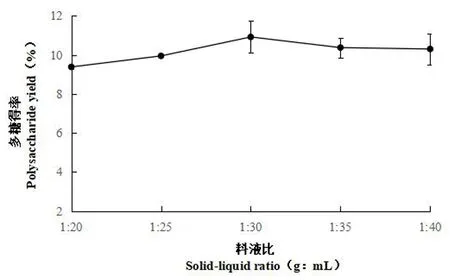
图4 不同料液比下多糖得率变化
2.2.3 提取时间对多糖得率的影响
研究表明,在料液比为1∶ 25,提取温度为80℃的条件下,随着浸提时间的增加而增加,但上升速率较慢,在1 h时多糖得率为10.00%,继续延长提取时间到4 h时得率最高为11.54%,再增加提取时间对多糖的提取率基本不变,而提取时间的延长也会导致能源消耗增加,以提取时间2、3、4 h作为正交试验中的试验参数。图5

图5 不同提取时间下多糖得率变化
2.3 牛肝菌多糖提取的正交设计试验
研究表明,对多糖提取率的影响较大的因素是提取时间,其次是提取温度,料液比对多糖提取率的影响最小。 A2B1C2,即料液比1∶ 25,温度75℃,时间3 h,多糖得率最高可达到12.92%。最佳提取条件为A3B2C2,即料液比1∶ 30,温度80℃,时间3 h。多糖得率最高为13.36%。表2
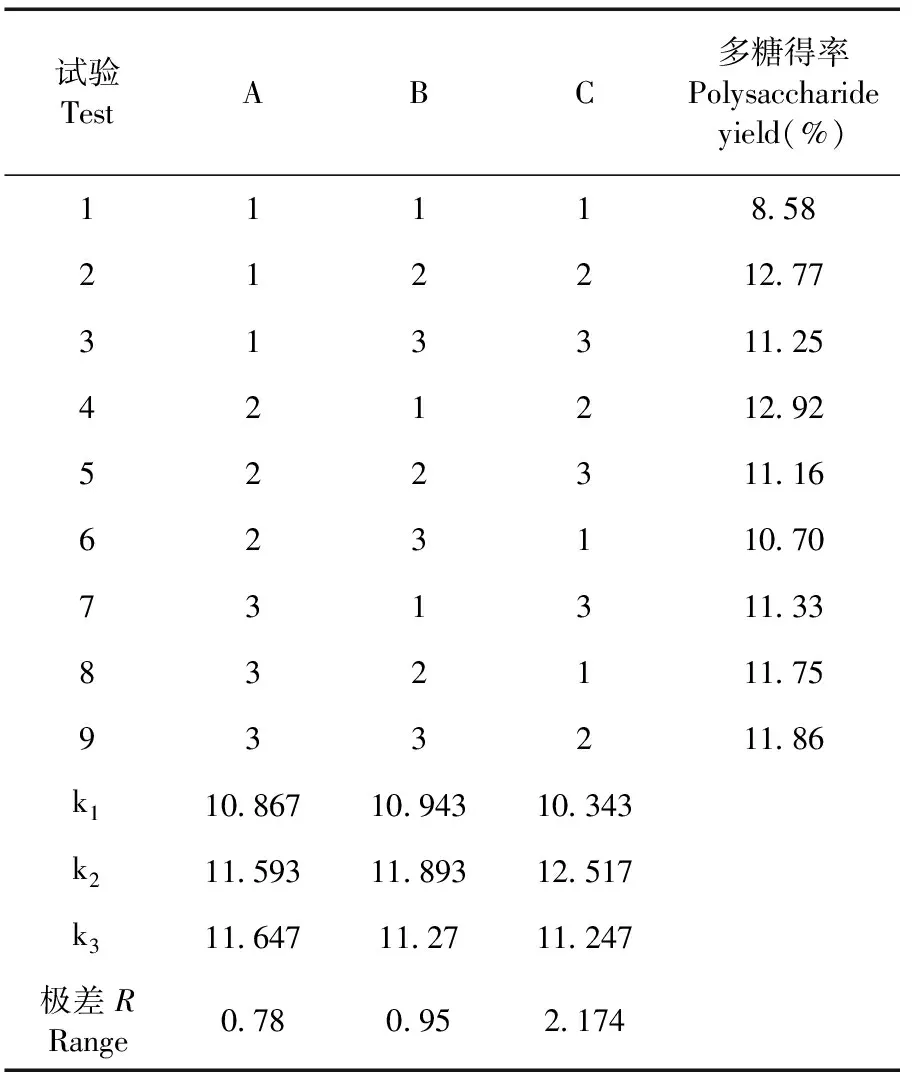
表2 牛肝菌粗多糖提取正交试验
2.4 不同多糖组分水溶性和持水力
研究表明,采用终浓度40%无水乙醇,获得LD-40多糖。继续添加无水乙醇,使体系终浓度为80%,获得LD-80多糖。通过干燥后计算,LD-40和 LD-80的占野生牛肝菌多糖的92.37%、7.63%。
LD-40持水力大于LD-80,而LD-80的水溶性强于LD-40,小分子多糖较大分子多糖易溶解。 表3

表3 不同多糖组分的水合性质
2.5 不同多糖组分的粘度
研究表明,两种多糖组分的粘度均随着多糖浓度的升高而高,且在相同浓度下,LD-40粘度明显强于LD-80,当多糖浓度达到20 mg/mL时,LD-40粘度最大为1 059 mPa.s,而LD-80粘度仅为573.6 mPa·s,LD-40粘度约为LD-80的2倍。图6

图6 不同浓度下各多糖组分粘度变化
2.6 体外抗氧化试验
2.6.1 DPPH 自由基清除试验
研究表明,当有清除自由基的物质存在时,溶液会从最初的紫色变为稳定的黄色,其褪色程度与抗氧化能力成正相关。两种多糖随着质量浓度的升高而上升,相同浓度下LD-80对 DPPH 自由基的清除能力明显高于LD-40,在多糖浓度为10 mg/mL时,LD-80对DPPH 的清除作用最高达到 48%。图7

图7 不同浓度下各多糖组分对
2.6.2 羟基自由基清除试验
研究表明,在 1.25~10 mg/mL 范围内,LD-40和 LD-80两种组分对羟自由基的清除能力都随着质量浓度的升高而上升,相同浓度下LD-80对羟基自由基的清除作用强于LD-40,但远低于同等浓度下VC的清除能力。图 8
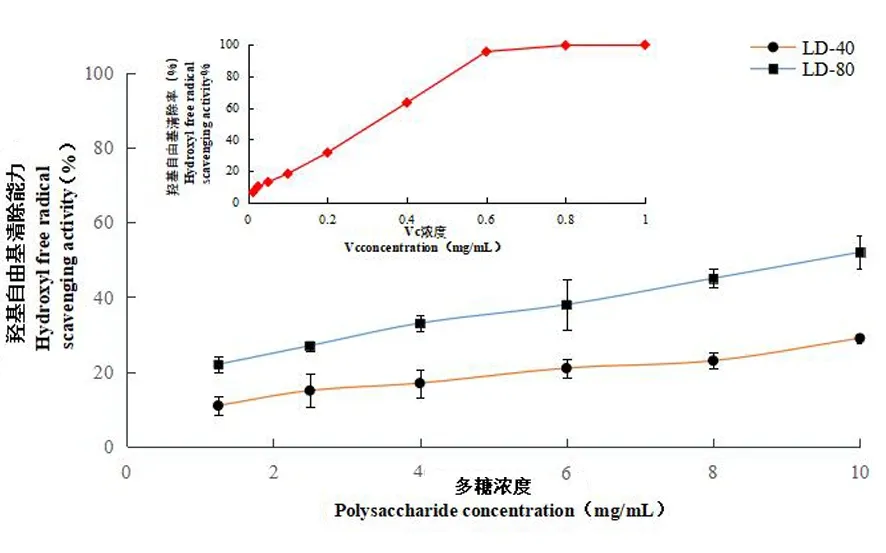
图8 不同浓度下各多糖组分对
2.6.3 还原能力试验
研究表明,与清除 DPPH自由基和清除羟基自由基能力相似,在 1.25~10 mg/mL 的质量浓度范围,2种多糖组分的还原能力均随着质量浓度的升高而上升,当浓度达到8 mg/mL以后两者增长均不明显。最高浓度10 mg/mL时,LD-80吸光度值最高可达1.02,而LD-40仅为0.27,尽管LD-80还原能力明显强于LD-40,但其远低于同等浓度下VC的还原能力。图9

图9 不同浓度各多糖组分的还原能力
3 讨 论
DPPH 自由基是一种极为稳定的自由基,在它接受氢自由基或电子后,会变成稳定的基团分子[10]。一般还原能力越强,其抗氧化能力越强[11,12]。蘑菇多糖普遍具有抗氧化[13]、降血糖[14]、免疫调节[15]、保肝[16]等多种生物活性。目前,热水提取法是多糖提取中应用最为广泛也是操作最为简单的一种方法,具有设备简单,易于操作,成本低廉的特点[17],且不会对天然活性物质多糖的结构及活性产生过多影响,有利于后续试验的进行[18]。试验通过水提法提取野生牛肝菌多糖,优化了提取工艺,使多糖得率达到13.36%,显著比杜敏华等[19]提取的野生牛肝菌多糖得率高出了4.23%,阿克苏野生牛肝菌更富含多糖。
研究获得了LD-40和LD-80,分别占粗多糖的92.3%、7.63%,野生牛肝菌可用较低浓度乙醇就可以获得绝大部分多糖 。在相同浓度下,LD-40粘度和持水力均强于LD-80,原因可能是与多糖的分子量有关,乙醇体积分数越高,多糖分子量越小[20]。LD-40为大分子多糖,其粘度也较高的现象;但LD-80为小分子多糖,易溶解,所以水溶性较高。多糖的持水性等物理性质常作为评价食品加工过程中物质的口感、质地和风味的重要指标,高粘度的多糖可作为增稠剂或胶凝剂,用于调整食品的流动性、可塑性和口感。酸奶中添加多糖会增加酸奶粘稠度,并且多糖的生物功能与其理化组成、水溶性、粘度等紧密相关[23]。在食品加工时可优先选择LD-40组分作为增稠剂。
不同菌蘑多糖其抗氧化功能存在明显的差异,如红托竹荪菌托多糖的抗氧化能力最佳,香菇多糖次之,黑木耳多糖最差[24]。长白山野生牛肝菌的抗氧化能力也较强,多糖浓度在0.8 mg/mL下清除羟基自由基能力达到96.82%[25]。研究中不同组分多糖抗氧化活性具有明显差异,LD-80体外抗氧化能力优于LD-40,但当LD-80浓度达到10 mg/mL 时,其清除DPPH和OH-自由基能力也仅达到48% 和 52% ,远低于一般菌多糖抗氧化能力,与报道的皱盖疣柄牛肝菌多糖[7]抗氧化能力相当。
4 结 论
4.1野生牛肝菌粗多糖最佳提取工艺为料液比1∶ 30,温度80℃,时间3 h,最佳工艺条件下,得出多糖得率为13.36%。
4.2采用分级醇沉的方法获得了不同牛肝菌多糖提取物LD-40和LD-80 ,两种多糖组分LD-40 和 LD-80分别占粗多糖的92.37%、7.63%。
4.3两种多糖表现出不同的特性,其中 LD-40的粘度及持水力均强于LD-80。两种多糖抗氧化能力均较弱,但LD-80抗氧化活性远高于LD-40。

