体外模拟消化对黑果腺肋花楸叶片抗氧化及抑制糖消化酶活性影响
石志娇,韦桂芳,何旭华,徐涵,彭小伟,阚欢,2*,刘云,2*
1(西南林业大学 生命科学学院,云南 昆明,650224) 2(云南省高校大健康类森林资源开发利用工程研究中心,云南 昆明,650224)
黑果腺肋花楸(Aroniamelanocarpa)又称黑果花楸、野樱莓、不老莓,为蔷薇科腺肋花楸属落叶灌木,原产于北美东北部,波罗的海至太平洋沿岸均有分布[1]。黑果腺肋花楸的果实和叶片中均富含多种生物活性化合物,两者皆有非常重要的食用价值和药用价值[2],对健康具有很好的促进作用。近年来,很多学者对黑果腺肋花楸药理作用进行了研究,发现其富含多酚和黄酮等活性成分[3-4],具有抗氧化[5]、降血压[6]、抑癌[7]、调节肠道菌群[8]等功效,因此,黑果腺肋花楸具有较大的开发价值。
对于食品原料中活性成分的研究大多集中在其化学结构的分析与鉴定以及对其生理功能的探索[9-10]。然而,活性成分的生理功能受到其在人体内消化吸收过程的影响。与体内消化技术相比,体外模拟消化是一种通过设定与动物体内相近的pH环境和消化酶体系进行消化的实验,可以很好地模拟食物进入人体消化道后的变化情况,这种技术具有成本低、周期短、且重复性高等优点[11]。
目前,对于黑果腺肋花楸的研究主要集中于果实,对其叶片的相关研究鲜有报道。因此,本研究采用体外模拟消化技术,对黑果腺肋花楸叶片进行消化,考察了消化前后多酚和黄酮释放情况及抗氧化、抑制糖消化酶活性的变化规律,以期为后续黑果腺肋花楸叶片在体内真实消化情况的研究提供理论依据和实验参考,也为其进一步开发利用提供新思路。
1 材料与方法
1.1 材料与试剂
黑果腺肋花楸叶片,采自辽宁省瓦房店市驼山镇前大地村。
没食子酸、芦丁、福林酚、α-淀粉酶(10 000 U/g)、α-葡萄糖苷酶(700 000 U/g)、胃蛋白酶(3 000 U/g)、胰蛋白酶(250 U/g)、纤维素酶(50 U/mg)、猪胆盐,上海源叶生物科技有限公司;DPPH、ABTS,合肥博美生物科技有限责任公司;可溶性淀粉、磷酸二氢钾(KH2PO4),分析纯,广东光华科技股份有限公司;磷酸氢二钠(Na2HPO4),分析纯,天津市大茂化学试剂厂;氢氧化钠(NaOH)、盐酸(HCl),分析纯,天津市风船化学试剂科技有限公司。
1.2 仪器与设备
YB-250A高速多功能粉碎机,永康市速锋工贸有限公司;HH-2数显恒温水浴锅,常州国华电器有限公司;DGH-9140A数显电热鼓风干燥箱,上海一恒科学仪器有限公司;SG5200HDT超声波清洗器,上海冠特超声仪器有限公司;YXFT3MP pH计,上海梅特勒-托利多精密仪器有限公司;UV-2600紫外可见分光光度计,苏州岛津仪器有限公司;SpectraMax190酶标仪,上海美谷分子仪器有限公司;THZ-82A数显恒温振荡器,常州朗越仪器制造有限公司;TG16-WS离心机,湖南迈克尔实验仪器有限公司。
1.3 实验方法
1.3.1 黑果腺肋花楸叶片粗提物制备
参照向卓亚等[12]的方法略作修改。准确称取1.0 g黑果腺肋花楸叶片粉末,加入10 mL甲醇,40 ℃超声提取30 min,8 000 r/min离心10 min,取上清液,重复提取2次,合并提取液,定容到40 mL置于4 ℃冰箱作为未消化样液进行后续指标测定。
1.3.2 体外模拟口腔、胃、小肠、大肠消化
参照QIN等[13]的方法和陈壁等[11]的方法略作修改,对黑果腺肋花楸叶片粉末进行体外模拟消化。
准确称取1.0 g黑果腺肋花楸叶片粉末置于离心管中,加入40 mL蒸馏水,调pH值至6.9,加入2 mL α-淀粉酶溶液,37 ℃恒温振荡20 min,8 000 r/min离心10 min,取上清液(口腔消化液)备用。向残渣中加入40 mL蒸馏水,调pH值至2.0,加入2 mL胃蛋白酶溶液,37 ℃恒温振荡2 h,8 000 r/min离心10 min,取上清液(胃消化液)备用。继续向残渣中加入38 mL蒸馏水,调pH值至7.4,加入2 mL胰蛋白酶和2 mL猪胆盐溶液,37 ℃恒温振荡2 h,8 000 r/min离心10 min,取上清液(小肠消化液)备用。向最后的残渣中加入40 mL蒸馏水,调pH值至4.0,加入0.2 mL纤维素酶,37 ℃恒温振荡2 h,8 000 r/min离心10 min,取上清液(大肠消化液)备用。
1.3.3 多酚、黄酮释放量测定
多酚含量测定采用福林酚法[14],以没食子酸为标准品在760 nm处测得的吸光度(y1)对浓度(x1)进行回归,得到回归方程为y1=0.027 57+2.026 57x1,R12=0.999 1,以此进行样品中多酚含量测定。样品中多酚的释放量按公式(1)计算。
黄酮含量测定采用亚硝酸钠法[15],以芦丁为标准品在510 nm处测得的吸光度(y2)对浓度(x2)进行回归,得到回归方程为y2=0.041 48+5.546 37x2,R22=0.999 2,以此进行样品中黄酮含量测定。样品中黄酮释放量计算如公式(1)所示:
(1)
式中:P为样品中多酚、黄酮的释放量,mg/g;C为根据标准曲线方程集散得到的样品中标准品质量浓度,mg/mL;V为提取液体积,mL;n为稀释倍数;M为样品质量,g。
1.3.4 体外抗氧化能力测定
1.3.4.1 DPPH自由基清除能力测定
参考LI等[16]的方法适当调整。配制质量浓度为0.05 mg/mL DPPH-乙醇溶液,分别取不同消化样液和DPPH-乙醇溶液等体积混合,暗反应30 min,在517 nm处测定吸光值。比较不同消化样液对DPPH自由基清除能力。清除能力计算如公式(2)所示:
(2)
式中:A1为实验样品组的吸光值;A2为以乙醇代替DPPH-乙醇溶液测定的吸光值;A0为以蒸馏水代替样品液测定的吸光值。
1.3.4.2 ABTS阳离子自由基清除能力测定
参考ZHANG等[17]的方法适当调整。配制ABTS储备液,用前以蒸馏水稀释,调节吸光值至0.700(±0.02)作为ABTS工作液。分别取不同消化样液和ABTS工作液于96孔酶标板均匀混合,暗反应6 min,在734 nm测定吸光值。比较不同消化样液对ABTS阳离子自由基清除能力。清除能力计算如公式(3)所示:
(3)
式中:A1为实验样品组的吸光值;A2为以蒸馏水代替ABTS工作液测定的吸光值;A0为以蒸馏水代替样品液测定的吸光值。
1.3.4.3 羟自由基清除能力测定
参照LI等[18]的方法适当调整。分别取不同消化样液、9 mmol/L FeSO4溶液、9 mmol/L水杨酸-乙醇溶液、8.8 mol/L H2O2等体积加入96孔酶标板,37 ℃避光反应1 h后在波长510 nm处测定吸光值。比较不同消化样液对羟自由基清除能力。清除能力计算如公式(4)所示:
(4)
式中:A1为实验样品组的吸光值;A2为以蒸馏水代替H2O2测定的吸光值;A0为以蒸馏水代替样品液测定的吸光值。
1.3.4.4 铁离子还原能力测定
参照师聪等[19]的方法适当调整。分别取不同消化样液、pH 6.6的PBS缓冲溶液、10 g/L铁氰化钾等体积混合均匀后于50 ℃水浴20 min,加入100 g/L三氯乙酸摇匀,取上清液于96孔酶标板,同时加入适量的蒸馏水和1 g/L三氯化铁混合静置10 min,在700 nm处测定吸光值表示铁离子还原能力。
1.3.5 抑制糖消化酶活性测定
1.3.5.1 α-葡萄糖苷酶抑制率测定
参照朱延胜等[20]的方法并稍作改动。取不同消化样液于96孔酶标板中,加入α-葡萄糖苷酶于37 ℃水浴10 min,加入pH 6.8的4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl α-D-glucopyranoside,PNPG)同温度下反应20 min,用1 mol/L Na2CO3溶液终止反应后于405 nm处测定其吸光值。α-葡萄糖苷酶抑制率计算如公式(5)所示:
(5)
式中:A1为实验样品组的吸光值;A2为以pH 6.8的PBS缓冲溶液代替α-葡萄糖苷酶测定的吸光值;A0为以蒸馏水代替样品液测定的吸光值。
1.3.5.2 α-淀粉酶抑制率测定
参照AKHTAR等[21]的方法并稍作改动。取不同消化样液于1.5 mL离心管中,加入α-淀粉酶于37 ℃水浴10 min,加1 g/L的可溶性淀粉溶液同温度下孵育10 min,取出加入二硝基水杨酸(3,5-dinitrosalicylic acid,DNS),沸水浴5 min,加适量蒸馏水冷却至室温后于540 nm测定其吸光值。α-淀粉酶抑制率计算如公式(6)所示:
(6)
式中:A1为实验样品组的吸光值;A2为以pH 6.9的PBS缓冲溶液代替α-淀粉酶测定的吸光值,A0为以蒸馏水代替样品液测定的吸光值。
1.4 数据分析
采用Excel 2010、Origin 2018软件进行数据分析,GraphPad Prism 8软件进行图形绘制。P>0.05表示差异不显著,P<0.05表示差异较显著,P<0.01表示差异显著,P<0.001表示差异极显著,P<0.000 1表示差异极极显著。所有实验均重复3次,结果以(平均值±标准偏差)表示。
2 结果与分析
2.1 体外模拟消化中黑果腺肋花楸叶片多酚、黄酮的释放量
如图1所示,黑果腺肋花楸叶片经体外模拟消化后,多酚、黄酮的释放量均呈下降趋势,与未消化液相比,各个消化部位中的释放量下降差异极极显著(P<0.000 1)。从总体上看,不同消化阶段中多酚、黄酮的释放量均为口腔消化液>胃消化液>小肠消化液>大肠消化液。口腔消化阶段时间最短,但多酚、黄酮释放量较其他消化部位均较高,这与向卓亚等[12]研究发现黑、红、黄3种藜麦经口腔消化后的多酚释放量最高的研究结果趋势相同,随着消化的继续,多酚、黄酮的释放量逐渐减少,各消化部位均有释放出,但释放量不同。各消化液中活性成分释放量的差异可能是由于各消化阶段中的pH值和消化酶种类不同而引起的。
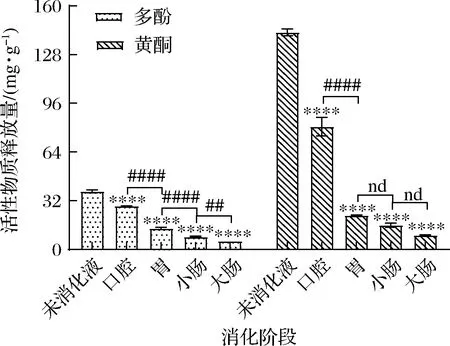
图1 黑果腺肋花楸叶片消化过程中活性物质释放情况Fig.1 Release of active substances from A.melanocarpa leaves during digestion注:各消化液与未消化液比较,*P<0.05,** P<0.01,*** P<0.001,**** P<0.000 1;相邻消化液间比较,nd P>0.05,#P<0.05,## P<0.01,###P<0.001,####P<0.000 1(下同)
2.2 体外模拟消化对黑果腺肋花楸叶片抗氧化活性的影响
2.2.1 DPPH自由基清除能力
如图2所示,随着消化的进行,与未消化液相比,各阶段对DPPH自由基清除能力大小依次为未消化液>胃消化液>口腔消化液>小肠消化液>大肠消化液,清除率分别为91.42%、88.33%、74.84%、71.76%、63.24%。胃消化液对DPPH自由基清除能力与未消化液相当,差异不显著,其他消化液对DPPH自由基清除能力均比未消化液低,且差异极极显著(P<0.000 1)。这可能是黑果腺肋花楸叶片经体外模拟消化后,对DPPH自由基清除能力较强的活性物质主要在胃中被释放出来,其他部位释放相对较少,因此在模拟消化过程中,胃消化液对DPPH自由基清除能力最高,这与谢乐怡等[22]研究发现大豆提取物经体外模拟消化后,对DPPH自由基清除能力在口腔和胃消化阶段升高,在肠消化阶段略微下降的结果一致。
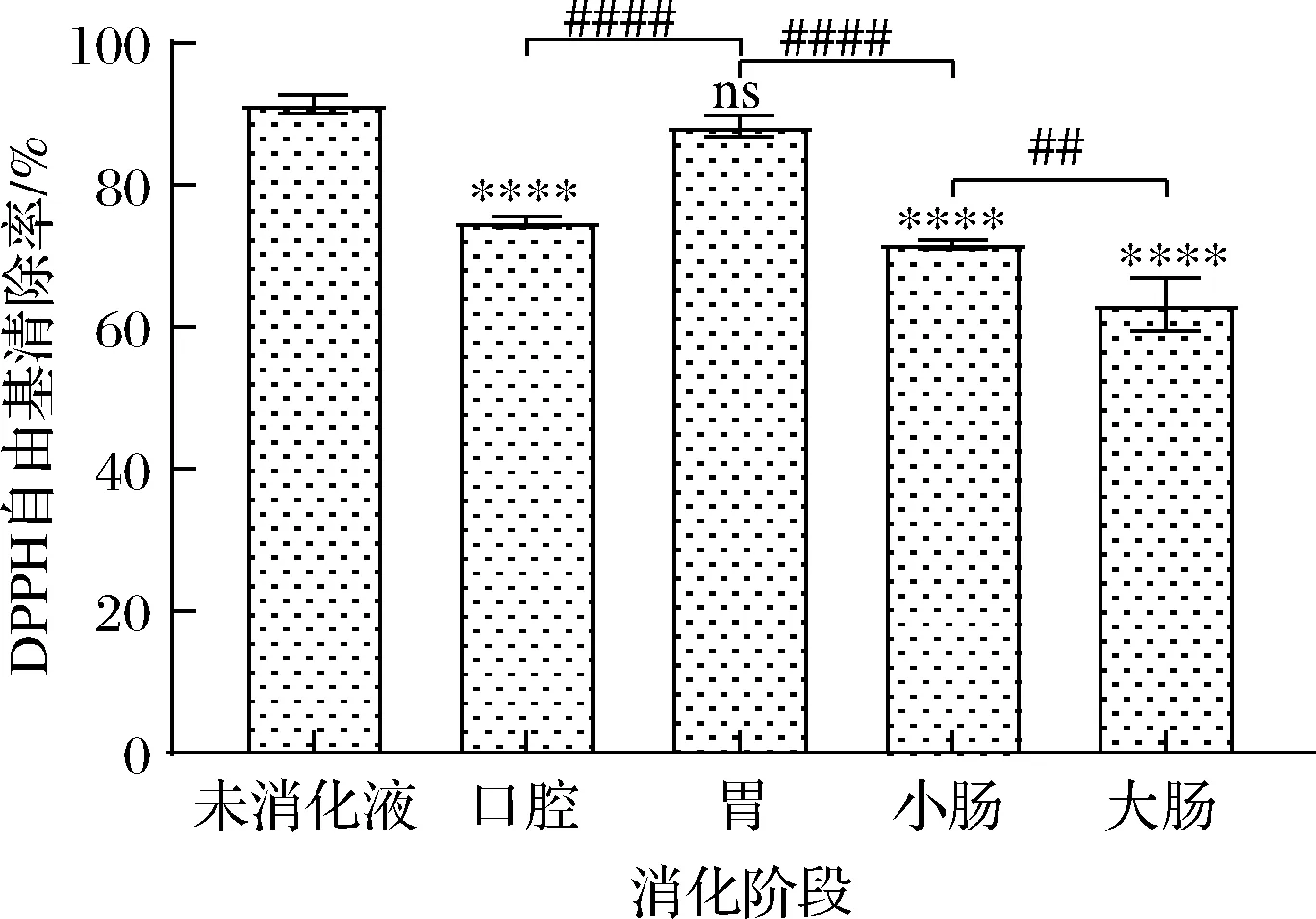
图2 黑果腺肋花楸叶片消化过程中DPPH自由基清除能力变化Fig.2 Changes of DPPH radical scavenging ability of A.melanocarpa leaves during digestion注:各消化液与未消化液比较,ns P>0.05(下同)
2.2.2 ABTS阳离子自由基清除能力
体外模拟消化黑果腺肋花楸叶片对ABTS阳离子自由基清除能力如图3所示,与未消化液相比,口腔、胃、小肠、大肠消化液对ABTS阳离子自由基清除能力下降,差异极极显著(P<0.000 1),各阶段对ABTS阳离子自由基清除能力大小依次为未消化液>口腔消化液>小肠消化液>胃消化液>大肠消化液,清除率分别为72.59%、46.42%、23.35%、22.05%、9.53%。随着消化的进行,对ABTS阳离子自由基清除能力逐渐降低,虽然在小肠消化过程中有一定回升,但回升量都较小,与胃消化相比,回升的清除率差异不显著。由图3可知,经体外模拟消化,口腔消化液对ABTS阳离子自由基清除能力最强,其他3个阶段相对较弱,这与向卓亚等[12]的研究结果一致,可能是因为清除ABTS阳离子自由基的活性物质大部分在口腔部位被释放出来,在其他3个部位由于酶种类和pH值的影响,不利于清除ABTS阳离子自由基的活性物质的释放,因此清除率相对口腔略低。
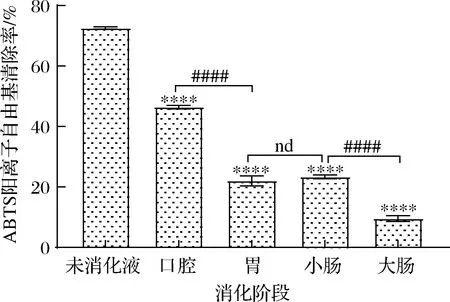
图3 黑果腺肋花楸叶片消化过程中ABTS阳离子自由基清除能力Fig.3 Changes of ABTS cationic radical scavenging ability of A.melanocarpa leaves during digestion
2.2.3 羟自由基清除能力
体外模拟消化黑果腺肋花楸叶片对羟自由基清除能力如图4所示,与未消化液相比,各阶段对羟自由基清除能力大小依次为小肠消化液>未消化液>口消化液>胃消化液>大肠消化液,清除率分别为31.76%、21.88%、21.45%、21.08%、16.51%。由图4可以看出,与未消化液相比,口腔、胃消化液对羟自由基清除能力相当,差异不显著,而小肠消化阶段对羟自由基清除率超过了未消化液,达到最高,且差异极显著(P<0.001),可能是小肠消化阶段中释放出的活性物质表现出了较高的清除羟自由基能力。经过大肠消化,清除率有所降低,与未消化液相比,差异较显著(P<0.05)。

图4 黑果腺肋花楸叶片消化过程中羟自由基清除能力Fig.4 Changes of hydroxyl radical scavenging ability of A.melanocarpa leaves during digestion
2.2.4 铁离子还原能力
铁离子还原能力与吸光值的大小相关,吸光值越大,对铁离子的还原力越强[23]。如图5所示,黑果腺肋花楸叶片经体外模拟消化后,吸光值逐渐降低,说明对铁离子的还原能力逐渐减弱。与未消化液相比,经口腔、胃、小肠、大肠消化后,各消化液对铁离子的还原能力下降,差异极极显著(P<0.000 1),在各消化阶段中,口腔消化液对铁离子的还原能力最好,与胃消化液相比,还原能力较强,且差异极极显著(P<0.000 1),可能是对铁离子有还原作用的活性物质主要在口腔部位被释放出来,随着消化的继续,具有还原作用的活性物质释放逐渐减少。
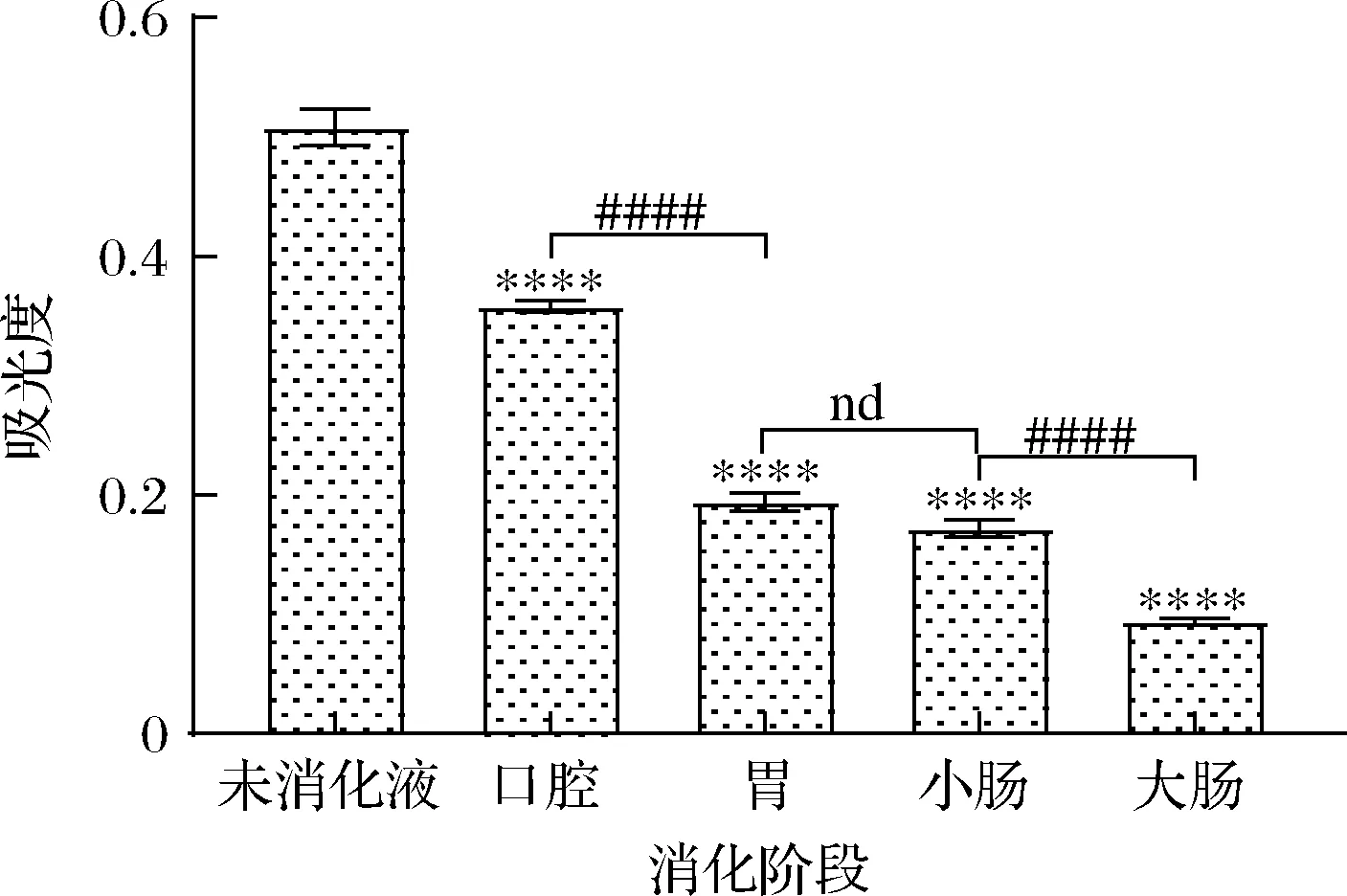
图5 黑果腺肋花楸叶片消化过程中的铁离子还原能力Fig.5 Changes of iron ion reducing power of A.melanocarpa leaves during digestion
2.3 体外模拟消化对黑果腺肋花楸叶片抑制糖消化酶活性的影响
2.3.1 α-葡萄糖苷酶抑制率
黑果腺肋花楸叶片消化液对α-葡萄糖苷酶的抑制率如图6所示,经体外模拟消化后,各消化液对α-葡萄糖苷酶的抑制率均有所下降,抑制率的下降差异极极显著(P<0.000 1)。与未消化液相比,各消化液对α-葡萄糖苷酶的抑制率大小依次为:未消化液>大肠消化液>口消化液>小肠消化液>胃消化液,抑制率分别为34.66%、9.87%、8.60%、7.01%、6.64%。由图6可以看出,与未消化液相比,口腔消化液对α-葡萄糖苷酶的抑制率极极显著降低(P<0.000 1),继续胃消化过程,抑制率降低,但与口腔相比差异不显著。经小肠消化后,抑制率略有回升,最后经大肠阶段的消化,抑制率持续回升,但差异不显著。

图6 黑果腺肋花楸叶片消化过程中对α-葡萄糖苷酶的抑制率Fig.6 Inhibition rate of α-glucosidase of A.melanocarpa leaves during digestion
2.3.2 α-淀粉酶抑制率
黑果腺肋花楸叶片各消化液对α-淀粉酶的抑制率如图7所示,与未消化相比,各阶段对α-淀粉酶的抑制率大小依次为未消化液>胃消化液>大肠消化液>小肠消化液>口腔消化液,抑制率分别为80.65%、37.21%、33.63%、29.77%、22.61%。与未消化液相比,口腔消化液对α-淀粉酶的抑制率极极显著降低(P<0.000 1),随着消化的进行,在胃消化环境中的抑制率有回升,与口腔相比,抑制率回升极极显著(P<0.000 1)。与胃消化液相比,经小肠和大肠消化后对α-淀粉酶活性的抑制率有一定的下降,但从消化总体看,都比口腔消化过程的抑制率高,可能是模拟胃、小肠、大肠3个消化环境更有利于黑果腺肋花楸叶片抑制α-淀粉酶活性成分的释放。
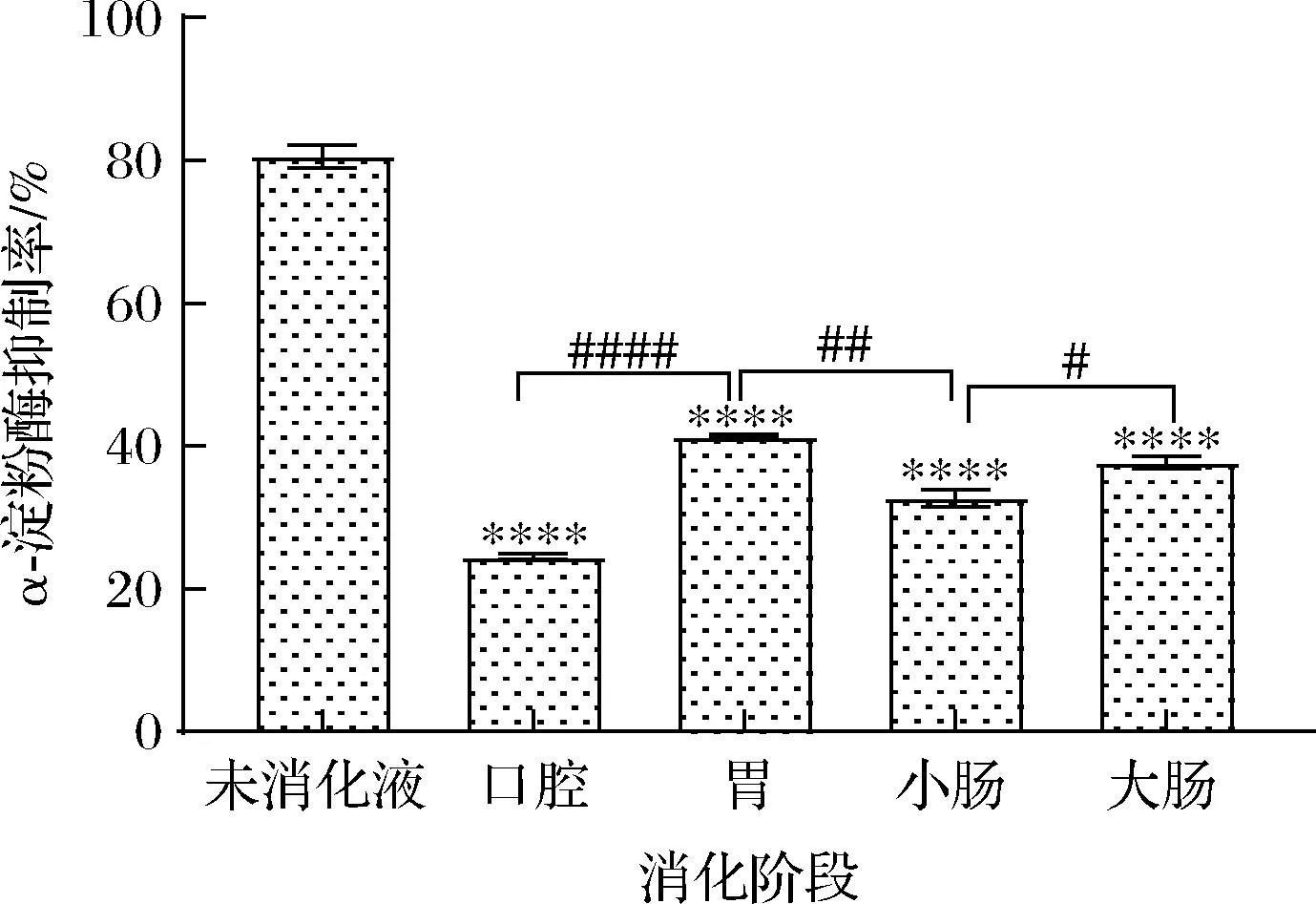
图7 黑果腺肋花楸叶片消化过程中对α-淀粉酶的抑制率Fig.7 Inhibition rate of α-amylase of A.melanocarpa leaves during digestion
2.4 抗氧化、抑制糖消化酶活性的变化与多酚、黄酮释放量相关性聚类热图分析


图8 黑果腺肋花楸叶片消化过程中体外活性与活性成分释放量之间的相关性分析Fig.8 Correlation analysis between in vitro activity and component release of A.melanocarpa leaves during digestion
3 结论
药食同源植物中的多酚、黄酮等活性物质以游离态和结合态的形式存在,利用体外模拟消化技术,在不同的pH值和不同酶的作用下,这些结合态的活性物质会与其结合的大分子类物质如蛋白质、纤维素等分离,发生降解或转化。本实验利用了体外模拟消化技术研究了黑果腺肋花楸叶片消化前后多酚、黄酮的释放情况及过程中抗氧化、抑制糖消化酶活性的变化。未消化液中多酚、黄酮含量均较高,经体外模拟消化后,释放量逐渐降低,且不同消化部位中多酚、黄酮的释放情况存在差异,对其抗氧化活性和抑制α-葡萄糖苷酶、α-淀粉酶情况也各不相同,但从总体消化过程分析,体外模拟消化促使了多酚、黄酮的释放,提高了生物利用度。在体外抗氧化活性测定中,与未消化液相比,各消化液的DPPH自由基和ABTS阳离子自由基清除能力、铁离子还原能力均呈下降趋势,但对羟自由基清除能力在小肠部位上升,在相关性分析中,羟自由基清除能力与多酚、黄酮的释放量呈负相关(R2<0),而ABTS阳离子自由基清除能力和铁离子还原能力与多酚、黄酮的释放量均呈正相关,且相关性较高。在抑制糖消化酶活性测定中,各消化液对α-淀粉酶的抑制率较高,对α-葡萄糖苷酶的抑制率稍低,相关性分析中,对2种酶活性的抑制率与多酚、黄酮的释放量呈正相关。可见,体外模拟消化过程影响黑果腺肋花楸中多酚、黄酮的释放量及抗氧化和抑制糖消化酶活性,后续还需进一步研究体外抗氧化和抑制糖消化酶活性的主要活性物质及其构效关系,并进行动物模型研究其作用机理,为黑果腺肋花楸的进一步开发利用提供实验依据。

