面向牙种植体的新型锆基非晶合金的成血管性能研究
王霏斐 孙玉春 郑 付 陈 虎 武云舒
35岁以上国人平均失牙4.7 颗,需及时进行口腔修复治疗[1]。种植修复不损伤口内余留牙,可恢复较高效率的咀嚼功能,美观性好、舒适度高,是目前人类理想的第三副牙齿。然而当牙槽骨宽度不足或缺牙间隙过小时,放置标准直径种植体会增加种植失败的风险。因此有学者建议使用窄直径种植体(narrow diameter implants,NDIs),以避免骨增量手术、减少患者痛苦和缩短治疗时间[2]。
通常文献中将直径在3.5 mm 以下的种植体定义为NDIs[2]。自骨结合理论提出以来,纯钛(Ti)已成为临床上应用最为广泛的种植材料[3]。然而Ti 机械强度欠佳,是NDIs发生机械并发症导致折断的重要因素[4]。Chrcanovic等在随访10099枚种植体的研究中发现,直径小的种植体具有更高的折裂风险[5]。因此,亟需寻找更高强度的材料以满足种植体的应力要求。同时,种植体骨整合主要历经四个阶段:早期血凝块形成、免疫炎症反应、血管新生和新骨生成[6]。血管新生是骨整合期间新骨形成的关键过程,新生血管可以为周围细胞提供氧气和营养物质以促进其增殖和分化,种植体在体内功能的发挥和存活需要植入后快速而稳定的血管生成[7]。而血管新生在Ti的骨整合过程中常常十分缺乏。
非晶合金是由超急冷凝固得到的,短程有序、长程无序结构的固态合金[8],锆基非晶合金是以锆(Zr)为主要合金元素的非晶态合金材料。得益于其独特的原子结构,锆基非晶合金具有优异的强度(约2 GPa)、高弹性应变极限(约2%)及相对较低的弹性模量(约80 GPa)[9]。在各种体系的非晶合金体系中,锆基非晶合金因其良好的生物相容性,成为研究最多的医用非晶合金。有研究发现,与传统的316L不锈钢支架相比,Zr-Cu-Al-Ti-Ni 制成的支架在分支部位的横截面积仅为316L 不锈钢支架的1∕3,即在相同的结构强度下可以使用更薄的支架材料制造,从而提高了支架的传输性,同时也降低了再狭窄率的风险[9]。
目前锆基非晶合金作为医用金属材料的研究主要集中于骨科植入物,尚缺少关于适用于口腔种植的成分体系报道,其传统加工方法成型尺寸也不足以满足种植体加工要求。目前可满足成型尺寸≥5 mm 的锆基非晶合金体系大多含有对生物有毒副作用的Ni、Be 等元素,不能作为长期植入物的组成元素。近来有研究报道了使用贵金属元素(Pd、Pt、Au 等)替代Ni、Be 元素,也可满足其成型尺寸要求,但贵金属限制了其作为种植材料的大规模应用[12~14]。
为探索锆基非晶合金作为口腔种植材料的应用前景,本研究基于经典的凝固理论,构建了一种新型(Zr60Cu26Al14)100-xNbx(x=1,3,5 at.%)成分体系,并以Ti为对照,比较其机械和成血管性能。
资料和方法
1.非晶合金体系设计
根据日本东北大学Inoue 在非晶合金体系总结出的3 条经验准则[14]:①多组元成分;②主要组元的原子尺寸差大于12%;③组元之间具有大的负的混和焓。本研究选取Zr、Cu、Al 三种元素构建非晶合金体系,查表得知各种元素之间的混合焓参照表(表1),从表中我们可以看到Zr-Cu-Al 合金体系具有高的混合焓,合金原子间键的作用力更大,在凝固过程中,原子间扩散更不容易,以形成非晶结构。表2 所示是各元素之间的原子半径差,Zr-Cu-Al 之间的原子半径差较大,基本符合原子半径大于12%的经验法则。因此,本研究选择Zr-Cu-Al 体系作为研究对象。

表1 [18] 元素混合焓
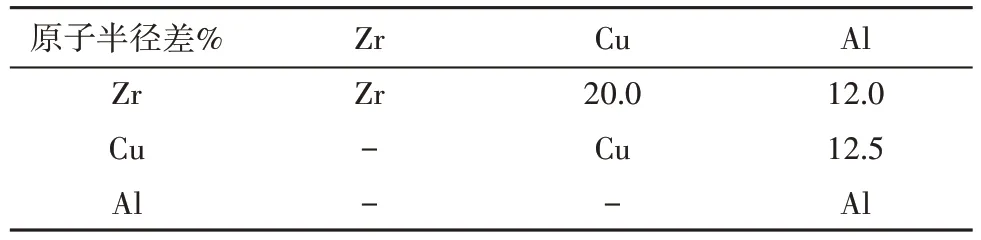
表2 [18] 元素原子半径差
经查阅,铌(Nb)可以显著增强锆基非晶合金的可塑性[15,16],增强氧化锆生物材料的骨诱导性能且无显著致敏性[17],且目前尚无含铌锆基非晶在牙种植应用的报道,因此,本研究拟构建Zr-Cu-Al-Nb体系,制备面向牙种植的新型含铌锆基块体非晶合金材料。
2.材料制备
选用纯度高于99.95%的Zr、Cu、Al、Nb 金属块体为原材料,标称成分为(Zr60Cu26Al14)100-xNbx(x=1,3,5 at.%)。在高纯氩气保护氛围中使用电弧熔炼母合金铸锭,反复熔炼6 次,确保获得母合金铸锭成分均匀。合金完全熔化后并保持30 s 保温,打开真空容器与铜模之间的阀门,熔化室和铜模之间的压力差推动合金熔体瞬间充满铜模内腔并快速冷却,由此制备出直径为3 mm、5 mm、7 mm 的非晶合金棒材。
3.材料物理性能表征
(1)微观结构和元素组成:在相同的工艺条件下,采用金刚石切割机将Zr-BMG 制备为厚度2 mm的样品,样品的相组成采用X 射线衍射仪(Bruker D8 Advance)验证;样品的元素组成采用X射线光电子能谱(Thermo Scientific ESCALAB 250X)对样品进行测试,检测条件:Al Kα激发源,真空室气压<2×10-6Pa。所需XPS标准谱线数据引自XPS手册。
(2)机械性能:采用金刚石切割机将 Ti(直径5 mm,长度20 cm,由北京佳铭铂业有色金属有限公司提供)、Zr-BMG 切割成为Ø5 mm×10 mm、Ø5 mm×3 mm 的样品,其中长10 mm 的样品使用万能力学试验(Instron 5967)进行室温单轴准静态压缩实验,压缩速率为0.5 mm∕min。每种材料使用5 个样品进行重复实验。
4.生物相容性
实验用含10%胎牛血清的内皮细胞培养基,在37°C、5% CO2培养箱中培养HUVECs,2-3天传代一次。采用金刚石切割机将Ti、Zr-BMG 切割成为Ø5 mm×1 mm 的样品,使用Ti、Zr-BMG 合金样品酒精浸泡紫外线照射消毒后置于96 孔板内培养细胞,每种材料设置三组平行样品。各孔加入5×103个细胞在恒温培养箱中分别培养1、3、5、7 天。到达时间点后,弃净培养基并用磷酸盐缓冲液充分冲洗样品表面。在每孔滴加10% CCK-8 试剂的培养基200 μL,再将其在37°C 培养箱中避光孵育1 h,然后每孔取100 μL 溶液用酶标仪(Infinite M200 型),测定其在450 nm波长处的吸光度(OD)值。
5.成血管性能
(1)浸提液制备:依据ISO 10993-12-2021,浸提液体积与试样材料的表面积之比为3:2,细胞培养液(含有10% FBS、青霉素和链霉素的内皮细胞培养基)作为浸提液介质。在含5% CO2,37℃的孵箱中浸提72 h。使用丙酮及去离子水清洗切割完成的试样,然后在75%酒精浸泡24 h,最后用紫外线照射灭菌处理2 h。最后将试样放置在离心管中,加入一定量的细胞培养液,将离心管密封,浸提72 h。制备成功的浸提液需要在在4℃温度下保存并且必须在24 h内使用。
(2)血管样结构形成实验:取生长良好的HUVECs 接种于6 孔板,贴壁后加入材料浸提液提前干预24 h。实验前一天将基质胶埋于冰里,并于4℃冰箱过夜缓慢融化,基质胶用预冷枪头混匀。第二天待基质胶冻融后,在预冷的48 孔板每孔加入50 uL 基质胶,沿48 孔板孔壁缓缓加入,铺板后于4℃放置15 min,后转入室温放置30 min 平衡后,在37℃孵箱放置45 min。当HUVECs 长满6 孔板的70%~80%时,消化重悬,每孔加入50 μL 重悬液,每组设置3 个复孔,置于37℃、CO2培养箱孵育。选取2 h,4 h,6 h 三个时间点,显微镜下持续观察HUVECs 的成管过程。最终选取4 h 时,倒置显微镜下观察内皮细胞在胶原表面形成小管样结构情况,每孔随机选取5 个视野,使用Image J 软件对总的血管长进行统计学分析。
(3)细胞迁移实验:在12 孔板底部外面用马克笔沿每孔的中部上下各画一道横线,两线相距0.5 cm,取生长良好的HUVECs 接种于12 孔板,贴壁后加入Zr-BMG 和Ti 的材料浸提液处理24 h,每组设置3个复孔。细胞长满后,直尺垂直底部直线放置于12孔板上,在每孔中部左右两侧各用200 uL 枪头沿直尺划痕,划痕时枪头尽量垂直于12 孔板。用PBS 冲洗3 遍,洗净划痕掉落的细胞,加入无血清培养基,每孔拍照3 个区域,即为0 h 的图像。37℃、5% CO2环境下培养,于12 h 后分别拍照记录。通过Image J 测定各细胞划痕间距,各组细胞分别计算迁移率。细胞迁移率=(0 h 划痕宽度-培养后划痕宽度)∕0 h 划痕宽度。
(4)RT-qPCR 检测:①实验过程:取生长良好的HUVECs 接种于6孔板,过夜后加入Zr-BMG 和Ti的材料浸提液预处理24 h。提取细胞RNA 后,使用nanodrop 8000 测定RNA 浓度。使用10 uL 体系进行逆转录,进行实时定量PCR(Quantitative Realtime PCR),反应条件为预变性95℃10 min,变性95℃ 5sec,退火及延伸60℃ 1 min,共40 个循环。以GAPDH的表达水平为内参照,设定对照组与实验组时,实验组基因相对于对照组的表达公式为2-△△CT=2-(△Ct实验组-△Ct对照组)。根据三次独立实验的结果,计算均值与标准差,绘制数据图。②引物序列:a.人GAPDH 上 游∕下 游:5'-TCATTGACCTCAACT ACATG-3'∕5'-TCGCTCCTGGAAGATGGTGAT-3';b.人ANG2 上游∕下游:5'-CAACACTCAGTGGCTAAT GAAG-3'∕5'-GCATTCTGCTGTATCTCTACCA-3';c.人VEGF 上游∕下游:5'-ATCGAGTACATCTTCAAG CCAT-3'∕5'-GTGAGGTTTGATCCGCATAATC-3';d.人APLN 上 游∕下 游:5'-CAGAGGGTCAAGGAAT GGG-3'∕5'-GAAAGGCATGGGTCCCTTAT-3'
6.统计学分析
实验数据均以均数±标准差(Mean±SD)表示,用Graph Prism 8.0 进行统计分析,使用非配对t检验进行组间比较。检验标准:P<0.05 时差异有显著性(*),P<0.01(**),P<0.001(***)。
结 果
1.Zr-BMG的微观结构和元素组成
利用铜模吸铸法制备的Ø3 mm、Ø5 mm、Ø7 mm的非晶合金样品如图1 所示。其中,当x=1 时,Zr-BMG 形成非晶结构的临界尺寸可达Ø7 mm,其他比例成分的Zr-BMG 临界尺寸均达到Ø5 mm。图2 是Zr-BMG 不同直径样品的XRD 衍射对比图谱,Ø3 mm、Ø5 mm的样品XRD 均为“馒头峰”;当样品直径达到7 mm,只有x=1时,样品才是完全的非晶相,其他成分比例均出现了尖锐的衍射峰,表明此时的合金试样在快速冷却过程中内部析出了晶体相。XPS结果(图3)显示,Zr-BMG 样品成分与预先设计的一致。

图1 铜模吸铸法制备的Ø3 mm、Ø5 mm、Ø7 mm的非晶合金样品

图2 Ø3 mm、Ø5 mm、Ø7 mm非晶合金样品的XRD图谱

图3 Zr-BMG的XPS图谱
2.Zr-BMG的机械性能
图4 是Zr-BMG 和Ti 室温压缩时的应力—应变曲线,表4 总结了其压缩断裂强度(σmax)和弹性应变率(σe)。材料力学性能指标中σmax 反映了材料对塑性变形和裂纹扩展的阻力。结果显示,非晶结构的合金显示出高压缩断裂强度,最高可达到1630.52±62.00 MPa,为Ti 的2.89 倍;最低也可至1102.23±27.50 MPa,为Ti的2.00 倍。同时,Zr-BMG的弹性应变段与Ti 相似,说明其具有良好的可加工性能。
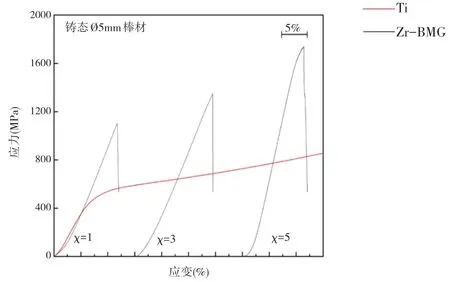
图4 Zr-BMG及Ti的压缩应力应变曲线
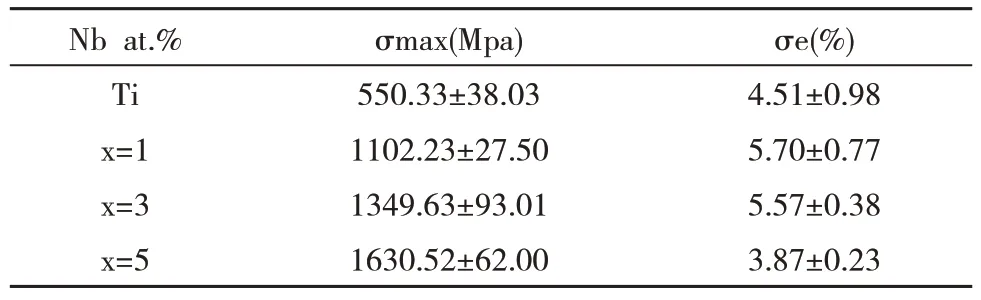
表3 Zr-BMG及Ti的力学性能
3.Zr-BMG的生物相容性
如图5 所示,Zr-BMG 对HUVECs 在1、3、5、7天时增殖的影响与Ti无异。(P>0.05),且各组样品表面细胞数量均随培养时间延长而明显增大。

图5 Zr-BMG和Ti对HUVECs增殖的影响
4.成血管性能
(1)血管样结构生成实验:如图6所示,2 h时细胞分散分布,未见血管样结构形成;4 h 时细胞形成分支相互连接成完整的网状结构;6 h 细胞虽形成完整的网状结构,但是已经出现了一些散在的细胞,细胞的线样结构也已经断裂,再随着时间延长细胞逐渐聚集成团,网管状结构消失。因此本实验选择4 h作为观察时间点。

图6 2 h、4 h和6 h后经Ti浸提液处理的同一视野下血管样结构生成图像
如图7 所示,相比于Ti,经Zr-BMG 浸提液处理的细胞在4h 形成的微血管网状结构更多、分布范围更广、散在的细胞更少。对总管腔长度、网状结构数量及主要结点数量进行统计学分析,结果如图8 所示,在本实验条件下,Zr-BMG 具有显著的促进血管生成的能力(P<0.05)。

图7 4 h后经Zr-BMG和Ti浸提液处理的HUVECs血管样结构生成图像

图8 管腔总长度、节点数及管腔数统计学分析
(2)划痕实验:用Ti、Zr-BMG 制成的材料浸提液对细胞干预后,划痕实验结果如图9 所示。相比于Ti,Zr-BMG 浸提液制成的条件培养基有显著促进HUVECs 划痕愈合的作用。当x=1 时,二者的差异具有统计学意义(P<0.05)。

图9 Zr-BMG与Ti的划痕实验结果与统计学分析
3.RT-qPCR结果
细胞经浸提液诱导后成血管相关mRNA表达量如图10 所示。本研究检测了与血管生成有关的VEGF、ANG2、APLN 因子的表达量,通过分析可以发现经Zr-BMG 浸提液处理的细胞,24 h 后相关因子表达显著升高,二者具有统计学差异(P<0.05)。
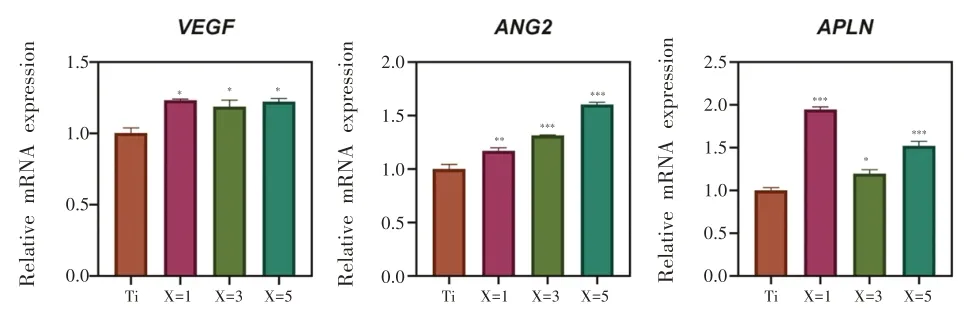
图10 Zr-BMG和Ti浸提液对成血管相关基因表达量的影响
讨 论
种植材料在无毒、无致敏、无致癌致畸的生物安全性基础上,应着重提高种植材料力学性能、骨整合能力,以达到提高骨结合率、延长种植体使用寿命的目的[3]。目前Ti 已经成为临床上应用最广泛的种植材料,但临床上仍约有10%的患者会有不同的并发症,引起这些并发症的原因有Ti 机械强度欠佳、促骨结合能力不足等。
目前已有研究指出,可以使用更高强度的材料替代Ti 以降低发生机械并发症的风险。Kobayashi等[20]首次提出在Ti 中添加安全无毒的Zr 元素以制备钛锆合金(Ti-Zr)种植体,可以有效提高机械强度,在窄直径种植体领域受到广泛关注。然而,钛锆合金(13% Zr)的强度仅可达Ti 的1.4 倍,Ti-Zr 种植体可达到的最小直径为3.3 mm,在咬合力大的区域、牙间隙不足或骨量严重不足的区域应用仍存在限制。本研究设计构建的新成分体系强度可达Ti的2.00~2.89 倍。因此,这种合金有潜力制作出直径更小的种植体应用于后牙区域,可以有效解决后牙骨量不足、与邻牙间隙过小等问题,减少骨增量手术的可能,缩短治疗周期。
同时,根据Branemark[6]的骨结合理论,提高种植材料诱导血管生成的能力,也可以增加其临床应用范围。当前,改善种植体骨结合能力的方法主要是种植体表面处理技术,如Guida[21]等对Ti进行阳极氧化处理,发现在阳极氧化处理后的钛片上生长的I型胶原蛋白量与对照组表面上生长的含量更高。但这些方法主要是通过钛及钛合金的表面处理来改善其生物性能,但表面结构与种植体连接结构薄弱,加工工艺复杂、成本较高,且未能从根本解决骨结合效率低的问题。本研究利用非晶合金可以通过引入不同元素以实现性能优化的特点,排除了生物相容性不佳的Ni、Be 等元素后,探索了一种新的成分体系。在可满足加工成为种植体的尺寸要求的基础上,实现了材料本身促血管生成能力的提升,减少了表面处理步骤,可以有效避免因表面结构连接薄弱而导致的种植并发症。
由数据可见,随着Nb含量的增加,Zr-BMG 的非晶形成能力减弱,但压缩断裂强度增强,因此尚需进一步探索用于NDIs 的最适成分体系。同时,依据GB∕T 37782-2019,应用于种植体的新材料尚需全面的性能检测,如种植体需要具备良好的疲劳寿命、抗腐蚀性能等,以保证其长期使用的可靠性。种植体在使用过程中将不断受到往返的压力和应力,需要具备足够的疲劳强度,以确保其在长期使用过程中不会出现疲劳断裂等失效问题。在本研究中,因电弧熔炼∕铜模吸铸方法制作的材料形状受限,无法加工出三点弯曲实验的标准样品,材料的弯曲模量、抗弯折强度、抗腐蚀性能等性能指标尚未检测。因此,本研究构建的新型材料尚需在未来研究中进行机械性能的进一步检测。
从本研究的实验结果来看,(Zr60Cu26Al14)100-xNbx(x=1, 3, 5 at.%)非晶合金拥有良好的生物相容性及显著的促血管生成能力,在口腔医学新材料方面有较广阔的应用前景,但要作为口腔植入材料应用于临床还需要进一步的观察研究。本研究使用HUVECs 建立体外模型检测新型Zr-BMG 的促血管生成能力,但仍然需要建立体内模型验证。构建合适的颌骨拔牙后微型种植体植入的大鼠模型并使用Micro-CT、硬组织磨片等手段评估材料的骨结合性能将是本课题未来需要完善的内容。同时,锆基非晶合金的临床应用需要通过大量的临床实验来证实其安全性和有效性,未来可以开展更多研究工作,包括临床试验、长期随访等,以进一步证实锆基非晶合金在牙种植体领域中的应用潜力。
本研究构建的新型锆基非晶合金体系具有高强度、加工性能优良的特点,生物相容性与Ti 没有显著性差异,具有作为生物植入物的潜力。同时,与Ti相比,Zr-BMG 的材料浸提液具有显著的促进血管生成的能力,可以加速骨整合初期的血管生成。因此,Zr-BMG 有望成为传统纯钛种植体之外的一个新的选择,使植义齿修复更加简便、美观、耐用。

