初步探索miR-27b-3p在普萘洛尔治疗婴幼儿血管瘤过程中的作用
朱羿霏 那思家 崔 浩 谢林洋 张 舟 梁 想 方思雅 屠军波
婴幼儿血管瘤是婴幼儿最常见的软组织肿瘤[1],发病率约为3%~10%。常见于出生时或出生后3 至6 个月,由血管生成失调所引发血管内皮细胞过度增殖所致。普萘洛尔作为血管瘤治疗临床一线用药对多数血管瘤具有显著疗效,但临床上仍然有部分血管瘤对普萘洛尔治疗不敏感[2],严重影响患儿身心健康,甚至威胁生命。普萘洛尔通过诱导血管瘤内皮细胞凋亡到达到促进血管瘤消退的作用,而细胞凋亡是一系列连续和多基因参与调控的过程[3]。其中凋亡蛋白酶活化因子-1(apoptoticprotease activating factor-1,Apaf-1)是一种哺乳动物线粒体依赖性细胞凋亡通路中关键因子,其通过激活Caspase 通路,促进细胞凋亡[4]。Apaf-1 蛋白低表达,是凋亡小体形成和凋亡信号通路激活的限制因素,其发生机制包括基因甲基化、mRNA 超甲基化、Apaf-1 在脂筏中的定位、microRNAs(miRNAs)的抑制、磷酸化以及与特定抑制剂的相互作用等[5]。
miRNAs 是一种短非编码的单链RNA,大约由22 核苷酸组成。miRNAs 通过与靶mRNA 3’-非翻译区(3’-UTR)区域互补配对,调控转录后靶基因的活性,从而调节不同的生物过程[6]。miRNA 对内皮细胞的增殖、存活和迁移,以及血管生成具有重要的调控作用[7]。曾有研究发现在中枢神经系统中miR-23a∕b 和miR-27a∕b 可有效抑制Apaf-1 的表达[8],通过targetscan.org 基因数据库分析发现miR-27b-3p 与Apaf-1 mRNA3’-UTR 区域互补。
因此,本研究拟采用细胞和分子水平探讨miR-27b-3p 是否通过靶向抑制Apaf-1 表达降低血管瘤内皮细胞凋亡水平,进而影响普萘洛尔治疗血管瘤的分子机制,以期利用RNA 干扰技术增敏普萘洛尔治疗效果提供理论基础。
材料和方法
1.HUVECs 的细胞培养与转染
人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)购于赛百康公司,在-196℃液氮中冻存,于实验室行体外传代培养。将5ml 胎牛血清(Gibco 公司,美国)加入45 ml 的α-MEM 培养基(Hyclone 公司,美国)中,混匀,制备成完全培养基,用于贴壁细胞HUVECs 培养。37℃、5% CO2和饱和湿度的培养箱中常规培养,每2 天换 液1 次,3 天 左 右 传 代1 次。LV-hsa-miR-27b-3p-inhibition 以及其阴性对照(CON137)病毒由上海吉凯公司合成,依据产品说明书操作,使用HitransG A 感染增强液进行转染,得到miR-27b-3p 敲低组(IN 组)与阴性对照组(NC 组),qRT-PCR检测转染效率,转染成功即证明miR-27b-3p-IN 组和miR-27b-3p-NC 组构建成功;LV-hsa-miR-27b-3p mimics 及其阴性对照病毒由上海吉玛公司合成,依据产品说明书,使用GP-transfect-Mate 转染试剂对miR-27b-3p-inhibition(IN 组)进行转染,得到miR-IN 组(未转染miR-27b-3p mimics 及阴性对照组)、miR-IN+miR-mimics NC 组(转染miR-27b-3p mimics 阴性对照组)以及miR-IN+miRmimics 组(转染miR-27b-3p mimics 组),qRT-PCR检测转染效率,转染成功即证明转染miR-IN 组、miR-IN+miR-mimics NC 组、miR-IN+miR-mimics组成功。
2.CCK-8 实验检测细胞活性
将盐酸普萘洛尔避光溶于pH 为7.4 的PBS 中,调整母液浓度为1000 μM,调整pH 为6.0 备用。以5000 个∕孔的数量,将HUVECs 接种于96 孔板。待细胞生长至70%时,以浓度梯度为0、15、30、45、60、90 μM 的盐酸普萘洛尔处理细胞。采用Cell Counting Kit-8(CCK-8)试剂盒(武汉博士德公司,中国)进行细胞活性检测。即普萘洛尔处理24 小时后,将CCK-8 溶液加入培养基中,在37°C,5%CO2环境中孵育1 小时。然后,将酶标仪设置波长为450 nm,上机检测。对照组的培养液说明:选用浓度为0 的盐酸普萘洛尔处理细胞组为对照组。
3.流式细胞实验检测细胞凋亡
按照Annexin V-APC∕7-AAD 细胞凋亡检测试剂盒(AT105,联科,中国)说明书进行细胞凋亡检测。收集2×105细胞弃上清液,PBS 洗涤一次,离心弃上清,再加入500 μl 稀释的Annexin V Binding Buffer 工作液重悬,再分别加入5 μl Annexin VAPC 和7-AAD,轻柔混匀,室温避光孵育15 min。最后,采用流式细胞仪器进行细胞凋亡水平检测、分析。
4.TUNEL 染色法检测细胞凋亡
按照TUNEL 试剂盒(武汉博士德公司,中国)说明书检测细胞凋亡水平。以2000 个∕孔的细胞密度将HUVECs 接种于共聚焦小皿,每孔200 ul 培养基,置于37℃,5%的CO2培养箱中培养24 h。然后,根据分组分别加入盐酸普萘洛尔(实验组)或PBS(对照组)处理24 小时,用二甲苯清洗细胞爬片两次,每次5 min。4%多聚甲醛固定10 min,PBS洗2 次。随后,用0.5% Triton 处理10 min,PBS 洗2次。以1:200 比例用0.01M TBS 稀释Proteinase K滴加在共聚焦小皿中,37℃条件下消化10 min,TBS 洗3 次;再将18 μl 缓冲液与1 μl 的TdT 和1 μl 的DIG-d-UTP 混匀,以20 μl∕片的量滴加在共聚焦小皿中,37℃孵育2 h,TBS洗3次;以50 μl∕片的量加入封闭液于共聚焦小皿中,室温封闭30 min,甩干;用SABC 稀释液以1:100 比例稀释生物素化抗地高辛抗体,每片50 μl,37℃孵育30 min,TBS 洗3次;在用SABC 稀释液以1:100 比例稀释SABC,每片50 μl,37℃孵育30 min,TBS 洗3 次;最后,DAPI 染液复染,双蒸水清洗2 次,抗荧光淬灭剂封片,激光共聚焦显微镜观察、记录并分析。
5.实时定量聚合酶链反应检测细胞凋亡相关因子基因表达水平
根据TRIzol 试剂盒(湖南艾克瑞公司,中国)操作说明书从HUVECs 中分离、收集、纯化并提取RNA,利用逆转录酶和引物合成cDNA,随后进行PCR 实验。miRNA 反转录条件为37℃60 min,85℃5 min,4℃-,而其他基因反转录条件为:第一阶段:42°C2 min,4℃-;第二阶段:37°C15min,85°C5 s,4℃-。PCR 反应条件:95℃30 s,接着39个循环95℃5 s、60℃20 s,最后95℃10 s。具体引物序列如表1。

表1 RT-PCR引物序列
6.蛋白质印迹法检测细胞凋亡相关因子蛋白表达水平
按照RIPA 裂解液试剂盒(西安中晖赫彩公司,中国)提取蛋白,BCA 蛋白分析试剂盒(武汉博士德公司,中国)进行蛋白定量,PAGE 凝胶(彩胶)快速配成试剂盒(西安子木生物公司,中国)制备凝胶。水浴变性后行SDS 电泳分离蛋白,PVDF 膜转印,5%脱脂奶粉的TBST 封闭2 h,加入anti-Apaf-1、anti-PARP、 anti-Caspase-9、 anti-Caspase-3、 anti-GAPDH 4℃孵育一抗过夜,次日羊抗兔IgG-HRP 室温孵育2 h,加入200 μl 发光液,上机(Bio-Rad ChemiDoc XRS系统),Image Lab软件定量分析。
7.双荧光素酶报告实验检测miR-27b-3p 与Apaf-1的靶向关系
将Apaf-1 及其相应突变体亚克隆到PSICheck2(上海汉恒生物公司,中国)中构建荧光素酶报告载体,分别命名为h-APAF1-3UTR-wt 和h-APAF1-3UTR-mu。 将h-APAF1-3UTR-wt 或h-APAF1-3UTR-mu 目的质粒,以及hsa-miR-27b-3p∕Negative.Control(NC)共转染293T 细胞。转染48 小时后,根据双荧光素酶检测试剂盒(汉恒生物,中国)说明书操作,利用全波长多功能酶标仪SPectraMax M5e(美谷分子仪器,中国)检测荧光强度。
8.统计学处理
所有实验重复3 次,研究结果以均数±标准差(SD)表示。采用SPSS 22.0 统计软件进行统计分析,采用方差分析进行组间差异比较,并使用独立t检验对各组均数进行两两比较,P值小于0.05 为有统计学意义。
结 果
1.普萘洛尔在体外有效抑制HUVECs 细胞活性、促进细胞凋亡
分别采用0 μM、15 μM、30 μM、45 μM、60 μM、90 μM 浓度梯度普萘洛尔处理HUVECs 24 h,CCK-8实验结果揭示普萘洛尔治疗组中HUVECs活性明显被抑制(图1A)。通过计算获得普萘洛尔半抑制浓度(IC50)为31.85 μM,故30 μM 浓度的普萘洛尔用于接下来实验。随后采用30 μM 浓度的普萘 洛 尔 分 别 以1、2、3、4、5 天 时 间 梯 度 处 理HUVECs,CCK-8 实验结果表明细胞活性随时间增加逐渐被抑制(图1B)。为了进一步检测普萘洛尔对HUVECs 细胞凋亡的影响,我们进行了流式细胞实验,结果显示比较对照组,经普萘洛尔处理24 h后,HUVECs 细胞凋亡增高63.88%(P<0.001)(图1C)。同时TUNEL 染色结果流式细胞检测结果一致,实验组高于对照组6.18 倍(P<0.001)(图1D)。普萘洛尔处理24 h 后,我们通过PCR 和Western Blot 法检测Apaf-1、PARP、Caspase-9 和Caspase-3的基因和蛋白表达。PCR 结果说明与对照组相比(0 μM 普萘洛尔处理组),经30 μM 普萘洛尔处理组 中 细 胞 凋 亡 因 子Apaf-1、PARP、Caspase-9、Caspase-3 mRNA 表达水平明显增加,分别为1.37倍、17.12 倍、2.49 倍和2.42 倍(P<0.001)(图1E)。Western Blot 法检测细胞凋亡因子Apaf-1、PARP、Caspase-9和Caspase-3的蛋白水平改变与PCR结果一致,分别为4.46 倍、8.21 倍、4.21 倍和8.71 倍(P<0.001)(图1F)。上述结果提示普萘洛尔在体外通过促进HUVECs细胞凋亡,抑制HUVECs增殖。
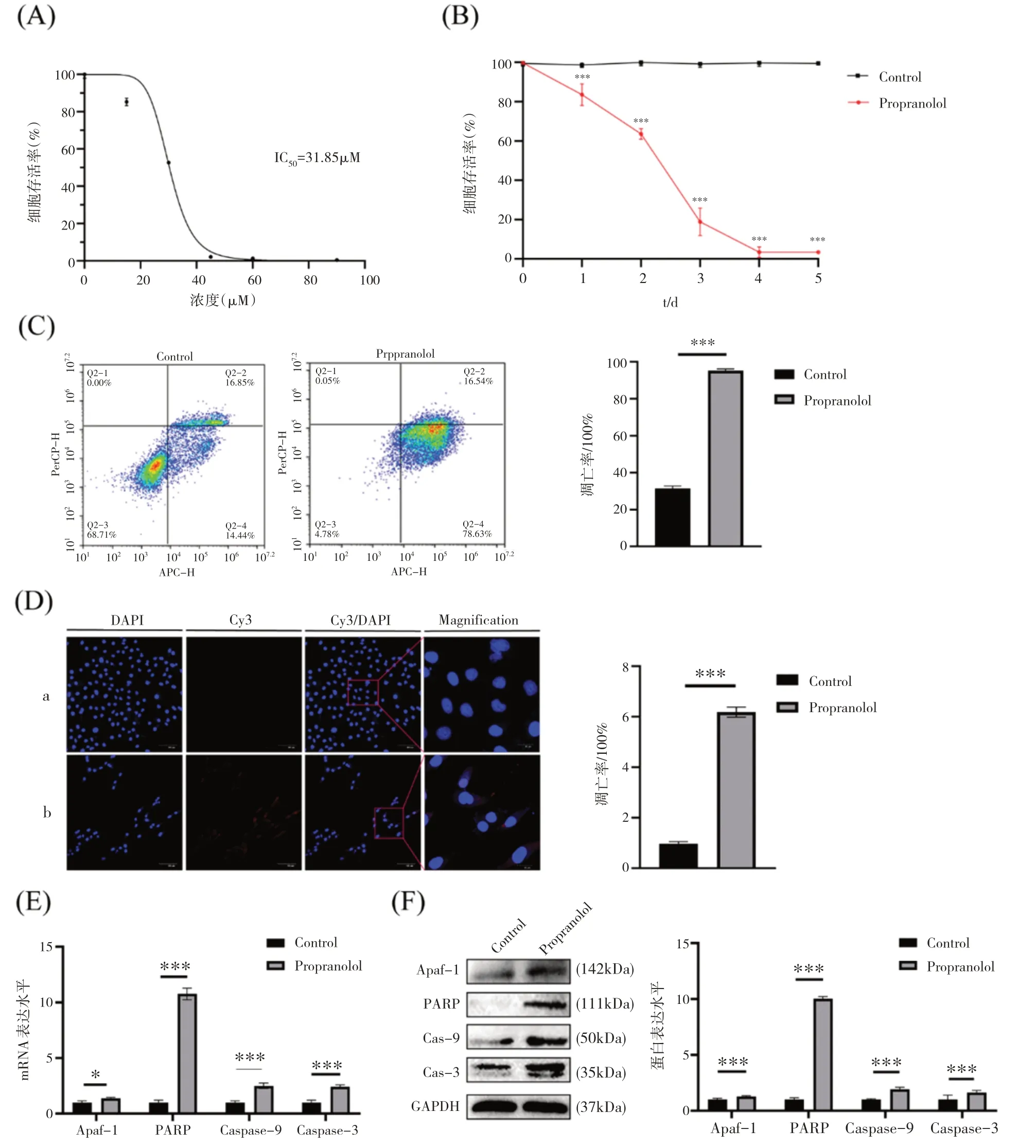
图1 普萘洛尔在体外有效抑制HUVECs细胞活性、促进细胞凋亡,并上调细胞凋亡相关因子Apaf-1、PARP、Caspase-9和Caspase-3的表达
2.敲低miR-27b-3p 促进普萘洛尔诱导HUVECs细胞凋亡
为了明确miR-27b-3p 在普萘洛尔诱导HUVECs 凋亡中的作用,我们检测了普萘洛尔处理后HUVECs 中miR-27b-3p 的表达水平,结果显示:普萘洛尔处理后,miR-27b-3p 的表达水平下调2.67倍(图2A,P<0.001)。同时,阴性对照组(NC 组)及miR-27b-3p 敲低组(IN 组)HUVECs 稳转株成功建立并鉴定(图2B)。随后,利用建立稳转株进行CCK-8 实验、流式细胞术和TUNEL 实验,结果显示与对照组相比,经普萘洛尔处诱导后,miR-27b-3p敲低组的HUVECs 细胞活性被有效抑制(图2C,P<0.001),细胞凋亡水平增加6.77%(流式细胞检测)和2.06 倍(TUNEL 染色)(图2D-E,P<0.001)。经过30 μM 普萘洛尔处理HUVECs 稳转株NC 组和IN 组24 h 后,PCR 检测Apaf-1、PARP、Caspase-9 和Caspase-3 的基因和蛋白表达变化。普萘洛尔诱导后,与阴性对照组相比,miR-27b-3p 敲低组Apaf-1、PARP、Caspase-9、Caspase-3 mRNA 表达水平明显增高,分别为4.43 倍、10.76 倍、1.8 倍和(图2F,P<0.05 或P<0.001)。同样,Apaf-1、PARP、Caspase-9 和Caspase-3 的蛋白水平经普萘洛尔处理24 h 后明显上调,1.4倍、2.81 倍、1.42 倍和4.14 倍(P<0.001,图2G)。综上,我们发现普萘洛尔处理后HUVECs 中miR-27b-3p 的表达降低,而敲低miR-27b-3p 后升高了HUVECs 细胞凋亡水平,提示miR-27b-3p 在普萘洛尔治疗中起抑制作用。
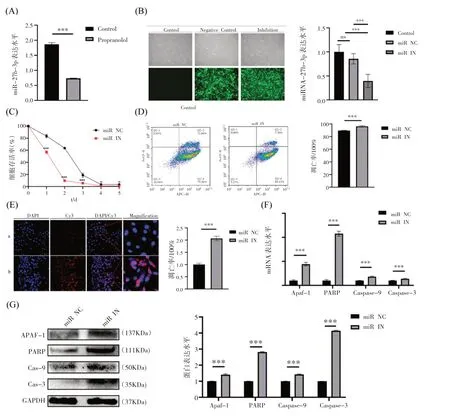
图2 敲低miR-27b-3p促进普萘洛尔诱导HUVECs细胞凋亡
3.miR-27b-3p 靶向抑制Apaf-1 降低普萘洛尔诱导HUVECs细胞凋亡
通过targetscan.org 数据库分析并预测miR-27b-3p 与Apaf-1 mRNA 的3'UTR 匹 配,并 且 荧光素酶报告实验结果显示在与WT Apaf-1 3’UTR(Apaf-1 WT)和miR-27b-3p mimics 共转染的细胞中,与miR-27b-3p 对照或突变Apaf-1 3’UTR(Apaf-1 Mu)相比,荧光素酶活性显著降低2.45 倍,这证明miR-27b-3p 与Apaf-1 存在靶向关系(图3A)。为了进一步明确miR-27b-3p 通过降低Apaf-1 表达,进而抑制普萘洛尔诱导HUVECs 细胞凋亡,我们通过转染miR-27b-3p-mimics 进行普萘洛尔处理下的挽救实验(图3B)。PCR 实验结果显示比较miR-27b-3p 敲低组(IN 组),miR-27b-3p-mimics 转染组细胞凋亡相关因子mRNA 表达被显著下调,分别为Apaf-1 1.46 倍、PARP 5.66 倍、Caspase-9 7.77倍及Caspase-3 2.66 倍(图3C,P<0.001)。同时,Western Blot 实验结果与PCR 结果相一致,细胞凋亡相关因子Apaf-1、PARP、Caspase-9 和Caspase-3的蛋白水平分别1.42 倍、3.63 倍、1.7 倍及4.57 倍(图3D,P<0.05或P<0.001)。
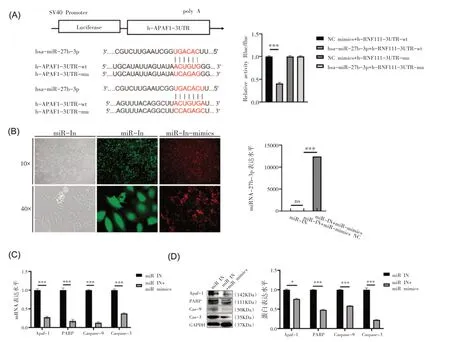
图3 miR-27b-3p靶向抑制Apaf-1降低普萘洛尔诱导HUVECs细胞凋亡
讨 论
IH 是由胚胎期血管内皮细胞过度增殖引起的皮肤良性肿瘤。IH 的治疗通常开始于肿瘤增殖的早期,此时有多种治疗方法,其中普萘洛尔被公认为治疗IH的一线药物,具有加速血管瘤消退的疗效[9]。早期研究发现普萘洛尔通过诱导血管瘤内皮细胞凋亡达到婴幼儿血管瘤的快速消退。然而,临床上仍有部分患儿对普萘洛尔治疗敏感度差,甚至无效。已有研究尚不足以解释普萘洛尔介导的分子网络,其治疗血管瘤的分子机制尚未完全理解[10]。
课题组前期研究表明,普萘洛尔通过p53-BAX线粒体凋亡途径促进血管瘤内皮细胞凋亡,从而加速IH 消退[11~12]。凋亡蛋白酶活化因子-1(Apaf-1)是一种内源性凋亡及线粒体依赖性细胞凋亡通路中的关键因子,Apaf-1 与细胞色素c 和dATP 结合后形成一个寡聚凋亡小体,凋亡小体通过结合和切割Caspase-9 前体蛋白,释放并激活Caspase-9,进而诱导Caspase 级联反应,促进细胞凋亡[13]。普萘洛尔处理 后,HUVECs 中 Apaf-1、PARP、Caspase-9、Caspase-3的基因和蛋白表达水平显著上调,这与文献报道普萘洛尔促进caspase-3 和caspase-9 的裂解产物和caspase-8 表达,进而介导的细胞凋亡相一致[14],证明普萘洛尔激活Apaf-1 介导的细胞凋亡通路,诱导HUVECs细胞凋亡。正如文献报道,miRNA作为非编码RNA 的一员,在转录或转录后水平调节基因表达,与肿瘤的发生及发展具有密切关系[15]。有报道显示,在中枢神经系统中的miR-23a∕b 和miR-27a∕b 抑 制Apaf-1 的 表 达[8]。而miR-23a 和miR-221 通过与Apaf-1 mRNA 的3'-非翻译区结合来抑制喉癌组织中Apaf-1 的表达[16,17]。此外,miR-17-5p 通过抑制Apaf-1 凋亡途径中PARP1∕HMGB1介导的线粒体DNA 损伤来调节脓毒症诱导的心肌细胞凋亡[18]。通过RNA 干扰技术敲低HUEVCs 中miR-27b-3p的表达,显著增加了细胞凋亡水平及相关细胞凋亡因子表达。这部分结果提示miR-27b-3p 可能参与调控Apaf-1 介导的细胞凋亡通路的调控。为进一步明确这一发现,我们通过targetscan.org 基因数据库对miR-27b-3p 与Apaf-1 进行预测析,并发现miR-27b-3p 与Apaf-1 mRNA3’-UTR 区域互补。同时,双荧光素酶报告实验结果也证实miR-27b-3p与Apaf-1存在靶向关系。这提示miR-27b-3p 作为非编码RNA 通过靶向结合Apaf-1 mRNA,抑制Apaf-1 的表达,负向调控Apaf-1 介导的细胞凋亡过程。因此,我们设计挽救实验:向敲低miR-27b-3p 的HUVECs 稳转株中转染miR-27b-3p-mimics,挽救miR-27b-3p 表达。普萘洛尔诱导后,实验结果显示与未转染miR-27b-3p-mimics 组相比miR-27b-3p IN-mimics 组细胞凋亡水平显著下降,细胞凋亡相关因子的基因和蛋白表达也显著被下调。
综上所述,本研究揭示普萘洛尔通过激活Apaf-1 介导的细胞凋亡通路治疗血管瘤,而miRNA-27b-3p 靶向抑制Apaf-1 表达,进而引起普萘洛尔诱导HUVECs 细胞凋亡水平下降,而这也是首次关于miR-27b-3p 在普萘洛尔治疗血管瘤中作用的报道。这些研究结果将加深普萘洛尔治疗婴幼儿血管瘤的理解,为普萘洛尔作为临床一线用药治疗婴幼儿血管瘤提供了理论基础。

