利拉鲁肽对高糖介导人牙周膜成纤维细胞的影响
赵东强 林仰东
(1天津市泰达医院口腔科,天津 300457;2天津市第一中心医院口腔科)
慢性牙周炎(CP)是一种普遍存在的慢性炎症性疾病,主要涉及牙齿周围支撑组织的炎症,如牙周和血管骨的破坏、牙齿松动,严重时可导致牙齿的脱落〔1,2〕,影响了全球大概11%的人口〔3〕。糖尿病已被明确确认为牙周炎的主要危险因素〔4~6〕,与非糖尿病患者相比,糖尿病患者患牙周炎的风险大约增加三倍〔7〕。因此,血糖水平的控制对于牙周炎的发生至关重要。炎症反应是糖尿病和牙周炎的共同特征,Ⅰ型和Ⅱ型糖尿病都受炎症因子水平增加的影响〔8〕。炎症水平的升高会导致糖尿病患者产生众多血管并发症,血糖水平的升高可导致炎症因子释放进一步增加、氧化应激加剧及造成细胞凋亡〔9〕。作为牙周组织的一部分,牙周韧带(PDL)是一种将牙齿与牙槽骨连接起来的专用组织纤维。PDL主要由成纤维细胞、成牙骨质细胞、成骨细胞和破骨细胞组成〔10〕。人类牙周韧带成纤维细胞(hPDLFs)是主要的成纤维细胞类型,可识别病原体,分泌炎症介质,如白细胞介质(IL)-8和IL-6,与牙周炎的发展密切相关〔11~13〕。因此,维持hPDLFs的免疫平衡被认为有利于牙周疾病的控制。
利拉鲁肽(Lira)是一种乙酰化胰高血糖素状肽-1类似物,与原生胰高血糖素样肽-1具有97% 氨基酸同源性,并且作用持久,临床上被广泛用于治疗2型糖尿病〔14〕。研究显示,Lira具有多重生物学效应,对牙周炎具有改善作用,可减轻其炎症反应〔15〕,在牙体牙周疾病治疗中的具有潜在应用价值,但是关于Lira对高糖诱导的hPDLFs损伤的保护作用及机制有待进一步研究。本文拟研究Lira对高糖介导hPDLFs损伤的影响及机制,探讨Lira在CP治疗领域里的应用前景。
1 材料和方法
1.1试剂和仪器 hPDLFs购自上海中乔新舟生物科技有限公司,大肠杆菌内毒素/脂多糖类(E.coli LPS,Sigma,美国)、辣根过氧化物酶(HRP)标记的山羊抗兔多克隆抗体、基质金属蛋白酶(MMP)-2、MMP-3、MMP-9、磷酸甘油醛脱氢酶(GAPDH)单克隆抗体(Santa Cruz),Trizol试剂盒(Invitrogen,美国),IL-8、IL-6、肿瘤坏死因子(TNF)-α、IL-1β酶联免疫吸附试验(ELISA)检测试剂盒(eBioscience)、CCK8细胞增殖检测试剂盒(碧云天)、Hoechst染色试剂盒(索莱宝)、Western印迹试剂盒(碧云天),相关引物合成(生工生物),DMEM低糖培养基、胎牛血清(Gibco,美国),CO2培养箱(ThermoFisher,美国),酶标仪(Bio-Rad公,美国)、Fluo-3/AM钙离子荧光探针(Invitrogen,Insight-PlusIQ型激光共聚焦显微镜(Meridian,美国),荧光相差显微镜(北京荣兴光恒科技有限公司)。
1.2方法
1.2.1人牙周膜成纤维细胞培养 hPDLFs培养在10%胎牛血清(FBS)的低糖DMEM培养基中,培养箱设置为37 ℃、5% CO2、饱和湿度。于荧光相差显微镜下观察细胞形态及生长状况,取对数生长期时用于后续实验。
1.2.2分组 hPDLFs调整密度为5×108个/L。对照组培养条件为:含11 mmol/L葡萄糖(GLU)常规培养基;甘露醇组:含19.5 mmol/L甘露醇培养基;高糖组:含40 mmol/L GLU培养基中培养;Lira 组:含40 mmol/L GLU和100 nmol/ml Lira的培养基。
1.2.3细胞增殖检测 使用CCK-8试剂盒检测细胞增殖,以1×104个细胞/孔在96孔板中种植细胞。24 h后,向其中加10 μl CCK-8试剂,96孔板在37 ℃孵育2 h,酶标仪上测定OD 450 nm值,细胞增殖率=(OD实验组/OD对照组)×100%。
1.2.4细胞内游离Ca2+浓度的测定 将hPDLFs细胞悬浮并与5 μmol/L Fluo-3/AM分子探针在 37 ℃下孵育45 min。使用Insight-PlusIQ型激光共聚焦显微镜观察细胞中Fluo-3/AM的荧光强度。
1.2.5Hoechst染色检测细胞凋亡率 未经处理和处理的细胞在磷酸盐缓冲液中洗两次,并固定在含有4%甲醛的磷酸盐缓冲液中,之后用水冲洗,滴加上Hoechst染色液(最终浓度,10 μg/ml)10 min。在染色后,用荧光显微镜观察到细胞核的形态。
1.2.6含半胱氨酸的天冬氨酸蛋白水解酶(Casp-ase)3、6、9活性的检测 采用荧光比色法测定hPDLFs中Caspase 3、6、9的活性。收集不同处理组hPDLFs,加入提前遇冷的裂解液(50 μl/1×106细胞),混匀后,置于冰上10 min;以2 991 r/min离心10 min,吸取上清液,测定蛋白浓度,加入50 μl特异性的荧光报告底物,分别检测hPDLFs中Caspase3、6、9的活性。通过荧光分光光度计定量检测各组hPDLFs中的Caspase3、6、9的活性变化情况。
1.2.7ELISA测定细胞上清液MMP-2、MMP-3和MMP-9的含量 采用ELISA按说明书测定4个实验组hPDLFs细胞上清液中MMP-2、MMP-3和MMP-9的含量,经离心后,收集各组细胞上清液,按相应的试剂盒说明书检测相关因子含量,于PR-521酶标仪读取各细胞OD值,按照试剂盒指示计算MMP-2、MMP-3和MMP-9的含量。
1.2.8Wnt3a连环蛋白β(CTNNB)1、Bcl关联X蛋白(Bax)、重组人B细胞淋巴瘤因子2XL(Bcl-xl)mRNA的表达测定 收集细胞,加入Trizol试剂提取总RNA。行逆转录合成相应的cDNA。逆转录条件为:25 ℃ 10 min,48 ℃ 30 min,95 ℃ 5 min。利用合成的cDNA为底物依据qRT-PCR说明书行检测相应指标mRNA的含量,qRT-PCR条件为:95 ℃预变性1 min,95 ℃变性30 s,59 ℃退火30 s,59 ℃延伸30 s,共40个循环。以GAPDH为内参,利用2-ΔΔCt法计算进行结果分析。所用引物序列见表1。
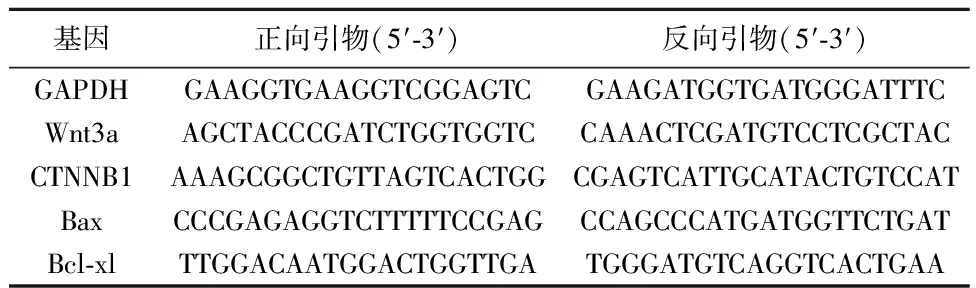
表1 qRT-PCR的引物序列
1.2.9Wnt3a、CTNNB1、Bax、Bcl-xl蛋白表达水平检测 处理结束后收集细胞,使用RIPA裂解提取总蛋白质。蛋白质浓度由BCA试剂测定,调整为4 μg/μl,由12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,并转移到聚偏氟乙烯(PVDF)膜。然后,5%的脱脂奶粉孵育2 h,然后加入相应的一抗抗体(1∶1 000)在4 ℃的孵育过夜。次日,残留的一抗抗体通过对苯二甲酸丁二醇酯(PBST)清洗去除,加入HRP标记的山羊抗兔免疫球蛋白(Ig)G二次抗体(1∶5 000)室温孵育1 h,然后用PBST冲洗3次,每次5 min,多余的液体用过滤纸吸收。电化学发光(ECL)显色液显色,采用ImageJ软件扫描蛋白质条带并分析灰度值。蛋白质的相对表达水平=目标蛋白带/GAPDH蛋白条带的灰度值。
1.3统计学分析 采用SPSS24.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1hPDLFs培养鉴定 当hPDLFs细胞接种1 d后,镜下观察,可见大部分细胞贴壁,细胞呈长梭形或多角形,胞质均匀,胞体丰满,细胞两端的突起明显可见。取传代后处于对数生长期的hPDLFs细胞,于相差显微镜下观察,细胞呈栅栏状或放射状。于免疫荧光显微镜观察,绿色荧光指示细胞波形丝蛋白,为中胚层来源的成纤维细胞(图1)。
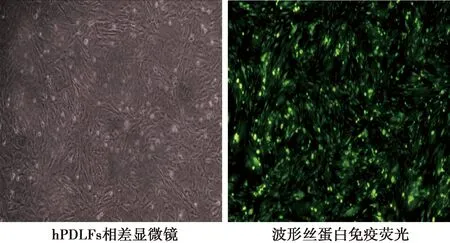
图1 hPDLFs相差显微镜观察及免疫荧光染色(×200)
2.2细胞存活率及细胞内钙离子浓度 与对照组和甘露醇组比较,高糖组hPDLFs细胞内游离Ca2+浓度显著增加,细胞增殖率显著降低(P<0.05)。与高糖组比较,Lira组细胞内游离Ca2+浓度显著降低,细胞增殖率显著升高(P<0.05)。见表2。

表2 细胞增殖率及细胞内钙离子浓度、细胞中及细胞上清液Caspase3、Caspase6、Caspase9含量
2.3Caspase3、Caspase6、Caspase9含量测定 与对照组和甘露醇组相比较,高糖组hPDLFs细胞中及细胞上清中MMP-2、MMP-3、MMP-9的含量均显著升高(均P<0.05)。与高糖组比较,Lira组hPDLFs细胞中及细胞上清液中MMP-2、MMP-3、MMP-9的含量均显著降低(均P<0.05)。见表2。
2.4Hoechst染色凋亡率检测结果 与对照组〔(6.45±1.19)%〕和甘露醇组〔(8.23±1.13)%〕相比较,高糖组细胞凋亡率〔(41.62±1.97)%〕显著增加(均P<0.05);与高糖组相比较,Lira组细胞凋亡率〔(22.70±2.73)%〕明显降低(P<0.05)。见图2。

图2 hPDLFs细胞凋亡率检测(Hoechst染色,×200)
2.5各组Wnt3a、CTNNB1、Bax、Bcl-xl mRNA及蛋白表达水平 与对照组和甘露醇组相比,高糖组hPDLFs细胞Wnt3a、CTNNB1、Bax mRNA及蛋白表达显著升高(均P<0.05),Bcl-xl mRNA及蛋白表达显著降低(P<0.05)。与高糖组比较,Lira组hPDLFs细胞Wnt3a、CTNNB1、Bax mRNA及蛋白表达显著降低(均P<0.05),Bcl-xl mRNA及蛋白表达显著升高(P<0.05)。见表3、图3。
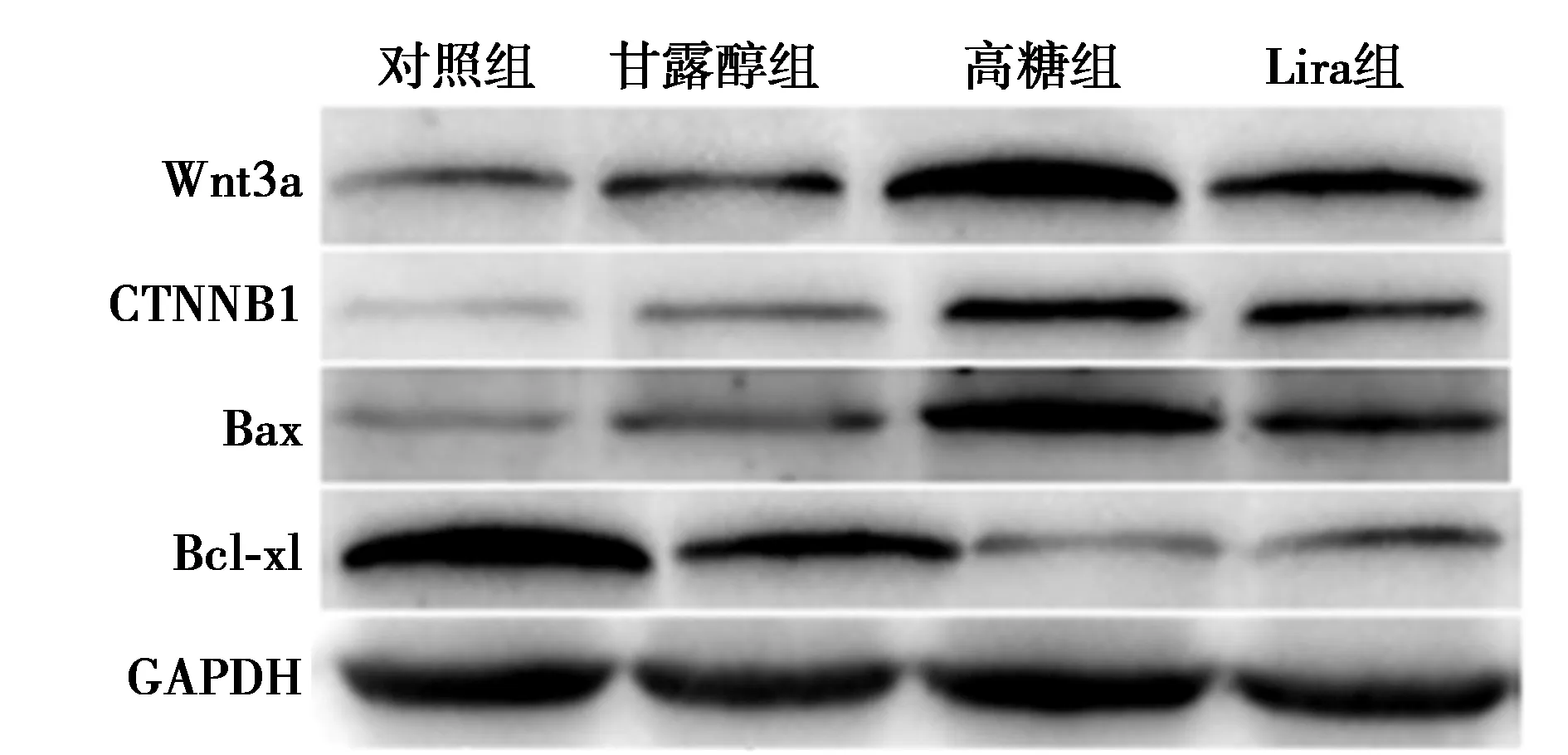
图3 Wnt3a、CTNNB1、Bax、Bcl-xl 蛋白表达

表3 各组Wnt3a、CTNNB1、Bax、Bcl-xl mRNA及蛋白表达水平
3 讨 论
牙周炎被认为是人类最常见的疾病之一,目前在全世界范围内呈明显增长趋势,全世界总体患病率为11.2%〔16〕。我国牙周炎患病率远远高于世界平均水平,根据最近发布的《中国第四次流行病学抽样调查》,在35~44岁年龄段人群中,牙周炎患病率约为90.9%。牙周炎是世界牙齿流失的主要原因,并给社会造成巨大的经济负担,牙周炎的治疗仍然是一个长期且艰巨的任务〔17〕。
Wnt信号通路被认为是人体内重要的信号通路,它调节生物体生长、发育,并控制细胞命运,如增殖、分化、凋亡和癌变。自21世纪初人类遗传学研究报告了Wnt信号通路成员与骨质疏松之间联系以来,Wnt信号通路在骨骼发育相关疾病中被广泛关注〔18〕,人们普遍认为,Wnt信号与牙周炎的发展有关。研究表明,Wnt3a在骨细胞的分化中具有重要的调节作用。在骨细胞分化早期可以诱导碱性磷酸酶的活性,促进骨细胞的分化〔19〕。在骨细胞分化后期阶段,Wnt3a可以调节骨原蛋白和骨蛋白(OPG),从而调节骨细胞的分化〔20〕。本研究结果说明高糖诱导hPDLFs细胞损伤模型制备成功;在牙周炎中存在Wnt信号通路的激活;牙周炎发作过程,利拉鲁肽在一定程度上通过Wnt/CTNNB1信号通路发挥作用。MMPs是胞外蛋白酶家族,负责细胞外基质的重塑和降解〔21〕。研究显示,MMPs是与牙周疾病相关的组织破坏过程中最重要的途径〔22〕。先前的研究表明,在牙周炎患者的牙周组织中检测到MMP-1、MMP-2、MMP-3、MMP-8、MMP-9水平显著升高〔23〕。本研究中,高糖处理hPDLFs细胞损伤后,细胞上清液中MMP-2、MMP-3、MMP-9表达升高,与上述研究结果相一致。
综上,利拉鲁肽处理后可显著抑制高糖引起的hPDLFs细胞损伤后导致的细胞凋亡及凋亡相关因子释放,改善hPDLFs细胞损伤。利拉鲁肽可降低细胞上清液中MMP-2、MMP-3和MMP-9含量及抑制Wnt信号通路成员Wnt3a和CTNNB1表达。本研究结果可为临床上牙周炎的治疗提供借鉴,并为利拉鲁肽在牙周炎治疗中应用提供理论基础。

