长期电子烟或传统香烟暴露的小鼠肺脏转录组学差异分析
季申健 王玉秀 顾建军 闵凌峰
(扬州大学临床医学院,江苏 扬州 225001)
吸烟是全身多种疾病的独立危险因素,如肺癌、慢性阻塞性肺疾病(COPD)、冠心病及脑梗死等。电子烟是一种靠电池产生动力的装置,在加热时能将里面的液体变成气体状态,供人吸入。目前电子烟被当作戒烟工具而使用〔1〕。现在尽管电子烟装置日益升级发展,但电子烟的主要成分不外乎包括:尼古丁、植物甘油、丙二醇和多种调味剂〔2〕。虽然研究显示电子烟中尼古丁与慢性疾病的不良生物反应存在明显相关性〔3〕,但国外普遍认识:①电子烟中的尼古丁等有毒物质颗粒含量较传统香烟低,短期吸入时对人体影响小,电子烟可以作为戒烟工具使用,甚至被推广使用。②电子烟中含有的植物甘油、丙二醇和多种调味剂一般被用作食品添加剂,但在电子烟气溶胶中,这些加热成分被吸入能否导致肺损伤因缺乏对照而暂未有定论,尤其在长期暴露情况下。反观国内,体外细胞培养、动物模型的研究认为电子烟气溶胶和液体会引起不良反应,包括炎症、氧化应激反应和培养细胞死亡等〔4,5〕。以上事实说明电子烟对人体的危害还是存在,不能忽视,尤其长期暴露对人体肺组织的影响仍需探讨。电子烟在当今很受欢迎,尤其是IQOS 品牌。最近公布的使用数据中显示其已有显著增长,特别在年轻人群中〔6,7〕。由于IQOS品牌是新型电子烟,且缺乏足够多的科学证据证明其危害性,因此许多人认为电子烟是无害的,可以作为香烟的安全替代品。但是,通过对经常使用电子烟的人群进行肺泡灌洗,并对灌洗液中的基因/蛋白质集分析表明:电子烟产生的气溶胶对人类气道有显著且广泛的急慢性炎症反应,具有明显的肺脏毒性〔8〕,所以电子烟产生的人体危害必须引起足够的重视。
目前研究显示,电子烟对机体的各个系统均有一定的影响,如心血管系统〔9~11〕、神经系统〔12~14〕、呼吸系统等,尤其是呼吸系统。Park等〔15〕采用实时荧光定量聚合酶链反应(PCR)方法分析了电子烟气溶胶对人支气管上皮细胞的影响,结果显示,暴露在电子烟气溶胶下会诱导上皮细胞纤毛相关基因的下调,导致呼吸道纤毛的功能降低,进而无法正常清除气道黏液,造成第1秒用力呼气容积(FEV1)下降,推测吸食电子烟同样可产生相似COPD病理生理学改变。 Staudt等〔16〕和Cervellati等〔17〕采用微阵列方法对传统吸烟者、电子烟使用者和不吸烟者的肺泡巨噬细胞、肺泡上皮细胞样本进行分析,结果显示电子烟的使用同样改变了巨噬细胞差异基因的表达,涉及炎症和免疫反应,导致了与传统吸烟类似的肺部变化。以上结果充分提示了电子烟对机体潜在的不利影响。
为理解电子烟与肺部组织差异基因的相关性,本研究建立了小鼠模型,利用转录组学技术,深入探究电子烟及传统香烟对小鼠肺组织影响及差异基因功能学分析,为电子烟及传统香烟对机体的分子生物学影响提供新思路、新方向。
1 材料与方法
1.1动物及分组 30只8周龄体质量24~27 g,SPF自交系C57BL/6J雄性小鼠,均购自北京维通利华实验动物中心〔许可:SCXK(北京)2016-0006〕。随机分为正常对照组、传统香烟组、电子烟组,每组10只,在扬州大学动物中心饲养,温度21~23 ℃,湿度50%~60%,自由饮水进食,昼夜节律12 h。实验过程中给予实验动物3R原则的人道关怀。所有动物研究经扬州大学动物伦理委员会批准。
1.2主要仪器与试剂 Marlboro牌红香烟(1.2 mg尼古丁,美国菲利普莫里斯烟草公司);Marlboro牌HeatSticks(1.29 mg尼古丁,美国菲利普莫里斯烟草公司)。电子烟IQOS加热器(美国菲利普莫里斯烟草公司)。仪器与设备:烟熏箱(自制有机玻璃箱,90 cm× 40 cm × 30 cm)。光学显微镜、肺功能仪(flexiVent;SCIREQ,Montreal,加拿大)。
1.3动物造模 喂养2 w后开始造模。电子烟组及传统香烟组分别被置于自制的烟熏箱中。为匹配尼古丁浓度:一支Marlboro牌红香烟抽吸8次,一支HeatSticks抽吸12次。电子烟组及传统香烟组分别暴露于电子烟气溶胶和香烟烟雾中30 min,每次5支,间隔4 h,2次/d,5 d/w,共6个月;正常对照组则自由呼吸空气6个月。记录每组一般情况。
1.4肺功能检测 造模结束后行肺功能检测。在小鼠腹膜内注射0.5%戊巴比妥钠(50 mg/kg)予以麻醉处理,常规进行固定,备皮,消毒后剪开小鼠颈部皮肤,并且小心予以钝性分离,使小鼠充分暴露出气管,进而在气管与软骨环之间水平处轻柔剪开小鼠气管,气管切开后立即行气管插管,并将小鼠置于体描箱内,保持头低位,与呼吸机管路相连,行机械通气测肺功能。在测定过程中,采用外加压力的办法,使动物深吸气/深呼气,电脑自动快速而准确地测出各项指标。测定指标有用力肺活量(FVC)、50 ms用力呼气容积(FEV0.05)、FEV0.05/FVC%。在扬州大学医学院机能实验中心进行小鼠的肺功能检测,为保证肺功能数据的准确性,均安排同一人进行实验操作。
1.5肺组织获取及处理 小鼠腹膜内注射0.5%戊巴比妥钠(50 mg/kg)后予以麻醉处理,处死小鼠后,收集小鼠的肺组织,进行多聚甲醛固定,石蜡包埋,随后进行切片,每张切片厚度为5 μm,进行苏木素-伊红(HE)染色,并使用光学显微镜观察小鼠肺组织的病理形态。
1.6转录组学测序 使用Illumina HiSeq平台检测样品,用mRNA富集法对totalRNA进行处理,mRNA富集:用带有OligodT的磁珠富集有polyA尾巴的mRNA;得到的mRNA中加入适量打断试剂高温条件下使其片断化,以打断后的mRNA为模板合成一链 cDNA,然后配制二链合成反应体系合成二链cDNA,并使用试剂盒纯化回收、黏性末端修复、 cDNA 的3′末端加上碱基“A”并连接接头,进行片段大小选择,最后进行 PCR 扩增;构建好的文库用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System质检,合格后进行测序(由杭州景杰公司代理完成)。测序所得的原始数据称为raw reads。首先,过滤掉低质量、接头污染及未知碱基N含量过高的reads,本实验使用华大自主研发的过滤软件SOAPnuke进行统计,使用trimmomatic进行过滤,过滤后的数据称为clean reads。然后将clean reads比对到参考基因组上,之后进行新转录本预测、 SNP &InDel 和差异剪接基因检测。得到新转录本后,将具有蛋白编码潜力的新转录本加入参考基因序列中构成一个完整的参考序列,计算基因-蛋白质表达水平。
1.7差异基因筛选及生物信息学分析 当基因丰度差异倍数达2倍及以上,且统计学检验P<0.05时,视为候选差异基因;将每组样品组间两两比较,统计得到差异基因数量,在3组样品间均有差异的基因作为差异基因。将筛选所得的差异基因做GO、KEGG功能富集分析。
1.8统计学分析 使用SPSS13.0软件进行t检验。
2 结 果
2.13组肺功能及肺组织学改变 相较于正常对照组,传统香烟组FEV0.05、FEV0.05/FVC显著下降(P<0.05);电子烟组FEV0.05、FVC、FEV0.05/FVC显著下降(P<0.05)。与传统香烟组比较,电子烟组FEV0.05、FVC均下降,且FVC下降有统计学差异(P<0.05)。见表1。从肺组织肺病理学角度看,相较于正常对照组,传统香烟组及电子烟组肺泡腔均存在明显扩张。见图1。
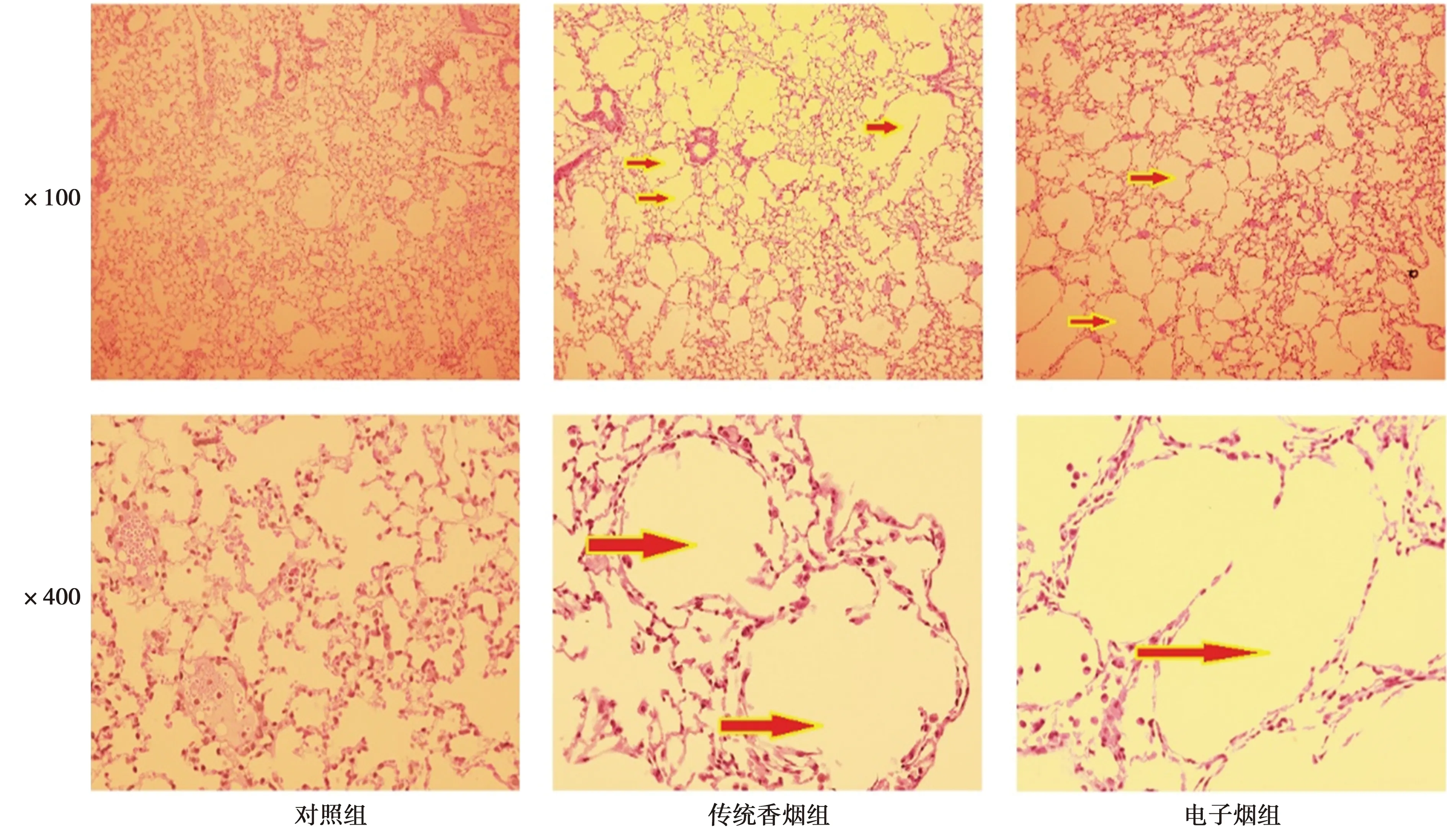
图1 3组肺组织(HE染色)
表1 3组肺功能比较
2.23组肺组织差异基因分析 基因组学测序分析结果提示,相较于正常对照组,传统香烟组发现1 089个差异基因,其中678个为表达上调基因,411个为表达下调基因;电子烟组发现1 044个差异基因,其中 598个为表达上调基因,446为表达下调基因;传统香烟组与电子烟组之间,发现811个差异基因,其中499个为表达上调基因,312个为表达下调基因,见图2。同时对差异基因进行韦恩图分析,见图3。
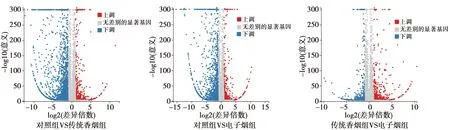
图2 火山图:3组肺组织差异基因

图3 韦恩图:3组肺组织差异基因
2.33组肺组织差异基因GO聚类分析和功能富集分析 相较于正常对照组,传统香烟组通过GO聚类分析,差异基因生物学过程主要聚类在生物调节、细胞转化及应激反应这3个生物学过程;细胞组成成分主要聚类在胞外区、细胞膜及细胞器细胞组成成分;分子功能学主要聚类在黏附、催化活性分子功能学过程。相较于正常对照组,电子烟组通过GO聚类分析,差异基因生物学过程主要聚类在生物调节、细胞转化、发育过程、多生物学过程及应激反应这5个生物学过程;细胞组成成分主要聚类在胞外区、细胞膜及细胞器细胞组成成分;分子功能学主要聚类在黏附、催化活性分子功能学过程。与电子烟组相比较,传统香烟组通过GO聚类分析,差异基因生物学过程主要聚类在生物调节、细胞转化、发育过程、代谢过程、多生物学过程及应激反应生物学过程;细胞组成成分主要聚类在胞外区、细胞膜及细胞器细胞组成成分;分子功能学主要聚类在黏附、催化活性分子功能学。见图4。

图4 3组肺组织差异基因GO聚类分析
2.43组肺组织差异基因KEGG聚类分析和功能富集分析 相较于正常对照组,传统香烟组通过KEGG聚类分析,差异基因主要聚类在癌性疾病以及感染性疾病;主要聚类在运输与代谢、信号传导、翻译及免疫系统;电子烟组通过KEGG聚类分析,差异基因主要聚类在癌性疾病及感染性疾病;主要聚类在运输与代谢、信号传导、翻译及免疫系统。与电子烟组相比较,传统香烟组通过KEGG聚类分析,差异基因生物学过程主要聚类在运输与代谢、信号传导、翻译及免疫系统。见图5。
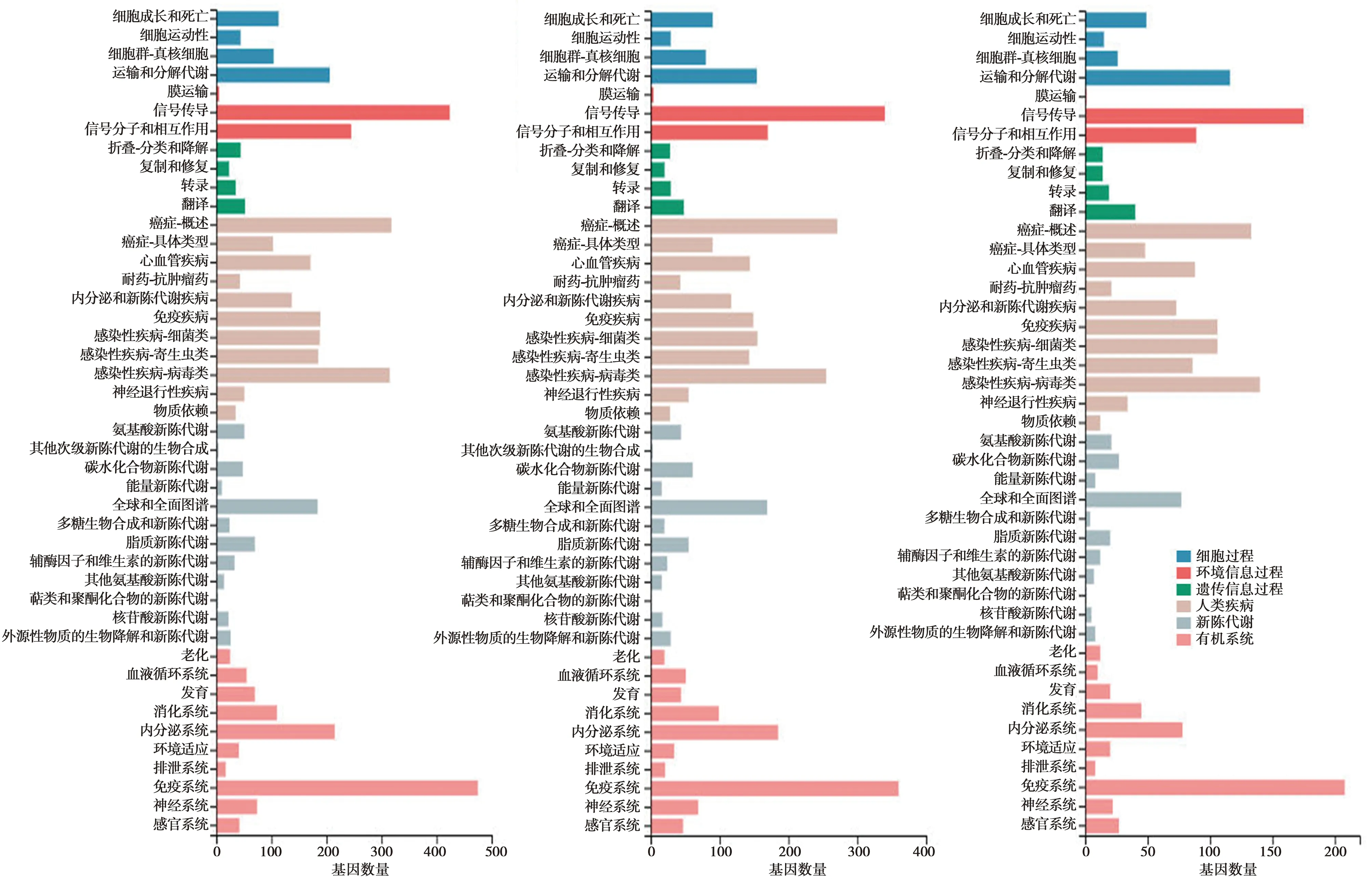
图5 3组肺组织差异基因KEGG聚类分析
3 讨 论
本研究说明,电子烟同样会造成小鼠气道阻力增加,肺组织弹性下降。Ferrari 等〔18〕研究结果提示,电子烟的短期使用对非吸烟者没有直接的不良影响,对吸烟者的FEV1和用力呼气流量(FEF)25只有很小的影响。而Meo 等〔19〕研究结果显示电子烟组肺功能(FEV1、FEV1/FVC、FEF25%、FEF50%、FEF75%、FEF25%~75%、FEF75%~85%)明显下降(P<0.05)。提示不管短期还是长期电子烟使用均可对机体肺功能产生一定的影响。所以和传统香烟相比,电子烟不是作为戒烟工具的最佳选择,两者同样都能引起肺功能的慢性下降和恶化。
本研究结果提示,不管是传统香烟组还是电子烟组,差异基因多分布在细胞的胞质细胞器结构上,两者在差异表达方面多有重合,且差异基因表达GO富集分析多主要聚类在生物调节、细胞转化、发育过程、代谢过程、多生物学过程及应激反应过程。传统香烟烟雾诱导肺组织病理性改变的机制多种多样,包括调节细胞增殖〔20〕、诱导细胞凋亡、调节机体免疫反应〔21,22〕及诱导炎症、氧化应激〔23,24〕等多种方式。本研究发现,电子烟诱导肺组织病理改变机制主要涉及炎症、氧化应激、细胞凋亡、调节细胞增殖等。本文观察到电子烟诱导的肺部炎症中,金属蛋白酶(MPO)、基质金属蛋白酶(MMP)-8、MMP-9等炎症基因上调;而在传统香烟组则没有发现这些上述基因。MMP-8、MMP-9属于MMP家族,在过氧化物酶体增生物激活受体(PPAR)γ和骨钙蛋白(OPN)通路及趋化因子相互诱导下,主要由中性粒细胞分泌,而中性粒细胞是参与气道炎症的主要细胞〔25,26〕。相关研究已表明气道炎症过程中,MMP-8、MMP-9会大量分泌,与气管扩张和肺组织破坏关系密切〔27〕。从电子烟组小鼠的肺组织病理观察到,这些上调基因参与导致肺损害的炎症过程。以往发现在传统香烟烟雾暴露下,MMP-12、MMP-1等同样也可诱导肺部产生炎症〔28〕。由此可见,这些基因所涉及的促炎机制基本相同,故提示了电子烟和传统香烟均可引起小鼠肺组织的炎症反应,电子烟并不是没有危害。在氧化应激方面,本研究发现电子烟组和传统香烟组都有下调抗氧化的基因,并且电子烟组高于正常对照组,如NAD(P)H醛脱氢酶1明显下调。NAD(P)H醛脱氢酶1可减少氧化应激诱导的自由基的形成,而抗氧化基因下调能导致肺部氧化/抗氧化失衡,一旦失衡产生能损伤气道上皮细胞进而导致小气道病理改变。以上发现说明电子烟也可导致体内氧化应激产生。在细胞增殖和凋亡方面,本研究发现电子烟组信号传导及转录激活蛋白(STAT)1表达下调,而转化生长因子(TGF)β-1则表达上调;而在传统香烟组则未发现STAT1。STAT1是STAT家族蛋白的一员〔29〕,该基因表达与抑制肿瘤发生有关,一般与酪氨酸激酶(JAK)结合形成信号通路,可促进肿瘤细胞凋亡,从而发挥抗肿瘤作用〔30,31〕,而且研究显示吸烟可导致STAT家族蛋白信号传导失调,可能还会促进肺癌的侵袭、转移〔32,33〕。TGFβ-1在活性氧作用下,通过结合多种Smad蛋白通路,在肿瘤微环境下可以帮助肿瘤细胞逃逸,它与肿瘤的发生和发展密切相关〔34〕。另外还有多种信号通路,包括核转录因子(NF)-κB〔35〕、磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)〔36,37〕等也参与烟草烟雾诱导的生物学改变过程。相关研究认为在电子烟气溶胶暴露条件下,某些常见涉及炎症、氧化应激等基因表达或有限或明显上调,可能与电子烟品种、尼古丁含量、实验小鼠品系、长短期持续暴露等有关〔38~40〕。结合本实验电子烟组和传统香烟组的转录组学差异结果,本文推测这些差异基因改变机制或许跟Czekala等〔38〕研究保持一致,需在后续实验中进一步论证。
综上,电子烟具有和传统香烟的危害性,甚至更甚于传统香烟对机体呼吸系统的危害。一方面长期暴露于电子烟可导致肺功能、肺弹性的下降,另一方面可诱导肺组织肺泡腔的扩大及炎性细胞的浸润,久之导致肺部结构的变化。

