巴戟天含药血清对高糖诱导的血管内皮细胞FOXP2/AGGF1信号通路及增殖、迁移的影响
黎珊珊 区岛良 张梅 谢桃梅
(儋州市人民医院内分泌科,海南 儋州 571700)
糖尿病(DM)是一种以高血糖、胰岛素抵抗和相对胰岛素缺乏为特征的代谢性疾病〔1〕。高血糖引起的血管并发症,导致DM患者的发病率和死亡率显著增高〔2,3〕。DM血管并发症主要表现为血管内皮损伤和功能障碍,与血管内皮细胞数量减少密切相关〔4〕。因此,寻找新的药物,抑制高血糖诱导的内皮细胞受损对临床治疗DM血管并发症,改善DM治疗效果具有重要意义。巴戟天是一种茜草科植物中草药,具有治疗肾虚、宫冷不孕和阳痿遗精等功效,且已被证实能够促进血管生成〔5〕。叉头框蛋白(FOX)P2是叉头盒蛋白家族成员之一,能够在转录水平上促进G补缀FHA域血管生成因子(AGGF)1表达,增强血管内皮细胞的增殖和迁移〔6〕。然而,巴戟天对高糖诱导下血管内皮细胞功能的影响及其作用机制尚不清楚。本实验旨在探索巴戟天含药血清对人脐静脉内皮细胞(HUVEC)增殖、凋亡及迁移的影响,并初步研究其与FOXP2/AGGF1通路的关系。
1 材料与方法
1.1实验细胞、药品及试剂 HUVEC(批号CL-0122)购自武汉普诺赛生命科技有限公司;巴戟天(批号14000863870)购自国药集团冯了性(药材)饮片有限公司;内皮细胞培养基(ECM,批号1001)、噻唑蓝(MTT)试剂盒(批号M8180)、胎牛血清(批号11011-8611)、0.25%胰蛋白酶消化液(批号T1350)、Trizol试剂盒(批号15596-018)、逆转录试剂盒(批号T2210-200T)、RIPA裂解液(批号R0010)、基质胶(批号356234)、电化学发光(ECL)液(批号PE0010)均购自北京Solarbio公司;膜联蛋白Ⅴ-异硫氰酸荧光素/碘化丙啶(Annexin Ⅴ-FITC/PI)双染细胞凋亡检测试剂盒(批号KGA108)购自南京凯基生物科技发展有限公司;FOXP2、AGGF1及GAPDH引物均由上海生工生物工程有限公司合成;FOXP2兔抗人单克隆抗体(批号720031)、AGGF1兔抗人多克隆抗体(批号A303-633A)、GAPDH兔抗人多克隆抗体(批号PA1-16777)、山羊抗兔lgG(H+L)二抗(批号A32731)均购自美国Thermo Fisher Scientific公司。
1.2主要仪器 BBD6220型二氧化碳细胞培养箱购自美国Thermo Fisher Scientific公司;2720型实时荧光定量PCR(qRT-PCR)仪购自美国ABI公司;Gel DocTMXR+型凝胶成像仪、ELX-8081U型酶标仪均购自美国Bio-Rad公司;MA100N型倒置显微镜购自日本Nikon公司。
1.3方法
1.3.1含药血清和不含药血清的制备 选取5周龄健康清洁级雄性SD大鼠24只,体质量100~140 g,购自华中科技大学实验动物中心,实验动物生产许可证号:SCXK(鄂)2018-0009,实验动物使用许可证号:SYXK(鄂)2018-0057,动物质量合格证号:DM0019101307,大鼠饲养于海南省疾病预防控制中心,禁食12 h后,随机分成4组,即不含药血清组、0.5 g/kg巴戟天给药组、1.0 g/kg巴戟天给药组和2.0 g/kg巴戟天给药组,每组6只,1 g巴戟天相当于生药3 g,给予灌胃处理,药物剂量等效于临床剂量(按照人和动物表面积折算等效剂量比率计算)。给药方式:2次/d,2 ml/次,连续灌胃3 d,第4天一次性服用全天剂量,不含药血清组给予等量生理盐水灌胃。禁食12 h,采血,末次给药1 h后,乙醚麻醉,无菌条件下心脏采血、静置2 h,离心(3 000 r/min,15 min),分离上清液,同组混合,56 ℃水浴灭活30 min,分装后得不含药血清、0.5、1.0和2.0 g/kg巴戟天含药血清,-20 ℃保存备用。本实验通过儋州市人民医院伦理委员会批准,实验严格遵循3R原则。
1.3.2细胞培养 将新购置的HUVEC用ECM完全培养基(含10%胎牛血清+1%内皮细胞生长因子+1%青霉素/链霉素混合液)于37 ℃、5%CO2细胞培养箱中培养,待细胞融合80%左右,胰酶消化传代,收集3~5代对数期生长的细胞用于后续实验。
1.3.3高糖模型的建立 将1.3.2中HUVEC接种于96孔板(4.5×104个/孔),随机分为对照组和高糖组,D-葡萄糖终浓度为:对照组(5.5 mmol/L)、高糖组(10、15、20、30、40 mmol/L),每组6个复孔,并设置调零孔,培养24 h,采用MTT法检测各组细胞存活率:吸去上清液,每孔添加100 μl二甲基亚砜(DMSO),充分震荡后,酶标仪检测各孔570 nm下吸光值(OD值),计算存活率,存活率(%)=(实验孔OD值-调零孔OD值)/(对照组OD值-调零孔OD值)。取存活率为50%左右的高糖浓度建立HUVEC损伤模型。
1.3.4含药血清干扰后细胞活性检测 收集1.3.3中使用30 mmol/L D-葡萄糖诱导24 h的HUVEC,接种于96孔板(4.5×104个/孔),随机分为空白对照组、对照组、巴戟天低、中、高剂量组,用1.3.1中制备的不含药血清和不同浓度的巴戟天含药血清对应处理对照组、巴戟天低、中、高剂量组细胞,空白对照组不做任何处理,24 h后,采用MTT法检测各组细胞的存活率。
1.3.5Annexin Ⅴ-FITC/PI实验 收集1.3.2中HUVEC,接种于6孔板(1.2×106个/孔),按照1.3.4中方法随机分组并处理,每组设置6个复孔。胰酶(不含EDTA)消化收集细胞,磷酸盐缓冲液(PBS)清洗、离心、500 μl结合缓冲液重悬,加入10 μl/管Annexin Ⅴ-FITC和5 μl/管 PI,混合均匀,避光保存15 min,吹打均匀后,流式细胞仪检测各组HUVEC凋亡情况。凋亡率(%)=凋亡早期细胞比例+凋亡晚期细胞比例。
1.3.6划痕实验 调整1.3.2中HUVEC密度为6×105个/ml,接种于6孔板(2 ml/孔),待细胞汇合率大于85%,使用200 μl枪头做划痕处理,按照1.3.4中分组方法并处理24 h,每组设置6个复孔,显微镜下观察并记录,ImageJ处理图像,计算各组HUVEC平均愈合率。愈合率=(0 h划痕距离-24 h划痕距离)/0 h划痕距离×100%。
1.3.7Transwell实验 收集1.3.2中HUVEC,接种于包被Matrigel基底胶的Transwell上室(5×106个/ml,200 μl),按照1.3.4中方法分组并处理,每组设置6个复孔,分别加入200 μl无血清ECM培养基。下室加入对应浓度的巴戟天含药血清及200 μl ECM完全培养基,孵育24 h。取出小室,甲醛固定25 min,结晶紫染色20 min,风干,随机选取6个视野,显微镜下观察并计数。
1.3.8qRT-PCR实验 参照Trizol说明书,提取1.3.4中各组细胞总RNA,并计算RNA纯度(OD260 nm/OD280 nm)。反转录得cDNA。取2.5 μl cDNA模板,上下引物各1 μl,对各组HUVEC细胞FOXP2、AGGF1进行PCR扩增。PCR条件:95 ℃预变性3 min,95 ℃变性30 s,58 ℃退火45 s,62 ℃延伸30 s,共40次循环。以GAPDH为内参,采用2-ΔΔCt法分析目标基因表达情况。引物序列如下:FOXP2上游引物5′-TGGATGACCGAAGCACTGCTCA-3′,下游5′-TGGGAGATGGTTTGGGCTCTGA-3′;AGGF1上游引物5′-TGGTCCAACACTAAGTAAGGAGG-3′,下游5′-CCCTACGTTTTCCAGCTCTATCT-3′;GAPDH上游引物5′-GGAGCGAGATCCCTCCAA-AAT-3′,下游5′-GGCTGTTGTCATACTTCTCATGG-3′。
1.3.9Western印迹分析实验 按照1.3.4中方法分组、铺板并使用巴戟天含药血清处理后,加入250 μl/孔RIPA裂解液低温裂解30 min,离心收集上清。12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜、封闭液封闭4 h,加入一抗FOXP2、AGGF1和GAPDH(1∶5 000),室温孵育2 h,TBST洗膜3次,加入二抗(1∶10 000),TBST洗膜3次,ECL曝光显影,观察条带并拍照记录,Image-J处理图片,以GAPDH为内参,计算FOXP2/GAPDH、AGGF1/GAPDH比值。
1.4统计学方法 采用SPSS22.0软件进行方差分析,进一步两组间比较行SNK-q检验。
2 结 果
2.1高糖诱导对HUVEC增殖抑制作用 与对照组〔(97.48±2.11)%〕相比,高糖组(10、15、20、30、40 mmol/L)HUVEC存活率依次降低〔(97.48±2.11)%、(91.09±3.34)%、(84.27±2.23)%、(71.77±3.06)%、(51.69±2.47)%、(37.84±2.63)%,P<0.05〕。
2.2巴戟天含药血清对HUVEC活性影响 与空白对照组和对照组相比,巴戟天低、中、高剂量组HUVEC存活率依次明显升高(P<0.05),呈剂量依赖性。见表1。

表1 巴戟天含药血清作用后各组HUVEC存活、凋亡、迁移及侵袭
2.3巴戟天含药血清对HUVEC凋亡的影响 与空白对照组和对照组相比,巴戟天低、中、高剂量组HUVEC凋亡率依次明显降低(P<0.05),呈剂量依赖性。见表1、图1。

图1 各组细胞凋亡
2.4巴戟天含药血清对HUVEC迁移能力、侵袭数量的影响 与空白对照组和对照组相比,巴戟天低、中、高剂量组HUVEC划痕愈合率、侵袭数量依次明显升高(均P<0.05),呈剂量依赖性。见表1、图2、图3。

图2 各组HUVEC迁移(×100)

图3 巴戟天含药血清对HUVEC侵袭能力的影响(结晶紫染色,×200)
2.5巴戟天含药血清对HUVEC FOXP2及AGGF1表达的影响 与空白对照组和对照组相比,巴戟天低、中、高剂量组中FOXP2、AGGF1 mRNA及蛋白表达水平依次明显升高(P<0.05),呈剂量依赖性。见表2、图4。
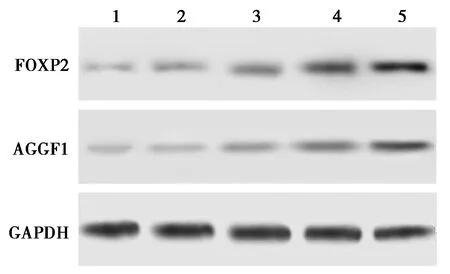
1~5:空白对照组、对照组、巴戟天低剂量组、巴戟天中剂量组、巴戟天高剂量组图4 Western印迹检测各组HUVEC FOXP2、AGGF1蛋白表达

表2 各组FOXP2、AGGF1 mRNA及蛋白表达比较
3 讨 论
在我国,DM发病率高达10.9%,居全球第一〔7〕。血管并发症是导致DM患者死亡率高的首要原因,而血管内皮细胞损伤是血管并发症的标志〔8〕。高糖状态能够抑制血管内皮细胞的增殖,并诱导凋亡,损伤血管内皮〔9〕,因此,减轻高糖诱导下血管内皮细胞的损伤作用是潜在的治疗目标。本研究首先构建了高糖损伤模型,结果显示,当D-葡萄糖浓度大于30 mmol/L,HUVEC损伤严重(存活率<50%),不利于后续研究,因此选择30 mmol/L作为模拟高血糖损伤内皮细胞的最佳浓度。
巴戟天药材来源于巴戟天干燥根,主要成分有寡糖、蒽醌、环烯醚萜等,在滋补肾阳方面具有良好的功效〔10〕。近年来,冉志芳等〔11〕研究发现,巴戟天能够促进斑马鱼节间血管生成;另外,作为巴戟天主要活成物质之一,巴戟天糖链对血管内皮细胞的增殖、分化具有促进作用〔5〕;傅文生等〔12〕研究发现,巴戟天结合振动干扰,对治疗Ⅱ型糖尿病大鼠具有积极作用。本研究结果提示,巴戟天含药血清能够促进血管内皮细胞增殖,抑制细胞凋亡,推测巴戟天可能对DM血管并发症患者的血管内皮细胞具有保护作用。
血管内皮细胞转移至其他部位是血管形成的关键,而促进血管内皮细胞的迁移侵袭功能有利于新血管形成〔13〕。Chen等〔14〕研究发现,高糖诱导后HUVEC的迁移能力明显降低;王宁〔15〕研究证实,巴戟天糖链能够提高缺氧/复氧诱导的HUVEC迁移能力;本研究结果提示,巴戟天含药血清能够促进高糖诱导下HUVEC的迁移能力,与上述研究结果一致。DM血管并发症与血管内皮细胞增殖、凋亡及迁移关系密切相关〔16〕,因此推测,巴戟天可能是缓解DM血管并发症潜在的有效中草药之一。
FOXP2能够促进肿瘤发生发展过程中的细胞迁移行为〔17,18〕。AGGF1是一种血管生成因子,正常状态下在血管内皮细胞中高表达〔19〕。Zhang等〔20〕研究证实,AGGF1对体内生理性血管生成至关重要,与内皮细胞的增殖和迁移有关。本研究结果提示,巴戟天含药血清促进HUVEC增殖及迁移,可能与激活FOXP2/AGGF1表达水平相关。Liu等〔21〕研究发现,激活FOXP2/AGGF1通路,对人微血管内皮细胞的增殖和迁移具有促进作用,与本研究结果一致,因此推测巴戟天可能通过激活FOXP2/AGGF1信号通路,促进高糖诱导下血管内皮细胞的增殖和迁移。
综上,巴戟天含药血清可促进HUVEC增殖、迁移、侵袭,并抑制细胞凋亡,可能与激活FOXP2/AGGF1信号通路相关,表明巴戟天在减缓DM血管并发症方向具有潜在治疗价值,可能为改善DM血管并发症的治疗效果提供了参考依据。但鉴于DM发病机制的复杂性及体外实验与临床疾病之间的巨大差异,本文将进一步联合DM血管并发症小鼠模型和临床试验,针对巴戟天调控机制及作用效果进行更深入的探索。

