通过CRISPR/Cas9敲除PD-1有效增强EGFR-CAR-T细胞对肺癌的抗肿瘤活性
姜伟华 高永山 刘娜 张媛 杨燕君 王贵刚 董跃华 张振明
(河北北方学院附属第一医院 1胸外科,河北 张家口 075000;2手术室)
肺癌是最致命的恶性肿瘤之一,全世界每年新增病例超过180万例〔1〕。肺癌存在许多病理类型,但约85%的肺癌患者被诊断为非小细胞肺癌,其5年生存率仅为10%〔2,3〕。尽管近年来在肺癌诊断和治疗方面取得了显著进展,但预后仍不乐观〔4,5〕。
嵌合抗原受体(CAR)T细胞在治疗多种B细胞白血病和淋巴瘤方面已经显示出良好的临床效果〔6,7〕,但在针对实体肿瘤方面仍然存在挑战〔8〕。基于规律间隔成簇短回文重复序列(CRISPR)/CRISPR关联蛋白质(Cas)9方法对原代T细胞进行编辑的策略增强了CAR-T细胞治疗实体瘤的前景〔9,10〕。
程序性死亡受体(PD)-1在T细胞激活后会短暂上调,是抑制T细胞发挥免疫功能的主要效应分子之一〔11〕。本研究中,选择肺癌中普遍高表达的表皮生长因子受体(EGFR)作为靶点,开发了一种基于CRISPR/Cas9破坏PD-1的CAR-T细胞,来探索这种利用基因编辑破坏PD-1的EGFR-CAR-T细胞是否可以有效地抑制肺癌的进展。
1 材料和方法
1.1血液、细胞系和主要试剂 健康人外周血由河北北方学院附属第一医院提供,所有流程经过河北北方学院附属第一医院伦理委员会批准,志愿者均知情同意。HCC827、NCI-H1650、NCI-H23及A549细胞系购自中科院上海细胞库,所有细胞使用DMEM培养基进行培养。
聚凝胺(Polyberene)、二氨基联苯胺(DAB)显色试剂、胶原酶Ⅰ及苏木素染液购自上海翌圣生物科技有限公司;聚蔗糖(Ficol)试剂购自北京索莱宝生物科技有限公司;CD3/CD28激活磁珠购自美国Gibco公司;T细胞培养基购自德国美天旎公司;乳酸脱氢酶(LDH)细胞毒性检测试剂盒购自上海碧云天生物科技有限公司;CD45-APC-Cy7、CD3-藻红蛋白(PE)、PD-1-APC及EGFR-PE抗体购自美国Biolegend公司;兔抗PD-1抗体购自美国CST公司;白细胞介素(IL)-2购自北京义翘神州生物科技有限公司;EGFR-CAR慢病毒购自上海吉凯生物科技有限公司;PD-1引导RNA(gRNA,GGCCAGGATGGTTCTTAGGT)由安徽通用生物有限公司合成;Cas9蛋白购自南京金斯瑞生物科技有限公司。
1.2外周血单核细胞(PBMC)的分离及CAR-T细胞的构建 按照Ficol试剂的说明书,采用密度梯度离心法获得PBMC,按照2×106/ml密度进行培养,6 h后小心吸取上清,离心重悬后获得PBMC。取6×106个PBMC,加入80 μl CD3/CD28激活磁珠,培养24 h,之后将细胞均分为3份,分别为未转导T细胞(UT)组、野生型EGFR-CAR-T细胞(CAR-T)组及PD-1敲除的EGFR-CAR-T细胞(PD-1-CAR-T)组。在CAR-T及PD-1-CAR-T组中加入8 μg/ml的Polyberene,在加入100 μl EGFR-CAR慢病毒,4 000 r/min离心60 min,放入37 ℃ CO2培养箱培养24 h。24 h后在PD-1-CAR-T组中加入3.6 μg的Cas9和3.6 μg的gRNA充分混合,置于调整密度为1×108/ml,并置于0.2 cm的电转杯中。电转结束后,将细胞重悬于T细胞培养基中,在37 ℃,5% CO2培养箱中培养。
1.3LDH释放实验检测CAR-T细胞对靶细胞的细胞毒性 取1×104个肿瘤细胞置于96孔板中,待细胞密度为80%时分别加入UT、CAR-T及PD-1-CAR-T,共孵育24 h。孵育结束后离心取上清,按照LDH细胞毒性检测试剂盒的说明检测对靶细胞的细胞毒性。细胞毒性按如下方法计算:细胞毒性(%)=(处理样品吸光度-样品对照孔吸光度)/(细胞最大酶活性的吸光度-样品对照孔吸光度)×100%。
1.4流式细胞术检测CAR-T细胞阳性率、EGFR、PD-1表达情况及肿瘤组织中T细胞比例 CAR-T细胞阳性率:分别取1×105个慢病毒感染5 d后的UT、CAR-T及PD-1-CAR-T,磷酸盐缓冲液(PBS)清洗3次后,使用100 μl PBS重悬细胞,使用流式细胞仪进行检测;EGFR表达:分别取1×106个HCC827、NCI-H1650、NCI-H23及A549细胞,PBS清洗3次后,将每种细胞均分为两份,使用100 μl PBS重悬细胞,在染色组的管子中加入5 μl EGFR-PE的抗体,冰箱中孵育30 min,PBS清洗3次后,使用300 μl PBS重悬细胞,使用流式细胞仪进行检测;PD-1表达检测:收集1.3中共孵育结束后的悬浮细胞,PBS清洗3次后,使用50 μl PBS重悬细胞,加入2 μl CD3-PE和PD-1-APC抗体,冰箱中孵育30 min,PBS清洗3次后,使用100 μl PBS重悬细胞,使用流式细胞仪进行检测;
肿瘤组织中T细胞检测:取新鲜分离的肿瘤组织10 mg,将其剪碎后加入1 ml含有1 mg/ml胶原酶Ⅰ的PBS,37 ℃孵育1 h,使用70 μm滤网过滤,收集的细胞用PBS清洗3次后,使用100 μl PBS重悬细胞,加入5 μl CD3-PE和CD45-APC-Cy7抗体,冰箱中孵育30 min,PBS清洗3次后,使用300 μl PBS重悬细胞,使用流式细胞仪进行检测。
1.5体内移植瘤模型检测CAR-T细胞的肿瘤抑制功能 15只M-NSG重度免疫缺陷小鼠购自江苏集萃药康生物科技有限公司,所有动物实验经过河北北方学院附属第一医院伦理委员会批准,动物饲养于河北北方学院附属第一医院SPF动物中心。本部分所用的表达红色荧光蛋白的NCI-H23细胞系(NCI-H23-RFP)由本实验前期构建保存。取1×107个NCI-H23-RFP细胞皮下注射到小鼠的背部皮下,第7天肿瘤长至100 mm3时分别通过尾静脉回输1×107个UT、CAR-T及PD-1-CAR-T,分别在接瘤后第7天和第21天进行活体成像检测。待小鼠死亡后取肿瘤组织进行瘤重检测。
1.6免疫组织化学法检测肿瘤组织中PD-1的表达 取20 mg分离的小鼠肿瘤组织,使用4%多聚甲醛(PFA)固定24 h,之后经过脱水包埋及切片后,制成组织切片。在组织切片上滴加50 μl 山羊血清室温封闭2 h,之后滴加50 μl抗PD-1抗体,在冰箱中孵育过夜,次日滴加50 μl山羊抗兔二抗,室温孵育1 h,之后通过DAB显色,苏木素染色后封片,在显微镜下观察并拍照。
1.7统计学分析 采用SPSS18.0软件进行t检验、方差分析。
2 结 果
2.1CAR-T及PD-1-CAR-T细胞的鉴定 EGFR-CAR的序列结构如图1A所示。对构建的T细胞进行流式检测,结果表明,未经基因编辑的CAR-T细胞的阳性率为41.3%,经过CRISPR/Cas9敲除PD-1的CAR-T细胞的阳性率为52.7%(图1B)。
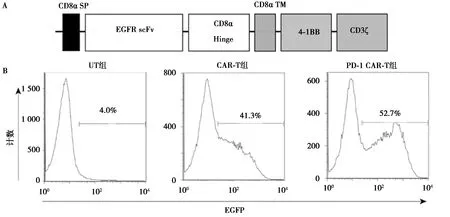
A.EGFR CAR结构;B.流式细胞术检测CAR表达图1 EGFR CAR-T细胞的性质
2.2肿瘤细胞表面EGFR的表达检测 HCC827细胞不表达EGFR,NCI-H1650低表达EGFR(16.3%),NCI-H23及A549细胞高表达EGFR,分别为97.6%、99.8%(图2)。
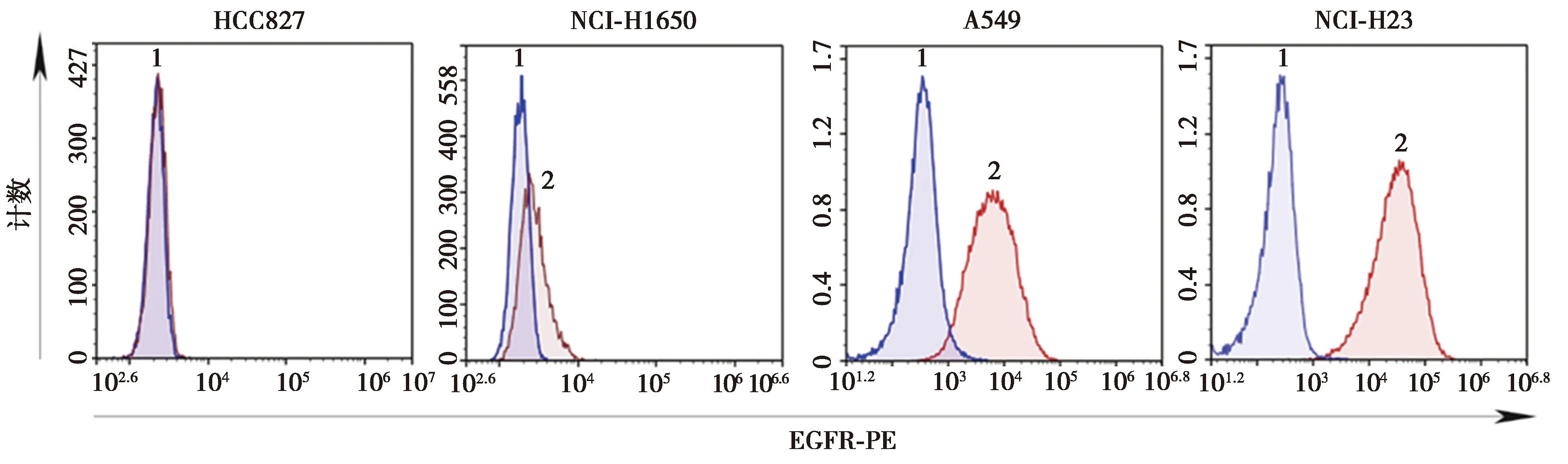
1:对照;2:抗体染色图2 肿瘤细胞中EGFR的表达
2.3CAR-T及PD-1-CAR-T细胞对肿瘤细胞的杀伤活性及PD-1表达检测 CAR-T及PD-1-CAR-T组对HCC827细胞的杀伤活性较UT组无差异,CAR-T及PD-1-CAR-T细胞对NCI-H1650、NCI-H23及A549细胞的杀伤活性显著高于UT组,而PD-1-CAR-T细胞对NCI-H23及A549细胞的杀伤活性较CAR-T组进一步提高,见表1。此外,对与NCI-H23细胞共孵育的效应细胞进行流式检测,结果表明CAR-T组PD-1细胞比例〔(25.600±2.600)%〕明显高于UT组〔(5.377±0.544)%,P<0.000 1〕,PD-1-CAR-T组PD-1细胞比例〔(11.630±1.365)%〕显著低于CAR-T组(P<0.001),见图3。
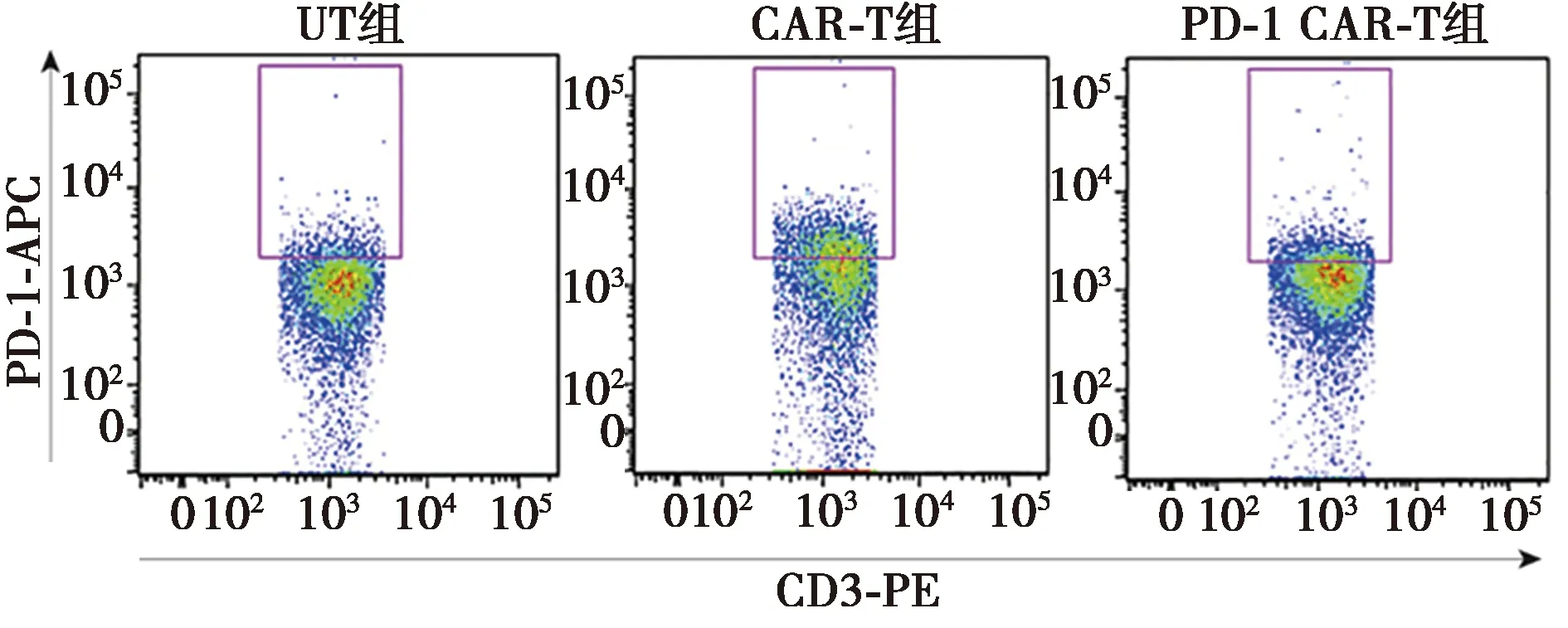
图3 T细胞中PD-1表达水平
2.4CAR-T及PD-1-CAR-T细胞的体内抗肿瘤活性 回输PD-1-CAR-T细胞的小鼠体内的肿瘤荧光强度低于回输CAR-T细胞组(图4A)。生存曲线显示,回输PD-1-CAR-T细胞较回输CAR-T细胞可以延长小鼠的生存期(图4B)。此外,CAR-T组肿瘤质量〔(353.300±48.440)mg〕明显低于UT组〔(831.300±37.580)mg,P<0.000 1〕;PD-1-CAR-T组肿瘤质量〔(152.700±59.000)mg〕也显著低于CAR-T组(P<0.01)。
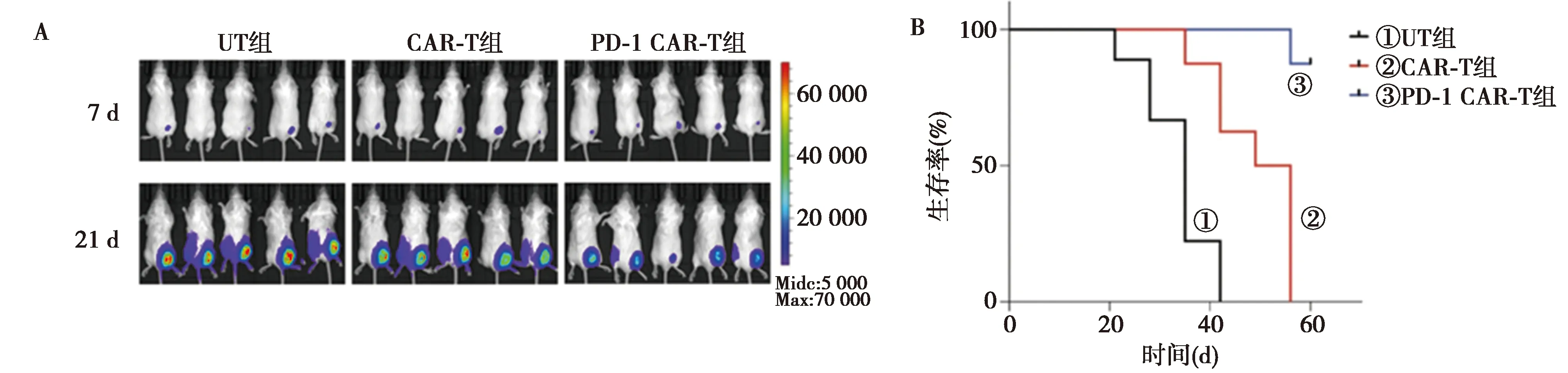
A.NCI-H23肿瘤细胞在7、21 d时的体内成像;B.治疗后的生存曲线图4 CAR-T细胞的体内抗肿瘤活性
2.5肿瘤浸润T细胞检测及肿瘤中PD-1的表达水平检测 CAR-T组肿瘤中T细胞比例〔(7.733±0.710)%〕明显高于UT组〔(0.103±0.046)%,P<0.000 1〕;PD-1-CAR-T组肿瘤中T细胞比例〔(12.330±0.603)%〕显著高于CAR-T组(P<0.001),见图5。免疫组化结果表明,CAR-T组肿瘤组织中PD-1细胞数〔(213.700±22.740)个〕明显高于UT组〔(53.330±15.500)个,P<0.000 1〕;PD-1-CAR-T组肿瘤组织中PD-1细胞数〔(92.000±11.530)个〕显著低于CAR-T组(P<0.001)。见图6。
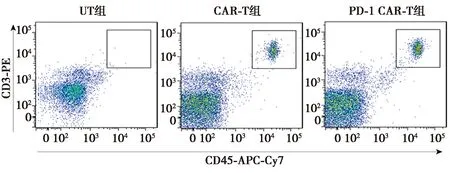
图5 肿瘤组织中T细胞浸润
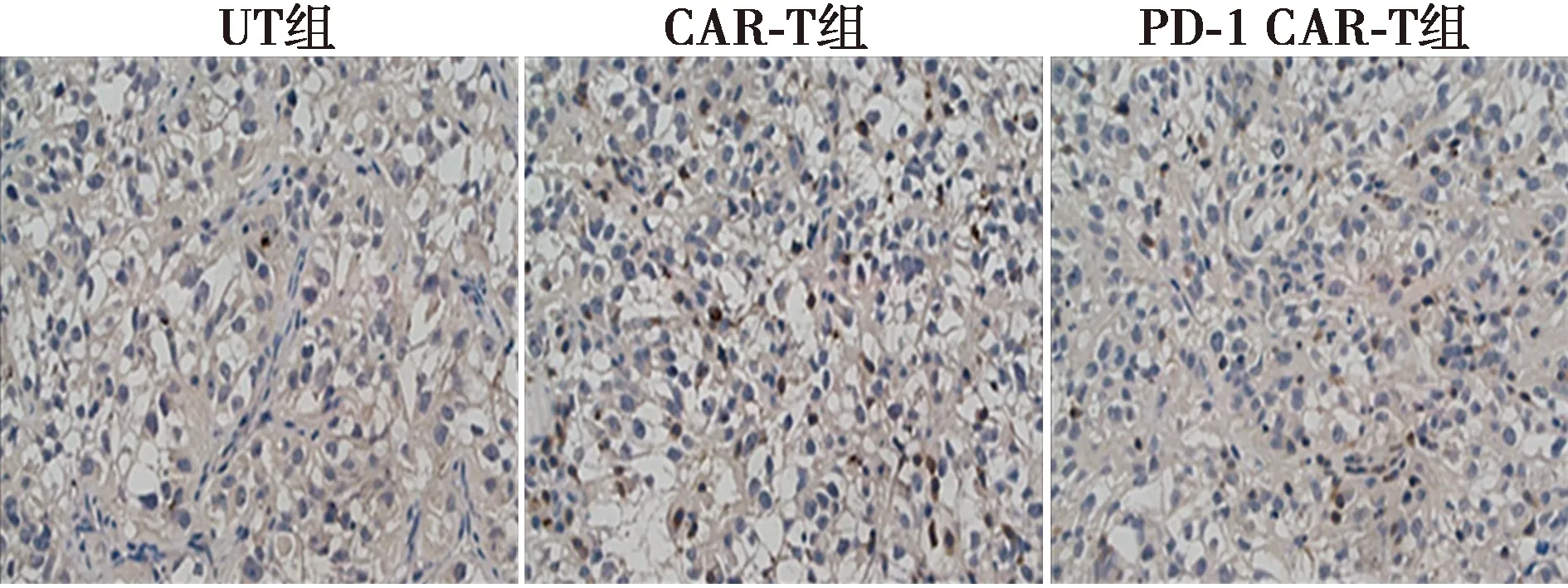
图6 各组肿瘤组织中PD-1表达(苏木素染色,×100)
3 讨 论
肺癌是一种免疫抑制型癌症,其肿瘤微环境限制抗肿瘤免疫,促进肿瘤进展,是肺癌治疗的重要障碍〔12〕。本研究结果表明,基于CRISPR/Cas9敲除PD-1可显著提高CAR-T细胞对实体瘤的疗效。
尽管CAR-T细胞和免疫检查点抑制剂这两种主要的癌症免疫治疗方法为癌症患者带来了更多的治疗希望,但控制一些癌症的进展,特别是实体肿瘤,仍然是一个巨大的挑战〔13,14〕。据报道,CAR-T细胞在肿瘤微环境中抗肿瘤功效大打折扣,很大一部分原因是其自身PD-1的表达抑制了抗肿瘤效应功能〔15〕。CAR-T细胞和PD-1受体抑制剂的联合使用可以改善肿瘤发展和患者的总生存期〔16〕。通过PD-1失活受体或PD-1信号转换受体实现的PD-1信号阻断同样可以提高CAR-T细胞的疗效〔17〕。PD-1阻断抗体的阻断作用是短暂的,需要反复给药〔18,19〕。近期有研究表明,CRISPR/Cas9介导的PD-1的敲除可以增强CD19-CAR-T细胞的功能〔20〕。本研究中构建的PD-1敲除的EGFR-CAR-T细胞不仅在体外增强了对肿瘤细胞的杀伤作用,在体内的肿瘤抑制功效同样卓越,抗肿瘤功能被显著增强。然而,在体外研究中,PD-1敲除的EGFR-CAR-T细胞较未敲除PD-1的EGFR-CAR-T细胞杀伤能力并无显著增加,这一现象可能与肿瘤细胞表面EGFR的低表达有关。
CAR-T细胞的扩增和持久性是体内抗肿瘤疗效的关键〔21〕。研究人员发现,转录激活因子样效应子核酸酶(TALEN)介导的肿瘤反应性淋巴细胞中的PD-1失活增强了T细胞的持久性,并改善了体内对黑色素瘤和纤维肉瘤的抗肿瘤疗效〔22〕。也有研究证明PD-1失活受体的共转导增加了28ζCAR-T细胞的增殖能力,并逆转了PD-1配体介导对CAR-T细胞抗肿瘤活性的抑制作用〔9〕。在本研究中,PD-1缺失的EGFR-CAR-T细胞较野生型EGFR-CAR-T细胞的体内持久性明显增强,这也可能与其卓越的肿瘤抑制功能有关。
高效和便捷的基因编辑手段为改进过继性免疫治疗的疗效开辟了多样化的途径。如PD-1编辑的CAR-T细胞的抗肿瘤功能增强,便可允许医生使用更少的细胞来达到同等的治疗效果〔23〕。然而对于这种编辑方案,一个潜在的风险是PD-1缺陷的CAR-T细胞仍然表达自身反应性TCR,可能导致类似于系统性PD-1抗体阻断的自身免疫疾病〔24〕。然而,其他研究小组报告了通过删除内源性TCR基因来产生“通用”型异体T细胞来预防移植物抗宿主病〔25〕。考虑到基于多重CRISPR/Cas9编辑的可操作性,添加靶向内源性TCR的gRNA和选择性去除TCR+细胞将产生高效的、肿瘤特异性的CAR-T细胞。
综上,CRISPR/Cas9介导的PD-1敲除可以在体外和体内改善CAR-T细胞的效应功能,增强其对肺癌的抑制活性。本研究有助于下一代CAR-T细胞的开发,为肺癌的治疗提供一种潜在的手段。

