羊传染性脓疱口炎病毒株的分离鉴定
李红 林鸷 何锡忠 ,林月霞 吕玉华 彭丽英

摘 要:利用牛肾(Madin-Darby bovine kidney,MDBK)细胞对上海市崇明区某羊场的痂皮病例进行病毒分离,获得一株羊口疮病毒(orf virus,ORFV),命名为ORFVSH-01。参考NCBI数据库中ORFV的保守基因B2L的序列,设计一对特异性引物,进行PCR扩增并测序。结果表明:接种病料悬液的MDBK细胞出现细胞病变,成功分离到毒株;经PCR扩增和测序,分离的毒株为ORFV,命名为ORFVSH-01。
关键词:羊口疮病毒;分离鉴定;PCR
中图分类号:S815 文献标志码:A 文章编号:1001-0769(2023)03-0066-04
羊传染性脓疱口炎,又称羊口疮,是由羊口疮病毒(orf virus,ORFV)引起山羊、綿羊以及中小反刍动物的一种接触性、嗜上皮性传染病,也是一种人畜共患病,可感染绵羊、山羊、大角羊、岩羚羊、骆驼、麝香牛、鹿和人,1~ 3月龄的羔羊更易感,以口唇、舌、鼻、乳房、蹄及外阴等部位形成丘疹、脓疱、水疱及结成疣状结痂为特征,严重影响病羊的采食和吸乳,会继发或混合感染其他的病原微生物,最终导致羔羊死亡[1-2]。该病发病率50%,死亡率较高,常呈群发性流行,严重影响养羊业发展。近年来,该病在世界各地呈不断上升趋势,感染的宿主范围在逐渐扩大[3],对人类健康也构成了威胁,引起了国内外相关研究人员的广泛关注[4]。
ORFV属于痘病毒科脊椎动物痘病毒亚科副痘病毒属成员,是一种具有囊膜的双链DNA病毒,全基因组长135.0~148.1 kb,可编码多种蛋白。其中B2L基因全长1 137 bp,是一个重要的保护性抗原基因,可以刺激机体产生良好免疫反应[5-6]。研究表明,不同国家或地区分离到的ORFV的基因差异较大,不同分离株基因组长度有10~25 kb的差异,致病性也存在较大差异,造成市场上现售的疫苗对一些感染变异株的羊群免疫保护效果不佳。
我国新疆、西藏、甘肃、内蒙、吉林、四川、云南、陕西等地对该病都有过报道。2019年11月,上海市某羊场的羊疑似发病,口唇和舌头处发生溃疡、生疮,有的已形成痂皮或疣状病变。该羊场曾免疫羊传染性脓疱口炎弱毒疫苗,因此该场羊群的发病率虽然较高,但死亡率较低。根据羊群的临床特征和分子生物学检测结果,诊断为羊口疮。本试验通过病料接种细胞获得致病毒株,并对羊传染性脓疱口炎病毒进行了鉴定。
1 材料
1.1 细胞与病料
牛肾(Madin-Darby bovine kidney,MDBK)细胞由本实验室保存。病料为上海市崇明区某羊场疑似患羊口疮山羊的唇部痂皮。
1.2 主要试剂
DMEM高糖培养基、小牛血清、胰酶为Gibco公司提供;Premix Taq?、DNA Marker DL2000购自TaKaRa公司;病毒DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒购自天根生物科技有限公司。
1.3 病毒
PCR阳性对照病毒购自山东泰丰生物制品有限公司的羊口疮病毒疫苗毒株。
1.4 主要仪器
主要仪器有Retiga 2000R高敏感度冷CDD荧光数码显微镜(日本OLYMPUS公司)、GeneAmp PCR System 9700扩增仪(美国Applied Biosytems公司)、紫外凝胶成像系统(法国 Vilber Lourmat公司)、DYY-6C型电泳仪(北京市六一仪器厂)。
2 试验方法
2.1 病料处理
取病羊唇部痂皮,用PBS缓冲液 (0.01 mol/L)反复冲洗几次,用无菌剪刀剪碎,加入少量PBS缓冲液进行研磨,加入青霉素和链霉素(终浓度1%),用PBS缓冲液将研磨液稀释为悬液,于-70 ℃反复冻融3次后,5 000 r/min 离心10 min,取上清液,用孔径0.22 μm的滤器过滤,获病料悬液置于-20 ℃保存备用。
2.2 病毒分离
MDBK细胞用含10%小牛血清的DMEM培养基传代培养至状态良好,待细胞铺满细胞瓶单层,接种2.1中处理好的病料悬液1 mL,置于37 ℃、5%CO2培养箱中吸附1 h,加入含2%小牛血清的DMEM维持液9 mL,置于37 ℃、5%CO2培养箱继续培养,每天观察细胞生长和细胞形态的变化,同时设未接毒细胞为阴性对照。当75%细胞圆缩时收毒,-20 ℃冻融3次,收集病毒液,于-70 ℃保存。若细胞在接种病料后5 d内未出现病变,则连续盲传3代,直到细胞出现明显细胞病变,收集病毒液置于-70 ℃保存,继续传代;若盲传3代后无细胞病变则弃之。
2.3 病毒纯化
将2×DMEM(含4%胎牛血清)放入37 ℃培养箱内预热;将3%琼脂在水浴锅中溶解后放入43 ℃烧杯水中预热。将病毒液做10倍稀释,即从10-1稀释至10-7,从10-3至10-7每个稀释度的稀释液中各取1 mL,依次加到6孔板中,每个稀释度一孔,设未接毒细胞为对照组;37 ℃培养1~2 h,弃病毒吸附液,用无血清的DMEM洗涤2次。取10 mL琼脂和10 mL DMEM等量混合,每孔加入2 mL琼脂与DMEM培养基混合液;37 ℃孵育,最低稀释度出现蚀斑时,收集蚀斑;用500 μL PBS溶解, -70 ℃冻融细胞3次,收集病毒液,提取病毒DNA,进行PCR鉴定。取阳性的蚀斑连续传6代,并将各代次病毒液分别冻存于-70 ℃。
2.4 引物设计与合成
参照文献[14]对羊口疮病毒的B2L基因设计1对特异性引物,由生工生物工程(上海)有限公司合成。上游引物:5'-ATGTGGCCGTTCTCCTC-3',下游引物:5'-TTAATTTATTGGTTTGCAGAACT-3'。
2.5 病毒PCR鉴定
按照病毒DNA提取试剂盒说明书,分别从疫苗毒株、病料悬液的上清液和第1~6代传代细胞病毒液中提取DNA。以提取的病毒基因组DNA为模板扩增目的片段,PCR反应体系为:2×Premix Taq? 25 μL、上下游引物各 2 μL、DNA模板6 μL、ddH2O 15 μL,反应条件为:94 ℃ 5 min;94 ℃ 30 s、53 ℃ 30 s、72 ℃ 90 s,30个循环;72 ℃ 10 min。取6 μL PCR产物在8 g/L琼脂糖凝胶上电泳,对扩增出目的条带的PCR产物进行测序。
3 结果
3.1 病毒分离
将病料悬液接种MDBK细胞后,第1代细胞未出现病变,72 h后收毒并盲传第2 代,从第2代开始出现细胞病变,病变出现时间在48 h左右,传到第6代时细胞病变时间变得有规律,细胞病变出现时间在40 h左右,表现为:胞核浓缩、变圆、团聚、拉网,最后脱落,未接毒的阴性对照细胞表现正常,详见图1。将该病毒分离株命名为ORFVSH-01。
3.2 病毒纯化
病毒液稀释至10-4时接种细胞,第一代细胞出现蚀斑,继续传代至第6代,随着传代次数的增加,蚀斑的出现更加有规律,病毒液稀释至10-6时接种细胞均出现蚀斑。
3.3 PCR检测及测序结果
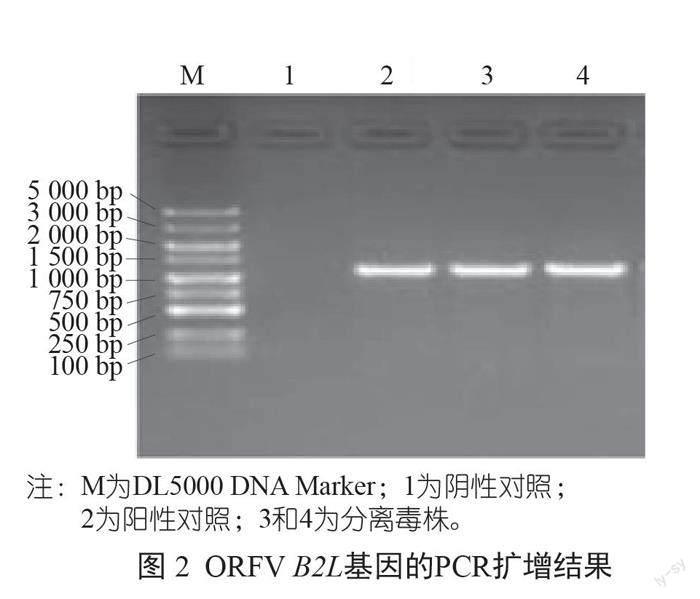
以阴性对照(未接毒正常细胞)、阳性对照(疫苗毒株)和分离毒株(第6代蚀斑)分别提取的病毒基因组DNA为模板进行PCR扩增,结果显示,扩增出1 137 bp左右的目的片段(图2)。测序序列经NCBI核酸序列比對后,显示与ORFA核酸序列同源性最高,说明分离的病毒为ORFV。
4 结论
ORFV可以用不同的原代细胞或传代细胞系进行培养。原代细胞以初生羔羊睾丸细胞和初生羔羊肾细胞为主,牛肾细胞系被认为是病毒分离和传代培养常用的细胞系[7]。ORFV的B2L基因序列高度保守,有文献报道,不同来源的羊口疮病毒B2L基因仅有个别碱基存在差别,因此,B2L基因常用于鉴定ORFV[5-6]。本试验采用MDBK细胞对羊唇部结痂进行病毒分离,经过6代纯化获得了纯化病毒,通过对ORFV的B2L基因的扩增、测序,证明从羊唇部结痂中分离到的毒株为ORFV,将其命名为ORFVSH-01。
疫苗免疫接种是预防羊传染性脓疱口炎的主要手段,常用的有弱毒疫苗和灭活疫苗。随着病毒毒力的返强、病毒变异株的出现,羊传染性脓疱口炎在各地羊群中呈暴发性流行,给养羊业造成了严重的经济损失。ORFVSH-01毒株的获得为今后羊口疮疫苗研制打下了良好的基础,为该病的防控提供了技术保障。
参考文献
[1] MAZUR C,FERREIRA I I,RANGEL FILHO F B,et al.Molecular characterization of Brazilian isolates of orf virus[J].Veterinary Microbiology,2000,73(4):253-259.
[2] MCELROY M C,BASSETT H F.The development of oral lesions in lambs naturally infected with orf virus[J].Veterinary Journal,2007,174(3):663-664.
[3] OEM J K,CHUNG J Y,KIM Y J,et al.Isolation and characterization of orf viruses from Korean black goats[J].Journal of Veterinary Science,2013,14(2):227-230.
[4] AL-SALAM S,NOWOTNY N,SOHAIL M R,et al.Ecthyma contagiosum (orf) - report of a human case from the United Arab Emirates and review of the literature[J].Journal of Cutaneous Pathology,2008,35(6):603-607.
[5] LI H,ZHU X,ZHENG Y,et al.Phylogenetic analysis of two Chinese orf virus isolates based on sequences of B2L and VIR genes[J].Archives of Virology,2013,158(7):1477-1485.
[6] 王廷璞,赵菲佚,安建平,等.羊传染性脓疱病毒42K囊膜蛋白基因克隆及表达[J].中国预防兽医学报,2006,28(1):29-32.
[7] GUO J,ZHANG Z,EDWARDS J F,et al.Characterization of a North American orf virus isolated from a goat with persistent, proliferative dermatitis[J].Virus Research,2003,93(2):169-179.

