加巴喷丁和普瑞巴林致药物超敏反应综合征1 例 *
郭敏慧 李俊宏 盘紧昇 何睿林
(广西医科大学第二附属医院疼痛科,南宁 530007)
药物超敏反应综合征 (drug-induced hypersensitivity syndrome, DIHS) 又称为伴嗜酸性粒细胞增多和系统症状的药疹(drug rash with eosinophilia and systemic symptoms, DRESS),是一种具有发热、皮疹及内脏损害三联征的急性严重性药物不良反应,相关的常见药物包括抗病毒药、抗惊厥药和抗结核药物[1,2]。DIHS 的临床表现主要为发热、皮疹和内脏损害,脏器受累多以肝脏为主、肾脏次之[3]。DIHS早期主要出现发热、皮疹、颜面部血管源性水肿和颈部淋巴结肿大伴压痛等症状[2,4]。对于DIHS 的临床诊断目前最常采用的诊断标准是由日本药物评估小组于2007 年制定的诊断标准[5]。加巴喷丁 (Gabapentin) 是美国Warner-Lanbert 公司开发的抗惊厥药物,1993 年首次在英国上市[6],它是一种人工合成的神经递质γ-氨基丁酸 (γ-aminobutyric acid, GABA)类似物,目前被用于糖尿病性神经痛、三叉神经痛、带状疱疹后神经痛[7]等神经病理性疼痛的治疗。普瑞巴林和加巴喷丁同为GABA 类似物,具有抗惊厥、镇痛和抗焦虑作用。目前加巴喷丁和普瑞巴林均为治疗带状疱疹后神经痛的指南推荐一线用药,在临床上被广泛使用。
查阅相关文献,加巴喷丁或普瑞巴林引起的药物过敏反应从1993 年加巴喷丁上市至今只有国外数例报道,国内尚未见相关报道。最早是在1999年由Detoledo 等[8]报道了1 例26 岁女性在使用加巴喷丁治疗后的第8 天出现大腿近端的瘙痒、红斑样皮疹,在停用加巴喷丁和局部使用糖皮质激素处理后痊愈,该病人既往在服用苯妥英钠和卡马西平时也出现了典型的多形性红斑的水疱性皮疹。Ragucci、Fletcher 和Goldman 等 分 别 在2001 年、2007 年和2008 年报道了1 例由服用加巴喷丁引起的超敏反应综合征。第1 例是1 名72 岁的男性,在使用加巴喷丁治疗幻肢痛12 天后出现发热、瘙痒性斑丘疹[9]。第2 例是1 名35 岁的女性,在服用加巴喷丁后出现高热、双侧颈部淋巴结肿[10]。第3 例是1 名有青霉素过敏史的55 岁女性,在使用加巴喷丁治疗癫痫24 天后出现了躯干部斑丘疹、发热、面部水肿[11]。这3 例病人均在停用加巴喷丁后病情缓解。2013 年Bamanikar 等[12]报道了1 例40岁男性在使用普瑞巴林治疗带状疱疹后神经痛2 周后出现了低热、瘙痒皮疹、嘴唇和面部肿胀,病人经过每日外用倍他米松乳膏40 mg 和口服泼尼松龙40 mg,疗程1 个半月的治疗后完全康复。2013 年Błaszczyk 等[13]发表了一项长达20 年的单中心研究,研究发现DIHS 可能与年龄、性别和联合用药相关。2018 年Rojas-Pérez-Ezquerra 等[14]报道了1 例72 岁的男性在服用加巴喷丁后并发了Sweet 综合征,在停用加巴喷丁和全身糖皮质激素治疗后症状开始好转,病人痊愈后行斑贴试验(加巴喷丁溶于二甲基亚砜,浓度为20%)为阳性,对照试验的5 例健康人均为阴性。
由于加巴喷丁和普瑞巴林引起的DIHS 较罕见,临床工作中难以快速诊断,但其临床表现较严重,尤其是进展至多器官功能衰竭时期,会对病人造成难以逆转的伤害。因此,对DIHS 的早期诊断和干预尤为重要,以免造成病人不良预后。然而,现阶段对于加巴喷丁和普瑞巴林引起的超敏反应临床上没有公认的确诊方法以及治疗方案。本研究通过我科发现的1 例由加巴喷丁和普瑞巴林导致的DIHS病例探究类似病例的诊断和治疗方法,对后续的临床工作作出警示和指导作用,现病例报告如下。
1.一般资料
病例:女性,73 岁,因“右侧胸背部带状疱疹并疼痛2 个月,全身皮疹20 天”于2022-08-01 入院。病人自诉2 个月前出现右胸背部带状疱疹感染发作,并在相应皮损区域内出现烧灼样疼痛、针刺样疼痛,不伴头晕头痛、胸闷心悸、呼吸困难、寒战发热、四肢乏力等。不放射至皮损区域外的其他部位。疼痛呈持续发作,无明显昼夜规律,夜间疼痛发作影响睡眠。曾在外院住院诊治,诊断为“带状疱疹神经痛”,经抗病毒(具体药物不祥)、甲钴胺营养神经、加巴喷丁缓解神经病理性疼痛等药物治疗后病情好转出院,20 天前出现全身皮疹,伴散在水疱及皮肤剥脱,不伴瘙痒,外院就诊,予用药治疗后稍好转。现为进一步入院诊治,门诊拟“带状疱疹后神经痛”收住入院。病人否认过敏史,既往无高血压、糖尿病、冠心病和肝肾疾病病史。
入院时主诉为右侧胸背部持续性烧灼样疼痛、针刺样疼痛。入院查体:体温:39.0℃,脉搏:112次/分,呼吸:21 次/分,血压:137/70 mmHg。神志清楚,头颈躯干四肢可见多发鲜红色皮疹,两侧腋窝、颈部淋巴结扪及肿大。
入院后第1 天予以普瑞巴林胶囊 (75 mg) 每日2 次口服,酮咯酸氨丁三醇注射液 (1 ml, 15 mg)30 mg 每日1 次静脉滴注,缓解神经病理性疼痛,盐酸阿米替林 (25 mg) 每日2 次,抗抑郁改善睡眠,吲哚美辛栓(0.1 g) 0.5 枚1 次直肠给药解热镇痛等对症治疗。入院后第2 天,病人检查结果示:超敏C 反应蛋白(全程):CRP: 34.50 mg/L (H);十二项细胞因子分析:IL-6: 33.81 pg/ml (H),IL-10:49.97 pg/ml (H),IL-5: 10.39 pg/ml (H);肾功能六项:CysC: 1.77 mg/L (H);肝功能十六项:ALT:163 U/L (H);电解质五项:K: 3.01 mmol/L (L),Ca:1.90 mmol/L (L);血常规:WBC: 12.61×109/L (H),EO%: 0.218 (H)。胸部CT 示:①两肺炎症;两侧胸膜腔积液;②纵隔及两侧腋窝多发淋巴结;③心影增大;心包积液。结合病人检验结果和既往病史,考虑全身皮疹为过敏性药疹,立即请皮肤科会诊协助诊疗。入院后第3 天皮肤科会诊意见诊断:药物超敏反应综合征可能性大。结合病人病史、近期用药情况和检验结果,考虑病人为抗病毒药物引起的药物超敏反应。遵皮肤科会诊意见予克林霉素磷酸酯注射液 (600 mg, 4 ml) 每日2 次静脉滴注,枸地氯雷他定片 (0.8 mg) 每日1 次口服,维生素C注射液 (2 ml, 0.25 g) 每日1 次静脉滴注,环磷腺苷(2 ml, 20 mg) 40 mg 每日1 次静脉滴注。葡萄糖酸钙注射液纠正电解质紊乱,同时使用经皮电刺激和偏振光照射治疗,减少药物使用。病人住院期间反复发热,予以冰袋物理降温、吲哚美辛栓 (0.1 g) 0.5枚直肠给药、布洛芬片 (0.1 g) 2 片口服。入院后第8 天,病人经抗过敏治疗后症状缓解不明显,仍伴有发热,此时考虑病人可能为抗惊厥药物引起的超敏反应,遂停用普瑞巴林。入院后第9 天,病人全身头面躯干四肢皮疹颜色由鲜红色转为褐色。入院后第11 天,病人躯干四肢面部皮疹脱屑结痂,面颈部水肿消退。遵皮肤科会诊意见予以病人肤宝乳膏 (40 g) 外用每日2 次,地奈德乳膏 (0.05%, 20 g) 外用每日2 次。入院后第12 天,病人再次出现全身躯干部四肢面部多发散在红色皮疹伴脱屑、头颈部水肿,给予注射用重组人II 型肿瘤坏死因子受体-抗体融合蛋白 (25 mg) 50 mg 皮下注射。病人注射TNF-α 拮抗剂后6 小时皮疹情况见图1。

图1 注射TNF-α 拮抗剂6 小时后皮疹情况
入院第13 天17:00 病人出现胸闷胸痛。查体:心率:113 次/分,呼吸:28 次/分,血压:184/110 mmHg,PO2:100%,神志烦躁,听诊两肺可闻及湿啰音。立即检查血气分析,结果示:K: 4.600 mmol/L (H),结合余验血结果:脑利钠肽前体:pro-BNP: 2427.00 pg/ml (H);肝功能十六项:AST: 49 U/L (H),ALT: 98 U/L (H);肾功能六项:CREA: 254 μmol/L (H),超敏C 反应蛋白(全程):CRP: 135.00 mg/L (H),考虑急性肾损伤、急性左心衰、肝功能损害、肺部感染。给予去乙酰毛花苷注射液 (2 ml, 0.4 mg) 0.2 mg once 静脉推注,硝酸甘油注射液(1 ml, 5 mg) 15 mg once 静脉泵入,同时监测生命体征,吸氧,经以上处理,于19:34 病人神志清楚,胸闷症状较前稍有缓解,继续吸氧对症处理,转入ICU 进行下一步治疗。
病人注射TNF-α 拮抗剂后12 小时皮疹情况见图2。
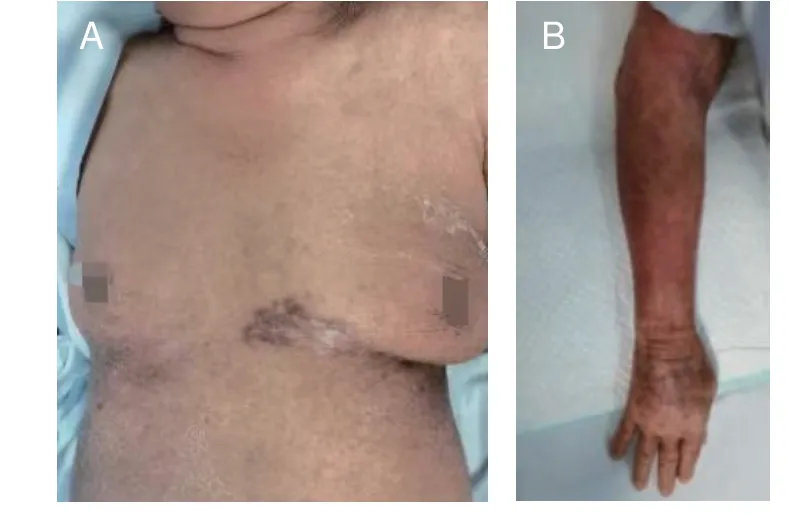
图2 注射TNF-α 拮抗剂12 小时后皮疹情况
入院后14 天到ICU 随访,病人神志清楚,全身头颈部躯干部下肢红色皮疹消退,可见褐色皮疹后疤痕伴脱屑,双上肢可见部分红色斑片样皮疹,较前明显好转。
病人注射TNF-α 拮抗剂后24 小时皮疹情况见图3。

图3 注射TNF-α 拮抗剂24 小时后皮疹情况
入院后第15 天至ICU 随访,病人回当地治疗。出院诊断为:①脓毒性休克;②全身多器官衰竭;③带状疱疹神经痛;④肺炎伴重症感染。
2.讨论
回顾本病例的诊疗过程,病人入院时体温39.0℃,全身面部躯干部四肢多发散在鲜红色皮疹,伴头颈部水肿、颈部腋窝淋巴结肿大,入院时考虑为药物引起的单纯药疹。经皮肤科会诊,病人符合日本药物评估小组诊断DIHS 诊断标准:①用药3周后出现斑丘疹;②停用致病药物后症状迁延2 周以上;③体温≥38℃;④肝功能异常[谷丙氨酸转氨酶 (ALT)≥100 U/L]或其他器官受累;⑤白细胞增多;⑥出现异型淋巴细胞;⑦嗜酸粒细胞增多;⑧淋巴结增大;⑨HHV-6 再激活,9 项标准中至少满足7 项或满足前5 项[5]。回顾病史,病人入院前20 天有口服抗病毒药物、甲钴胺、加巴喷丁、曲马多、萘普生等用药史。通过查阅文献,常见的引起DIHS 的药物为抗病毒药、抗结核药物和抗惊厥药,因抗病毒药物引起的药物超敏反应更常见,抗惊厥药物中以卡马西平和苯巴比妥引起的超敏反应较常见,结合病人用药史我们首先考虑其可能是由抗病毒药物引起的DIHS。病人入院后依然使用普瑞巴林治疗,在进行抗过敏、激素冲击治疗后病人临床症状缓解不明显,肾功能进一步恶化,直到停用普瑞巴林后,病人全身皮疹明显缓解。此时考虑为病人入院前的药物超敏反应是服用加巴喷丁引起,入院后病人依然服用普瑞巴林,经查阅资料普瑞巴林和加巴喷丁同为GABA 类似物,推测病人可能对普瑞巴林也表现出交叉过敏反应。使用诺氏 (Naranjo's)药物不良反应评估量表进行评估(见表1),得分为9 分[15],依据量表标准不良反应相关性为肯定有关。

表1 诺氏 (Naranjo's) 药物不良反应评估量表
超敏反应是由淋巴细胞介导的机体异常的免疫应答,主要分为4 型,药物导致的超敏反应属于特异性免疫范畴。目前研究结果认为DIHS 可能的发病机理主要有以下3 种:①具有特定遗传背景的HLA 个体在接触特定药物时发生DIHS;②药物毒性或免疫原性触发机体的免疫系统导致了DIHS 的发生;③疱疹病毒(HHV-6、CMV、EBV 与HHV-7)的重新激活[16,17]。DIHS 的触发因素可能是药物刺激T 细胞导致潜伏在T 细胞的疱疹病毒基因组由静止状态再活化为异源性病毒[16],病毒刺激T 细胞可和药物交叉反应,随后导致特异性T 细胞扩充,产生异常免疫应答。有研究发现抗惊厥药物(如苯妥英钠、卡马西平等)在人体中会经细胞色素450系统代谢产生有毒的芳香族环氧化物,再由环氧化物羟化酶分解为无细胞毒性的代谢物,而未经分解的芳香族环氧化物可能会启动特异性免疫反应导致DIHS,所以环氧化物羟化酶的缺乏也是发生DIHS的一项高危因素[18]。
目前临床上对于DIHS 的治疗方法主要为使用糖皮质激素、静脉注射丙种球蛋白以及对症处理。有研究表明早期、大量使用糖皮质激素可以有效地控制病情,同时联合大剂量丙种球蛋白可以减少糖皮质激素的用量和减轻使用激素带来的不良反应[19]。在DIHS 急性期应避免使用抗生素或非甾体抗炎药,药物间交叉反应可能加重临床症状或使其复杂化。
加巴喷丁与普瑞巴林引起DIHS 较罕见,本例病人入院时否认过敏史,加上对于DIHS 的认识不足导致病人预后较差。针对本病例做出以下经验总结:对于有过抗病毒、抗惊厥药物用药史的病人,如用药后出现发热、皮疹、器官功能障碍等DIHS相关表现,应及时停药,鉴别诊断。对于明确引起病人超敏反应的药物,若考虑为加巴喷丁引发的超敏反应,普瑞巴林和加巴喷丁同为GABA 类似物,也应警惕普瑞巴林可能存在潜在交叉过敏反应,一旦应用可能加重病人病情。病人入院时症状和实验室检查结果已明确提示药物超敏反应,但前期治疗还停留在对症支持治疗,没有进行相应的护肝、护肾、预防心衰等综合治疗。后期应用地塞米松和TNF-α 拮抗剂(重组人II 型肿瘤坏死因子受体抗体融合蛋白)后皮疹有所改善,但对于器官衰竭情况无明显改善。因此,对于DIHS 病人,一定应尽早开始激素冲击治疗并联合大剂量丙种球蛋白静滴,联合重要器官保护的综合治疗,否则后期多器官衰竭难以逆转。病人后期出现严重的肺部感染并发了脓毒性休克,带状疱疹的病人免疫力较低,治疗过程中应注意行免疫增强治疗,并及时纠正感染以改善预后。有研究表明HLA-B×1502 基因型检测可以有效预测抗惊厥药物引起的DIHS,尤其在预测卡马西平引起的DIHS 中相关性明显,在因抗惊厥药物引起超敏反应的病人可以考虑进行HLAB×1502 基因型检测尽早诊断或预测[20]。有研究报道采用斑贴试验成功检测病人对加巴喷丁出现皮疹即过敏反应,也可以考虑采用斑贴试验辅助诊断[14]。加巴喷丁和普瑞巴林致DIHS 发生率低,但全身反应重、易反复、致死率高。因此,非必要时,不建议两药联合使用以减少DIHS 风险,当病人在使用加巴喷丁或普瑞巴林期间出现高热、皮疹、脏器功能损伤时,应高度警惕DIHS 并立即停药,尽早进行大剂量激素冲击治疗并联合大剂量丙种球蛋白处理,TNF-α 拮抗剂(重组人II 型肿瘤坏死因子受体抗体融合蛋白)治疗也有明显疗效。
利益冲突声明:作者声明本文无利益冲突。

