长链非编码RNA lncMD通过转录miR-1促进牛肌细胞的分化研究
孙晓梅,王奕猛,徐 杰,毛秋彤,李明勋,蓝贤勇
(1. 扬州大学 动物科学与技术学院,江苏 扬州 225009;2. 西北农林科技大学动物科技学院,陕西 杨凌 712100)
牛骨骼肌的生长发育及其遗传特性直接决定了产肉率、肉品质和肉牛产业的经济效益。成肌细胞增殖分化是肌肉发育的关键环节[1],研究牛成肌细胞分化的调控机制对理解肌肉生长发育的生理基础、肉牛的遗传改良及进行精准的分子设计育种等具有重要的理论和实际意义。
肌细胞分化是由一系列转录因子参与的复杂而精细的程序化调控过程,受到众多编码基因、非编码基因及其互作的调控[2-4]。研究显示,长链非编码RNA(long noncoding RNA,lncRNA)可在转录、翻译和染色体水平等多层面调控基因表达[5-8],在骨骼肌发育过程中发挥着重要功能[9-13]。lncRNA可以通过顺式作用或反式作用等方式作为支架分子、诱饵分子或指导分子靶向调控下游基因的表达[14-15]。前期研究鉴定到一个新的长链非编码RNA lncMD,过表达和干扰试验表明lncMD能够显著促进肌细胞分化[16]。利用UCSC基因组浏览器比对发现,lncMD是miR-1的宿主基因,miR-1位于lncMD的第三外显子区域,是一种在进化中高度保守的miRNA,在肌肉中特异性表达。据报道,配对盒基因7(paired box 7,Pax7)是miR-1的一个重要靶基因,miR-1可通过抑制Pax7的表达来调节肌卫星细胞的生成[17]。miR-1还可以通过靶向调节细胞周期蛋白D1(CyclinD1),进而调控肌生成[18]。
lncMD与miR-1在基因组上的位置重叠会产生什么样的调控关系以及lncMD-miR-1下游的靶基因是什么等问题还有待深入研究。因此,本研究利用过表达、RNAi、双荧光素酶报告系统和实时荧光定量PCR(Quantitative real-time PCR,qRT-PCR)等方法解析lncMD和miR-1的调控关系,确定牛肌细胞分化过程中miR-1的下游靶基因,解析lncMD对肌生成的调控作用,以期在牛肌肉发育的分子调控理论及应用方面取得重要进展,为肉牛的快速生长和优质高效生产奠定基础。
1 材料与方法
1.1 细胞培养与诱导分化
采用胶原酶消化法培养牛原代肌细胞,具体步骤如下:无菌状态下采集胎牛的背最长肌组织,将其置于含1%双抗的无菌PBS中迅速带回实验室;用无菌剪刀剪成1 mm3小块,放入50 mL离心管中;加入胶原酶Ⅰ消化,37 ℃水浴1.5 h,过滤并收集滤液; 1000 r/min离心5 min后去除上清液,收集沉淀;在DMEM完全培养基中重悬细胞,将细胞悬液接种到6 cm培养皿中;在CO2培养箱中培养2 h,收集上层培养液于新的培养皿中继续培养;鉴定后冻存备用或进行细胞传代。
诱导分化步骤:当细胞融合度达到约80%时,将生长培养基(DMEM高糖培养基、10% FBS)换为分化培养基(DMEM高糖培养基、2%马血清),每天换一次细胞培养液。
1.2 双荧光素酶活性检测

1.3 载体构建
以骨骼肌的cDNA为模板,在lncMD序列的两端分别引入Hind III和EcoR I酶切位点,扩增lncMD的全长,连接至pcDNA3.1+载体(Invitrogen, 上海),构建过表达载体pcDNA-lncMD。miR-1 mimics、miR-1 inhibitor、lncMD siRNA购自吉玛生物(Genepharma,苏州)。
1.4 RNA提取、cDNA合成及实时荧光定量PCR
根据操作说明,利用RNAiso Plus(TaKaRa,大连)提取细胞总RNA,NanoDrop 1000分光光度计检测RNA质量。利用PrimeScriptTM RT reagent Kit with gDNA Eraser (TaKaRa,大连)进行RNA反转录。在Bio-Rad CFX96实时荧光定量PCR仪上进行qRT-PCR反应。反应体系25 μL,包括12.5 μL SYBR Premix Ex Taq II,10 μM正向和反向引物,10 ng cDNA。反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s 40个循环。以GAPDH为内参,采用2-ΔΔCT方法计算基因表达水平[19]。利用Beacon Designer 8.12设计定量引物,引物序列见表1。
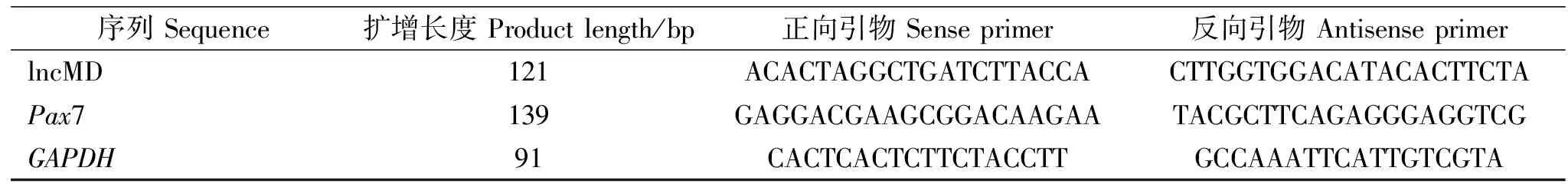
表1 实时荧光定量PCR引物Table 1 Primers used for qRT-PCR
1.5 统计分析
利用GraphPad Prism 6进行数据处理及Student's t检验,数据表示方式为平均数 ± 标准误,P<0.05表示差异显著。
2 结果与分析
2.1 长链非编码RNA lncMD促进miR-1的表达
序列分析显示lncMD第三外显子与miR-1在基因组上位置重叠(图1A)。采集牛肾脏、小肠、肺、肝脏、脾脏、骨骼肌、脂肪和心脏等组织进行定量分析,结果发现miR-1与lncMD的组织表达谱相似,都仅在牛肌肉组织中表达,且均是骨骼肌中高表达,心肌中少量表达(图1B)。
在牛原代肌细胞中分别过表达和干扰lncMD,收集细胞,qRT-PCR检测miR-1的表达量,结果如图1C、1D所示。过表达lncMD极显著增加lncMD的表达量,而干扰载体可以极显著降低lncMD的表达量,说明lncMD的过表达和干扰成功,可用于后续研究。由图1C可知,过表达lncMD后,miR-1的表达量极显著上升(P<0.001);而干扰lncMD导致miR-1表达显著下调(P<0.05,图1D),提示lncMD可以促进miR-1的表达。
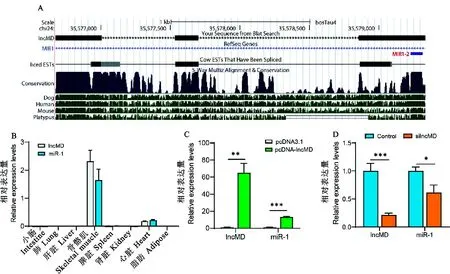
图1 lncMD调控miR-1的表达A.生物信息学分析lncMD和miR-1的基因组位置特征;B. lncMD和miR-1的组织表达谱;C. 过表达lncMD检测对miR-1表达量的影响;D. 干扰lncMD的表达检测对miR-1的影响。 *表示P<0.05,**表示P<0.01,***表示P<0.001。下同。Fig.1 lncMD regulates the expression of miR-1A. Bioinformatics analysis of the genomic location of lncMD and miR-1; B. The tissue expression profiles of lncMD and miR-1;C. The effect of overexpression of lncMD on the expression levels of miR-1;D. The effect of interference with lncMD expression on miR-1 expression. *means P<0.05, ** means P<0.01, *** means P<0.001. The same below.
2.2 牛miR-1和Pax7基因的靶向关系验证
利用TargetScan在线预测miRNA靶基因,结果如图2A所示,牛Pax7基因3'UTR区共存在4个miR-1的结合位点。利用双荧光素酶报告系统和定点突变技术,验证牛miR-1与Pax7的靶向关系。由图2B-E可知,和对照组相比,试验组荧光素酶活性显著下降,说明miR-1结合到Pax7上,导致萤火虫荧光素酶基因表达受阻,萤火虫荧光素酶与海参荧光素酶活性比值下调;分别突变Pax7基因3'UTR区4个miR-1结合位点(M1-M4),转染突变型Pax7-MT双荧光素载体后,荧光素酶活性与对照组无显著区别。这是由于突变miR-1结合位点,解除了miR-1对靶基因Pax7的抑制,进一步证明Pax7 3'UTR区存在4个miR-1的结合位点,其是miR-1的靶基因。
2.3 lncMD可通过miR-1-Pax7途径促进肌分化
为进一步验证miR-1和Pax7的靶向关系,在牛骨骼肌细胞中分别转染miR-1 mimics、miR-1 inhibitor,检测Pax7基因的表达量。结果发现,miR-1表达量增加可以降低Pax7的表达量,而miR-1表达量降低能够提高Pax7表达量,说明miR-1可以负调控Pax7表达(图3)。综合双荧光素酶试验结果,表明lncMD可以通过自身编码miR-1,抑制靶基因Pax7的表达,进而促进成肌细胞分化(图4)。
3 讨 论
牛肉的产量和质量与肌纤维的数量和体积紧密相关,肌纤维数量和体积的变化即肌细胞的增殖分化过程。细胞的增殖分化能力直接决定了组织器官的形成及动物个体的生长发育状况。长链非编码RNA在细胞分化、个体发育、干细胞维持、能量代谢等生命活动中发挥关键的调控功能[20-21],它能在转录、转录后等水平调控基因表达,参与染色质重塑、X染色体失活、基因组印记、核内运输、细胞周期调控、选择性剪接调控和mRNA稳定性调控等多种重要的生命过程[5-6,22-23]。当前,已明确鉴定的lncRNA数目还在继续增长,但大多数lncRNA的功能和作用机制尚未阐明。
成肌细胞分化的相关信号转导途径及分子调控机制是畜牧学领域的热点问题之一,lncRNA对成肌细胞的增殖至关重要[24]。牛基因组结构被逐步解析,一些与肌肉发育调控相关的重要非编码RNA相继被发现。虽然牛上关于lncRNA已有很多研究,然而功能清晰的lncRNA数量还有限[25-27]。前期研究报道lncMD在牛的肌肉组织中特异性表达,并且在肌细胞分化过程表达量逐步升高,能够显著促进牛成肌细胞的分化[16]。本研究通过组织表达谱分析发现,miR-1与lncMD都仅在牛的骨骼肌和心肌中表达,这和已有报道miR-1仅在牛肌肉组织中表达相一致[28]。
lncRNA与基因组位置邻近的miRNA可能具有两种作用机制,lncRNA可以通过调控邻近miRNA发挥功能,如miR-15a/16-1簇的表达受宿主基因lncRNA DLEU2启动子的调控[29];在人和小鼠的成肌细胞中,沉默lncRNA H19导致其自身编码的miR-675-3p和miR-675-5p表达量相应降低,H19通过miR-675-3p和miR-675-5p促进骨骼肌的分化和再生[30]。该作用机制与本研究中lncMD与miR-1的作用机制一致。lncRNA还可能与miRNA独立转录,分别行使功能:如lncRNA MIR100HG是miR-100的宿主基因,在人的U2OS细胞系中,敲除MIR100HG导致细胞周期异常,但却不改变miR-100表达[31];lncRNA lnc-31的第三外显子与miR-31在基因组上位置重叠,lnc-31调控肌细胞增殖并不依赖于miR-31[32],两者并无调控关系。本文进一步结合过表达、干扰试验发现,lncMD可以通过自身编码miR-1促进牛成肌细胞分化。
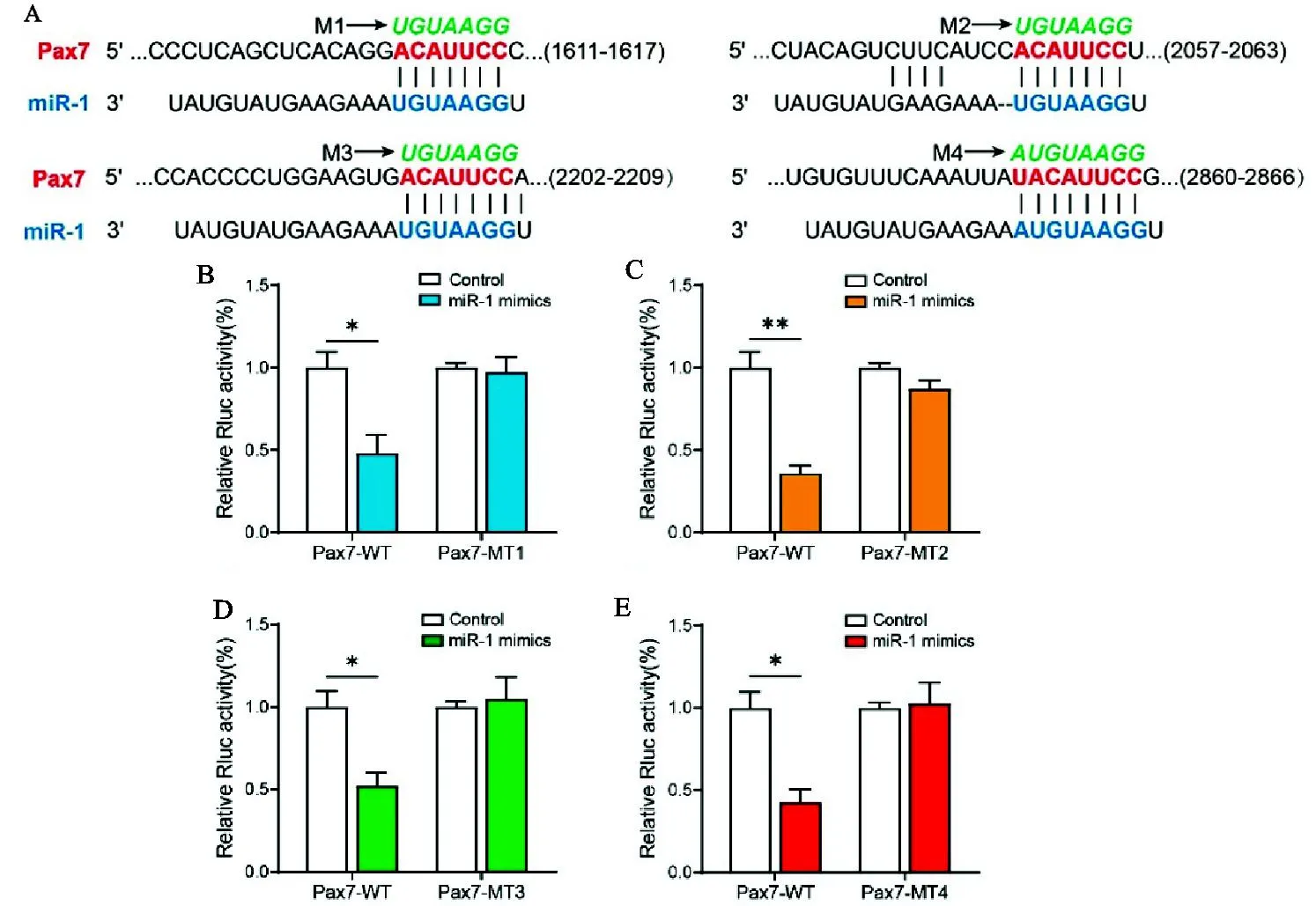
图2 双荧光报告载体验证miR-1和Pax7的靶向关系A. 在线预测miR-1和Pax7的结合位点。M1-M4分别代表Pax7基因的3' UTR区4个的miR-1结合位点的突变序列;B-E. HEK293T细胞中转染miR-1 mimics和双荧光素报告载体,48 h后检测荧光活性Fig.2 The relationship between miR-1 and Pax7 verified by dual fluorescent reporter systemA. Online prediction of the binding sites of miR-1 and Pax7. M1-M4 respectively represent the mutated sequences of four miR-1 binding sites in the 3' UTR region of the Pax7 gene; B-E. HEK293T cells were transfected with miR-1 mimics and dual fluorescein reporter vectors, and after 48 hours, the fluorescence activity was detected
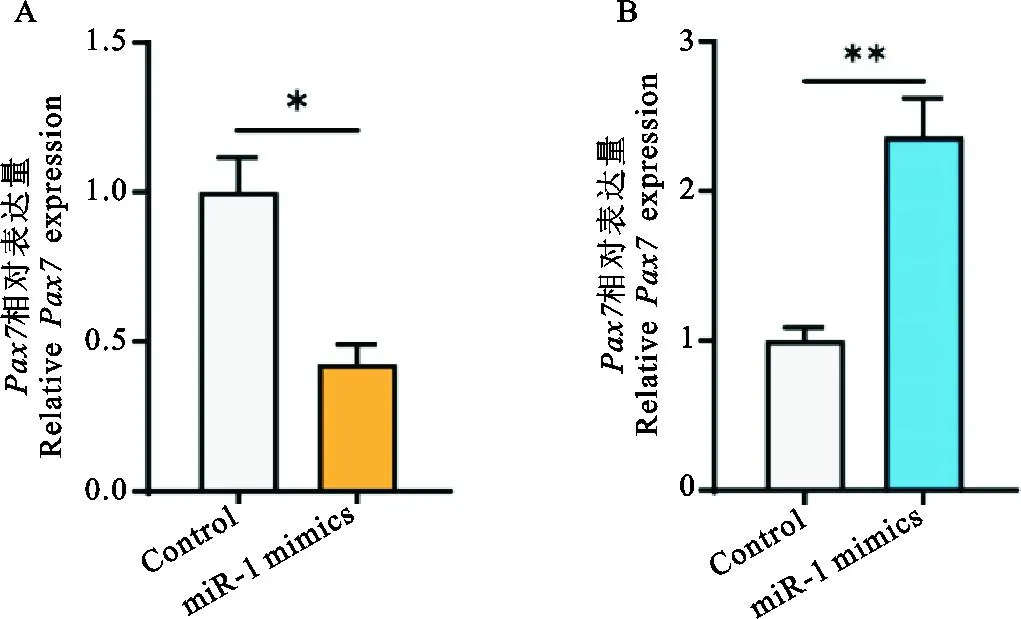
图3 牛miR-1显著抑制靶基因Pax7的表达 牛骨骼肌细胞中转染miR-1 mimics(A)、miR-1 inhibitor(B) 后检测靶基因Pax7表达量Fig.3 Bovine miR-1 significantly inhibits the expression of its target gene Pax7 After transfection of miR-1 mimics (A) or miR-1 inhibitor (B) into primary cultured bovine skeletal muscle cells, the expression level of the target gene Pax7 was detected, respectively
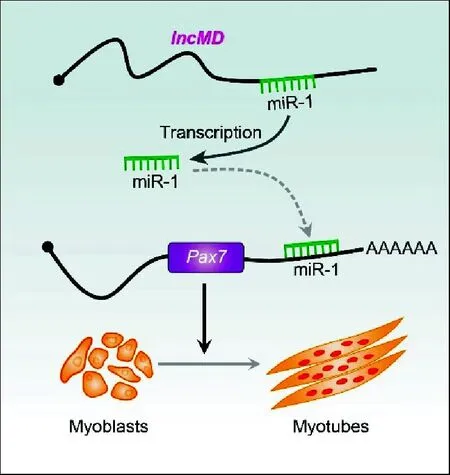
图4 lncMD-miR-1-Pax7调控通路在促进 牛成肌细胞分化中的作用模式Fig.4 Model of the lncMD-miR-1-Pax7 pathway in promoting bovine muscle differentiation
此外,通过在线预测、双荧光素报告系统结合定点突变技术发现,牛Pax7基因是lncMD-miR-1促进肌分化过程的下游靶基因,与已有报道牛Pax7和HDAC4基因是miR-1的靶基因一致[33],而且Pax7基因在肌细胞增殖、分化及肌营养不良等方面发挥重要功能[34-35],这进一步证明本研究结果的可信性。本文以lncMD为研究对象全面开展分子机制研究,从lncMD-miR-1-靶基因互作的角度,解析lncMD调控牛肌肉生成的调控网络。
4 结 论
本研究明确了lncMD对miR-1转录的调控作用,揭示lncMD通过正调控miR-1的表达,抑制其靶基因Pax7的功能,进而促进肌分化。
