淀粉特性及其表面结合蛋白与裸燕麦籽粒硬度的关系研究
南金生 安江红,2 柴明娜 蒋屿潋 朱志强 杨 燕 韩 冰,*
淀粉特性及其表面结合蛋白与裸燕麦籽粒硬度的关系研究
南金生1安江红1,2柴明娜1蒋屿潋1朱志强1杨 燕1韩 冰1,*
1内蒙古农业大学 / 麦类种质创新利用自治区高等学校重点实验室, 内蒙古呼和浩特 010018;2内蒙古自治区农牧业科学院, 内蒙古呼和浩特 010018
籽粒硬度可以反映麦类籽粒胚乳质地, 与其碾磨性能和食用加工品质密切相关。为了探究裸燕麦(L.)籽粒淀粉特性及其表面结合蛋白与籽粒硬度的关系。本文以5份软质和5份硬质裸燕麦种质为材料, 测定总淀粉、支链和直链淀粉含量, 观察淀粉粒特性和粒度, 对淀粉颗粒表面结合蛋白进行质谱鉴定。结果表明: 成熟籽粒中淀粉颗粒的形状有圆形、椭圆形和不规则形, 淀粉粒的数量、体积和表面积均呈现单峰分布; 淀粉粒大小可分为小(粒径<6 μm)、中(6~40 μm)和大淀粉粒(粒径>40 μm), 裸燕麦籽粒主要由小和中淀粉粒组成; 硬度不同的裸燕麦籽粒中淀粉的粒度分布不同, 软质裸燕麦小淀粉粒的数量和体积百分比高于硬质, 中、大淀粉粒的数量和体积百分比低于硬质; 软质裸燕麦小和中淀粉粒的表面积百分比高于硬质, 大淀粉粒表面积百分比低于硬质; 裸燕麦籽粒硬度与支链淀粉含量呈正相关。软质裸燕麦14 kD蛋白在淀粉颗粒表面的含量高于硬质裸燕麦, 该蛋白条带经HPLC/MS共鉴定到41种蛋白, 包括Vromindoline蛋白和燕麦α淀粉酶胰蛋白酶抑制剂等。综上所述, 裸燕麦籽粒淀粉含量、粒度分布和淀粉表面结合蛋白均与籽粒硬度相关, 支链淀粉含量越高, 小淀粉粒的数量、表面积和体积百分比越多, Vromindoline等蛋白含量越高, 裸燕麦籽粒越软, 为揭示裸燕麦籽粒硬度形成机制奠定了基础。
裸燕麦; 籽粒硬度; 淀粉粒度; Vromindoline; HPLC/MS
籽粒硬度是指破坏籽粒所需的力, 是国际较通用的商品小麦分类的重要指标, 是小麦进行市场分级和定价的重要性状之一[1]。燕麦籽粒属于超软质结构[2], 籽粒硬度与其在收获、清洗、脱粒和脱壳过程中的破损率密切相关[3], 对燕麦的加工及食用品质有重要影响。
小麦籽粒硬度的研究开展较早, 已有研究表明, 小麦籽粒硬度不是由淀粉粒和储藏蛋白单独决定的,而是由籽粒中淀粉和蛋白质基质的粘合力以及包被淀粉颗粒的蛋白基质的连续性决定的[4], 并且与淀粉颗粒表面含有少量的脂类物质也有关[5]。Greenwell等[6]通过对100个小麦品种经Triton X-114提取的水洗淀粉粒表面蛋白进行SDS-PAGE电泳, 发现了2个主要谱带, 分子量大约为15 Ku和30 Ku, 而且软质麦中富含有分子量为15 Ku的淀粉粒表面蛋白, 硬质麦中含量稀少, 而在硬粒小麦(AABB)中根本不含有该种蛋白质。该蛋白被命名为Friabilin蛋白, 这种蛋白被认为是判断小麦籽粒硬度的生化标记[7]。Greenwell和Schofield[6]对Frabilin蛋白进行高效液相层析和氨基酸序列分析, 证实了Frabilin蛋白主要由2种蛋白构成, 因其富含色氨酸区域, 故将其命名为Puroindoline a (PINA)和Puroindoline b (PINB)[8-9]。PINA蛋白的缺失或编码PINB蛋白的基因突变均造成小麦胚乳质地变硬[10]。
燕麦籽粒硬度在分子水平的研究开展较晚。直到2015年, Gazza等[11]利用双向电泳在普通栽培燕麦()和砂燕麦()的籽粒淀粉颗粒表面各分离了3个燕麦属特异的Vromindoline (VIN)蛋白, 大小为14 kD, 并在燕麦属内对VIN蛋白进行了系统研究; 作者通过将和基因转化到硬粒小麦Svevo中, 在转基因后代中表达并在淀粉粒表面积累了其编码的蛋白VIN-2.1和VIN-3.1, 使得转基因硬粒小麦的籽粒硬度降低约50%, 表明Vromindoline基因引起籽粒硬度的改变, 可以用于其他谷物籽粒硬度性状的修饰。在六倍体大粒裸燕麦()上关于Vromindoline蛋白的研究还未见报道。
前期研究确立了籽粒硬度的检测方法, 针对260份裸燕麦自然群体设置了3年2点试验, 并对其进行了硬度检测, 消除环境方差后得到了连续变化的硬度数据。本研究选择了自然群体中硬度值差异最大的5份软质和5份硬质裸燕麦材料为研究对象, 以淀粉和淀粉颗粒表面结合蛋白为切入点, 对淀粉含量、淀粉颗粒的形态和粒度分布, 以及淀粉颗粒表面蛋白含量和种类进行研究, 揭示淀粉及其表面结合蛋白与籽粒硬度的关系, 为阐明裸燕麦籽粒硬度的形成机制奠定基础。
1 材料与方法
1.1 试验材料
根据前期研究建立的裸燕麦籽粒硬度检测方法[12]和3年(2019、2020和2021年) 2点(内蒙古乌兰察布市(40.71°N, 13.23°E)和河北省张家口市, 114.72°E, 41.07°N)籽粒硬度的检测数据, 并根据硬度值从2021年种植于乌兰察布的材料中筛选出5份最硬和5份最软的裸燕麦用于本研究(表1)。
1.2 淀粉提取
裸燕麦籽粒经挑选去杂后, 使用旋风磨磨制成粉, 过80目筛, 得到裸燕麦全粉。按照刘刚的燕麦淀粉和蛋白提取方法[13]对裸燕麦淀粉进行提取。
1.3 淀粉含量的测定
总淀粉、直链淀粉和支链淀粉含量的测定按照淀粉含量试剂盒说明书进行样品制备。将标准品母液进行梯度稀释, 制备标准曲线。淀粉水解为葡萄糖后, 利用蒽酮比色法测定葡萄糖的含量, 再换算为淀粉含量, 测定波长为620 nm; 直链淀粉与碘形成络合物于620 nm处读取吸光值, 进而得到样本中直链淀粉的含量; 利用双波长比色法测定支链淀粉与碘形成的络合物, 进而得到样本中支链淀粉的含量, 测定波长为540 nm和740 nm。

表1 10份裸燕麦材料信息
1.4 淀粉颗粒形态的观察
淀粉过100目筛, 取约100 mg淀粉样于载物台上, 铺均匀, 压紧, 并在蔡司Merlin Compact高分辨场发射扫描电子显微镜下进行观察。另外, 直接将成熟后自然干燥的籽粒用力掰开, 将切面压向导电胶, 直接观察粘在胶面上的淀粉颗粒。
1.5 淀粉粒度的检测
称取100~200 mg淀粉于干净EP管中, 加入1 mL 75%酒精, 涡旋混匀后超声混匀。将混匀后的样品加入到Mastersizer 3000马尔文激光粒度仪进行粒度分布测定, 每样测定3次。利用Mastersizer 3000分析软件, 对采集的样品粒度数据进行处理, 得到淀粉的表面积、体积、数量分布曲线等特征参数。
1.6 淀粉颗粒表面蛋白的提取与SDS-PAGE电泳
分别称取1 g全粉和淀粉, 按照霍华蕾等[14]的方法用TritonX-114提取膜蛋白, 于–20℃存放。利用Solarbio公司的BCA蛋白浓度测定试剂盒对蛋白溶液进行定量, 具体操作步骤按照试剂盒说明书进行。全粉和淀粉的蛋白上样量分别为10 μg和30 μg, 蛋白的电泳参照王子宁等[15]使用的SDS-PAGE电泳法。电泳结束后, 考马斯亮蓝溶液染色4 h, 脱色液脱色3~5 h, 背景清晰后, 用成像仪进行成像。
1.7 蛋白胶内酶解与HPLC-MS分析
以染色条带为标准, 将SDS-PAGE电泳分离的TritonX-114可溶性蛋白条带切割, 将胶条切碎, 按照王霞霞等[16]的方法进行胶内酶解。得到的肽段混合物用EASY-nLC 1000超高效液相系统进行分离, 后被注入NSI离子源中进行电离, 然后进质谱仪进行分析。
1.8 搜库
二级质谱数据使用Proteome Discoverer 2.4进行检索, 数据库设置为Avena (UniProt, 1096条序列); 酶切方式设置为Trypsin/P; 漏切位点设置为2; 一级母离子质量误差容忍度设置为10 mg L–1; 二级碎片离子的质量误差容忍度设置为0.02 Da; 肽段离子打分要求高于20, 鉴定结果peptide confidence设置为High。
1.9 数据分析
利用SPSS 20进行差异显著性和Person相关性分析。在UniProt数据库中下载并比对质谱检测到的蛋白的氨基酸序列, 利用MEGA 7采用邻接法(Neighbor-Joining, NJ)构建进化树, bootstrap值设为1000。
2 结果与分析
2.1 不同硬度裸燕麦中淀粉含量的差异
10份裸燕麦成熟籽粒中总淀粉含量变化范围为539.69~620.07 mg g–1, 直链淀粉含量变化幅度为118.80~181.60 mg g–1, 支链淀粉含量变化幅度为426.08~539.29 mg g–1。经统计分析发现, 最软的HX317和最硬的HX320的总淀粉和直链淀粉含量差异不显著(>0.05), 而软质组中的HX344与HX320的总淀粉含量差异显著(<0.05), HX88与HX320的直链淀粉含量差异显著(<0.05); 最软的HX317与硬质组中的HX310、HX268和HX265的直链淀粉含量差异显著, 与硬质组中的HX310、HX21、HX265和HX320的支链淀粉含量差异显著(图1)。软质组和硬质组的硬度值进行方差分析, 发现总淀粉、直链淀粉和支链淀粉在组间的差异均不显著, 组内个别材料之间存在显著差异(>0.05)。籽粒硬度与籽粒淀粉含量的Pearson相关性分析显示, 裸燕麦籽粒硬度值与总淀粉含量的相关系数为–0.098, 与直链淀粉含量的相关系数为–0.07, 与支链淀粉含量的相关系数为0.692, 呈正相关(=0.027)。
2.2 淀粉颗粒形态的观察
选择最软(HX317)和最硬(HX320)两份材料进行扫描电镜观察, 结果表明, 成熟籽粒中包括大颗粒和小颗粒淀粉(图2-f), 淀粉颗粒的形状有圆形、椭圆形和不规则形(图2-c); 软质裸燕麦籽粒的淀粉以小淀粉粒为主(图2-a), 而硬质裸燕麦籽粒中、大淀粉粒分布较多(图2-f)。另外, 水提淀粉颗粒表面光滑, 几乎没有附着物质的存在(图2-d, i), 而直接将成熟籽粒掰开, 直接观察粘在胶面上的淀粉颗粒, 发现软质和硬质裸燕麦淀粉颗粒表面都有很多附着物(图2-e, j)。
2.3 淀粉颗粒的粒度分析
经检测, 裸燕麦淀粉粒的数量、表面积和体积均呈现单峰分布(图3)。参考小麦和水稻等[17]的划分方式, 将裸燕麦淀粉粒按粒径不同划分为小(粒径<6 μm)、中(6 μm<粒径<40 μm)和大淀粉粒(粒径>40 μm)。从表2可以看出, 裸燕麦籽粒主要由小淀粉粒和中淀粉粒组成, 大淀粉粒较少。从数量分布来看, 最软的HX317的小淀粉粒的数量百分比高于HX320, 而中、大淀粉粒的占比低于HX320, 这与扫描电镜观察到的结果基本一致。从表面积分布来看, HX317和HX320的小、中及大淀粉粒的表面积百分比分别是0.027%和0.009%、99.79%和98.26%、0.016%和1.73%, 说明2个材料的淀粉粒表面积都主要取决于中淀粉粒。软硬裸燕麦之间比较, 软质裸燕麦的小、中淀粉粒的所占表面积百分比高于硬质, 而大淀粉粒的低于硬质。从体积分布来看, HX317和HX320的小、中和大淀粉粒的体积百分比分别是14.37%和7.59%、84.82%和88.89%、0.80%和3.52%, 说明裸燕麦淀粉粒总体积主要取决于中淀粉粒。软硬裸燕麦之间比较, 软质裸燕麦的小淀粉粒所占体积百分比约是硬质裸燕麦的2倍, 而中和大淀粉粒所占体积比低于硬质裸燕麦。

图1 10份裸燕麦成熟籽粒中总淀粉、直链淀粉和支链淀粉的含量
不同小写字母表示在0.05概率水平差异显著。缩写同表1。
Different lowercase letters indicate significant difference at the 0.05 probability level. Abbreviations are the same as those given in Table 1.

图2 软质HX317和硬质HX320籽粒淀粉颗粒的显微结构
a~e: HX317的淀粉颗粒; f~j: HX320的淀粉颗粒; 从左向右的5列图片比例尺分别为20、10、3、1和5 μm。
a–e: the starch granules of HX317; f–j: the starch granules of HX320. The scale bars of the five column pictures from left to right are 20, 10, 3, 1, and 5 μm, respectively.
2.4 TritonX-114可溶性蛋白提取
利用TritonX-114提取了燕麦籽粒全粉和淀粉颗粒表面的膜蛋白。结果表明, 籽粒全粉和淀粉颗粒表面检测到了多种蛋白, 包括与PIN和VIN蛋白大小相近的14 kD的蛋白, 并且该蛋白在最软的HX317的淀粉颗粒表面的含量高于最硬的HX320中的含量(图4), 表明裸燕麦淀粉颗粒表面14 kD蛋白的含量可能与籽粒硬度相关。
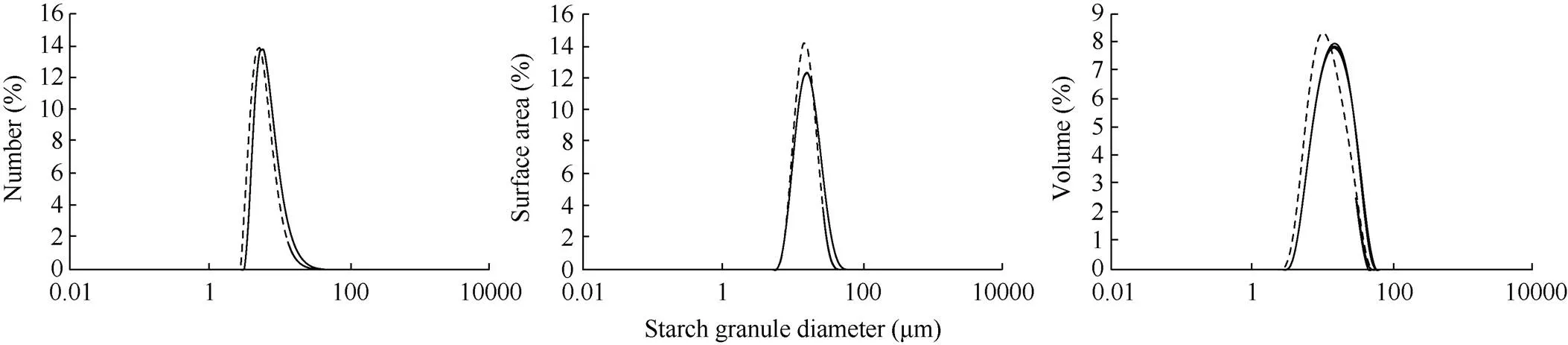
图3 HX317和HX320淀粉粒的数量、表面积和体积分布
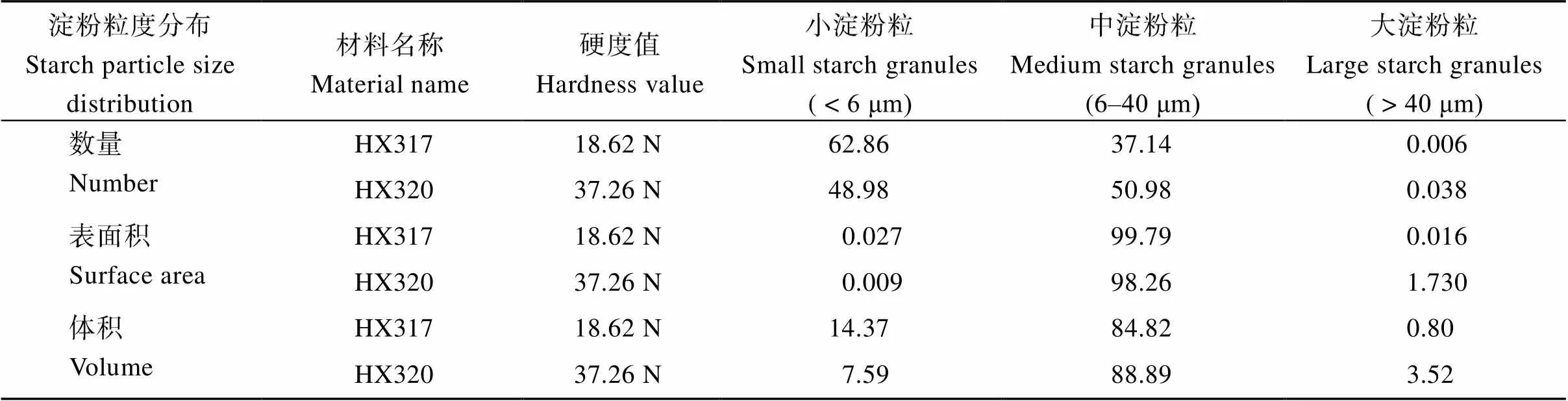
表2 HX317和HX320淀粉粒的数量、表面积和体积分布百分比
缩写同表1。Abbreviations are the same as those given in Table 1.

图4 不同硬度裸燕麦中TritonX-114可溶性蛋白的SDS-PAGE
a和b为全粉中和淀粉颗粒表面结合的蛋白; M为80 kD的蛋白marker; 1~10分别代表HX317、HX88、HX106、HX54、HX344、HX310、HX268、HX21、HX265和HX320, 越向右硬度值越大。
a and b are the proteins form whole flour and starch surface bound proteins, respectively. M: 80 kD protein marker. 1–10 represent HX317, HX88, HX106, HX54, HX344, HX310, HX268, HX21, HX265, and HX320, respectively. The further to the right the sequence, the greater the hardness value of the variety.
2.5 硬度相关蛋白的质谱鉴定与生信分析
从图4-b的SDS-PAGE凝胶上切取14 kD处的条带, 进行胶内酶解, 对酶解得到的肽段混合物进行质谱鉴定。经基质峰、酶自切峰校正, 根据UniProt中燕麦属蛋白数据库进行比对, 鉴定到159个肽段, 共41个蛋白, 包括Vromindoline蛋白、燕麦α淀粉酶胰蛋白酶抑制剂(AATI)、燕麦储藏蛋白(Avenin)、类麦醇溶蛋白(Gliadin-like)和球蛋白(globulin)等(表3)。其中, Vromindoline蛋白和燕麦α淀粉酶胰蛋白酶抑制剂在UniProt数据库中比对到了普通栽培燕麦()、细燕麦()、岛屿燕麦()、绵毛燕麦()、砂燕麦()、大穗燕麦()、大燕麦()和墨菲燕麦(), 表明本研究从裸燕麦()淀粉颗粒表面提取的14 kD蛋白中也存在Vromindoline蛋白和AATI蛋白。得分最高的Vromindoline和AATI蛋白的特异性肽段的质谱分析结果如图5所示。经过蛋白序列比对, Vromindoline和AATI蛋白在燕麦属内是非常保守的, Vromindoline蛋白包含“WPWKWWWK”的色氨酸丰富区(图6)。

图5 I2E102和A0A1B2LQE3特异肽段的质谱图

表3 14 kD处蛋白的部分质谱分析结果

图6 9个Vromindoline蛋白和8个AATI蛋白的序列比对
Fig. 6 Sequence alignment of nine Vromindoline and eight AATI proteins
A: 9个VIN蛋白和8个AATI蛋白的进化树; B: VIN蛋白的序列比对, 红框为色氨酸丰富区。
A: the evolutionary tree of nine VIN proteins and eight AATI proteins; B: the sequence alignment of VIN proteins, and the red box is the tryptophan-rich region.
3 讨论
小麦PIN蛋白是淀粉颗粒结合蛋白, 包含一个色氨酸丰富区, 该区域具有脂质结合特性[18-19], 且软质小麦淀粉颗粒表面的PIN蛋白量显著高于硬质小麦[20]。小麦淀粉粒结合蛋白的突变会影响直链淀粉含量、支链淀粉结构, 引起淀粉粒结晶异常[21]。本研究从裸燕麦成熟籽粒的淀粉颗粒表面分离出了与籽粒硬度相关的VIN蛋白, 且该蛋白也包含一个色氨酸丰富区, 且在软质裸燕麦中的含量高于硬质, 这与小麦上的研究类似。PIN蛋白通过色氨酸丰富区与膜脂相互作用, 影响籽粒脱水过程中造粉体脂双层膜的稳定性, 使其不会被完全破坏, 阻碍了淀粉颗粒与蛋白质基质的结合, 而突变的PIN蛋白的脂结合能力降低, 造粉体膜的稳定性降低, 淀粉颗粒与蛋白质框架结合更直接、牢固, 从而使籽粒硬度增加[22]。淀粉表面极性脂在PIN蛋白与淀粉表面结合中的发挥重要媒介作用, 且在软麦中含量高于硬麦[23-24]。本研究在淀粉颗粒表面也观察到一些附着物, 可能是一些脂质或者蛋白, 推测其VIN蛋白可能在裸燕麦籽粒硬度中发挥与PIN蛋白类似的功能, 其作用模式有待进一步研究。
经粒度分析表明, 裸燕麦淀粉颗粒包含小、中及大淀粉粒3种粒型, 这与小麦、水稻和玉米等[17]的研究相似。不同的是, 水稻、玉米的淀粉粒的体积和表面积呈三峰和双峰分布, 小麦的体积呈微弱的四峰分布, 表面积呈三峰分布, 而裸燕麦的淀粉粒的数量、体积和表面积均呈现单峰分布。小麦胚乳淀粉基本上由小淀粉粒(粒径<5 μm)组成, 而裸燕麦由小(粒径<6 μm)和中淀粉粒(6~40 μm)共同组成, 但软质燕麦的小粒淀粉比例显著高于硬质裸燕麦, 造成这种差异的原因有待进一步研究。
淀粉、脂质和蛋白三者的结合方式是脂质中脂肪酸的具有疏水性的烃链进入直链淀粉螺旋空腔中,与直链淀粉结合, 而在螺旋空腔外的具有极性的羧基, 可以和蛋白质的带电基团通过静电作用结合, 从而将两者连接起来, 形成淀粉-脂质-蛋白质三元复合物[25-26]。有研究表明, 籽粒中单半乳糖甘油二酯(monogalactosyl diglyceride, MGDG)和双半乳糖甘油二酯(digalactosyl diglyceride, DGDG)含量与小麦[27]和玉米[28]籽粒胚乳质地紧密相关。MGDG与小麦籽粒硬度呈负相关, 而DGDG与之呈现正相关[29]。本研究推测, 裸燕麦籽粒成熟过程中, 软质裸燕麦的造粉体形成更多的小淀粉粒, 比表面积更大, 可以通过膜脂与更多的VIN蛋白进行结合, 而VIN蛋白越多, 稳定了造粉体的脂双层膜, 从而使得胚乳结构松弛, 空隙较大, 硬质裸燕麦VIN蛋白少, 膜稳定性降低而降解, 淀粉和蛋白质基质的结合更加紧密。
4 结论
裸燕麦成熟籽粒中支链淀粉含量与籽粒硬度呈正相关; 淀粉颗粒的粒度分布影响籽粒硬度, 软质裸燕麦中、小淀粉粒的数量、表面积和体积百分比均高于硬质裸燕麦; Vromindoline等蛋白位于裸燕麦淀粉颗粒表面, 且在软质裸燕麦中的含量高于硬质裸燕麦。
[1] 陈锋, 李根英, 耿洪伟, 夏兰芹, 夏先春, 何中虎. 小麦籽粒硬度及其分子遗传基础研究回顾与展望. 中国农业科学, 2005, 38: 1088–1094. Chen F, Li G Y, Geng H W, Xia L Q, Xia X C, He Z H. Review and prospect of wheat grain hardness and its molecular genetic basis., 2005, 38: 1088–1094 (in Chinese with English abstract).
[2] 安江红, 张文静, 赵瑛琳, 韩冰, 南金生. 麦类作物籽粒硬度的研究进展. 北方农业学报, 2020, 48(4): 40–47. An J H, Zhang W J, Zhao Y L, Han B, Nan J S. Research progress on the grain hardness ofcrops., 2020, 48(4): 40–47 (in Chinese with English abstract).
[3] Peltonen-sainio, Muurinen S, Vilppu M, Rajala A, Gates F, Kirkkari A. Germination and grain vigor of naked oat in response to grain moisture at harvest., 2001, 127: 147–156.
[4] Stenvert N L, Kingswood K. The influence of the physical structure of the protein matrix on wheat hardness., 1977, 28: 11–19.
[5] Barlow K K, Buttrose M S, Simmonds D H, Vesk M. The nature of the starch-protein interface in wheat endosperm., 1973, 50: 443–454.
[6] Greenwell P, Schofield J D. A Starch granule protein associated with endosperm softness in wheat., 1986, 63: 379–380.
[7] 郭世华. 中国小麦籽粒硬度的生化和分子标记研究. 山东农业大学博士学位论文, 山东泰安, 2003. pp 6–7. Guo S H. Biochemical and Molecular Markers of Chinese Wheat Grain Hardness. PhD Dissertation of Graduate School of Shandong Agricultural University, Tai’an, Shandong, China, 2003. pp 6–7 (in Chinese with English abstract).
[8] Blochet J E,Chevalier C, Forest E, Pebay-Peyroula E, Gautier M F, Joudrier P, Pézolet M, Marion D. Complete amino acid sequence of puroindoline, a new basic and cystine-rich protein with a unique tryptophan-rich domain, isolated from wheat endosperm by Triton X-114 phase partitioning., 1993, 329: 336–340.
[9] Marion D, Clark D C. Wheat lipids and lipid-binding proteins: structure and function., 1995: 245–260.
[10] Bhave M, Morris C F. Molecular genetics of puroindolines and related genes: regulation of expression, membrane binding properties and applications., 2008, 66: 221–231.
[11] Gazza L, Taddei F, Conti S, Gazzelloni G, Muccilli V, Janni M, D’Ovidio R, Alfieri M, Redaelli R, Pogna N E. Biochemical and molecular characterization of Avena indolines and their role in kernel texture., 2015, 290: 39–54.
[12] 安江红, 张文静, 杨晓虹, 南金生, 杨燕, 闫明霞, 韩冰. 2种裸燕麦籽粒硬度测定方法比较. 作物杂志, 2021, (6): 28–35.An J H, Zhang W J, Yang X H, Nan J S, Yang Y, Yan M X, Han B. Comparison of two methods for measuring grain hardness of naked oats., 2021, (6): 28–35 (in Chinese with English abstract).
[13] 刘刚. 燕麦淀粉和蛋白的提取及理化性质研究. 武汉工业学院硕士学位论文, 湖北武汉, 2008. pp 9–12. Liu G. Extraction and Physicochemical Properties of Oat Starch and Protein. MS Thesis of Graduate School of Wuhan Institute of Technology, Wuhan, Hubei, China, 2008. pp 9–12 (in Chinese with English abstract).
[14] 霍华蕾, 郭坚, 罗杰, 何光源. 种子中Puroindoline蛋白的SDS-PAGE分析. 生物技术通讯, 2005, (2): 153–155. Huo H L, Guo J, Luo J, He G Y. SDS-PAGE analysis of Puroindoline protein in seed., 2005, (2): 153–155 (in Chinese with English abstract).
[15] 王子宁, 郭北海. 小麦地方品种SDS-PAGE分析. 华北农学报, 1992, (2): 35–39. Wang Z N, Guo B H. SDS-PAGE Analysis of Wheat Landraces., 1992, (2): 35–39 (in Chinese with English abstract).
[16] 王霞霞, 柴守玺, 常磊, 柴继宽, 徐智明. 燕麦种子蛋白质组的GeLC-MS/MS分析. 草地学报, 2012, 20(1): 108–115. Wang X X, Chai S X, Chang L, Chai J K, Xu Z M. GeLC-MS/MS analysis of oat seed proteome., 2012, 20(1): 108–115 (in Chinese with English abstract).
[17] 徐云姬, 李银银, 钱希旸, 王志琴, 杨建昌. 三种禾谷类作物强、弱势粒淀粉粒形态与粒度分布的比较. 作物学报, 2016, 42: 70–81. Xu Y J, Li Y Y, Qian X Y, Wang Z Q, Yang J C. Comparison of starch grain morphology and size distribution in superior and inferior grains of three cereal crops., 2016, 42: 70–81 (in Chinese with English abstract).
[18] Bordier C. Phase separation of integral membrane proteins in Triton X-114 solution., 1981, 256: 1604–1607.
[19] Gautier M F, Aleman M E, Guirao A, Marion D, Joudrier P.puroindolines, two basic cystine-rich seed proteins: cDNA sequence analysis and developmental gene expression., 1994, 25: 43–57.
[20] 常成, 张海萍, 李保云, 刘广田. 小麦籽粒发育时期Puroindolines蛋白与硬度的关系. 麦类作物学报, 2007, 27: 630–633. Chang C, Zhang H P, Li B Y, Liu G T. The relationship between Puroindoline protein during grain development and kernel hardness of common wheat., 2007, 27: 630–633 (in Chinese with English abstract).
[21] 赵法茂, 蔡瑞国, 毕建杰, 肖军, 王宪泽. 小麦籽粒淀粉分支酶同种型SBE IIb的亚细胞定位及遗传多样性. 作物学报, 2009, 35: 952–957. Zhao F M, Cai R G, Bi J J, Xiao J, Wang X Z. Subcellular localization and genetic polymorphism of isoform of starch branching enzyme (SBE IIb) in wheat grain., 2009, 35: 952–957 (in Chinese with English abstract).
[22] Lillemo M, Morris C. A leucine to proline mutation in Puroindoline b is frequently present in hard wheats from northern Europe., 2000, 100: 1100–1107.
[23] 秦海霞. 小麦淀粉表面极性脂对籽粒硬度的影响及其生理机制. 河南农业大学硕士学位论文, 河南郑州, 2017. pp 2–3. Qin H X. Effects of Surface Polar Lipids on Wheat Starch on Grain Hardness and Its Physiological Mechanism. MS Thesis of Henan Agricultural University, Zhengzhou, Henan, China, 2017. pp 2–3 (in Chinese with English abstract).
[24] Ma D Y, Qin H X, Ding H N, Zhang J, Wang C Y, Guo T C. Surface lipids play a role in the interaction of puroindolines with wheat starch and kernel hardness., 2016, 93: 523–528.
[25] Zhang G, Hamaker B R. A three component interaction among starch, protein, and free fatty acids revealed by pasting profiles., 2003, 51: 2797–2800.
[26] Zhang G, Hamaker B R. Sorghum (L. Moench) flour pasting properties influenced by free fatty acids and protein., 2005, 82: 534–540.
[27] Finnie S, Jeannotte R, Morris C, Faubion J M. Variation in polar lipid composition among near-isogenic wheat lines possessing different puroindoline haplotypes., 2010, 51: 66–72.
[28] Wang H H, Huagn Y C, Xiao Q, Huang X, Li C S, Gao X Y, Wang Q, Xiang X L, Zhu Y D, Wang J C, Wang W Q, Larkins B A, Wu Y R. Carotenoids modulate kernel texture in maize by influencing amyloplast envelope integrity., 2020, 11: 5346.
[29] Ohm J, Chung O. Relationships of free lipids with quality factors in hard winter wheat flours., 2002, 79: 274–278.
Relationship between the starch properties and its surface-bound proteins in grains with hardness inL.
NAN Jin-Sheng1, AN Jiang-Hong1,2, CHAI Ming-Na1, JIANG Yu-Lian1, ZHU Zhi-Qiang1, YANG Yan1, and HAN Bing1,*
1Key Laboratory of Wheat Germplasm Innovation and Utilization Autonomous Region Higher School / Inner Mongolia Agricultural University, Hohhot 010018, Inner Mongolia, China;2Inner Mongolia Academy of Agriculture and Animal Husbandry Science, Hohhot 010018, Inner Mongolia, China
Kernel hardness can reflect the texture of wheat kernels and it is closely related to its milling performance and edible quality. The objective of this study is to explore the relationship between naked oat (L.) grain starch properties and its surface-bound proteins with grain hardness. In this experiment, to determine the content of total starch, amylopectin and amylose, observe the characteristics and particle size of starch granules, and identify the surface-bound proteins of starch granules by mass spectrometry, five soft and five hard naked oat germplasms were used as the materials. The results showed that the shapes of starch granules in mature grains were round, oval and irregular, and the number, volume and surface area of starch granules showed a unimodal distribution. The size of starch granules could be divided into small (particle size < 6 μm), medium (6–40 μm), and large starch granules (particle size > 40 μm). Naked oat grains were mainly composed of small and medium starch granules. The grain size distribution of starch in naked oat grains with different hardness was different. The number and volume percentage of small starch granules in soft naked oat were higher than those in hard, and the number and volume percentage of medium and large starch grains were lower than those in hard. The percentage of surface area of soft naked oat small and medium starch granules was higher than that of hard, and the percentage of surface area of large starch granules was lower than that of hard. There was a significant positive correlation between the grain hardness of naked oat and the amylopectin content. The results showed that the protein content of the starch granule surface with a size of 14 kD was higher in soft oats than in hard ones. A total of 41 proteins were identified by HPLC/MS for starch granule surface-binding proteins at 14 kD, including Vromindoline protein and oat alpha amylase trypsin inhibitor. The above results showed that the starch content, particle size distribution and starch surface-bound protein in naked oat grains were all related to grain hardness. The higher the amylopectin content, the greater the number, surface area and volume distribution of small starch granules. The higher the protein content such as Vromindoline, and the softer the naked oat kernel. This study laid the foundation for revealing the formation mechanism of grain hardness inL.
L.; grain hardness; starch particle size; Vromindoline; HPLC/MS
2022-10-05;
2023-02-10;
2023-02-27.
10.3724/SP.J.1006.2023.21064
通信作者(Corresponding author):韩冰, E-mail: hb_nmg@163.com
E-mail: 470917658@qq.com
本研究由国家重点研发计划项目(2022YFE0119800), 麦类种质创新利用自治区高等学校重点实验室和“饲用作物及有益微生物种质资源与分子育种”团队经费项目(TD202103)资助。
This study was supported by the National Key Research and Development Program of China (2022YFE0119800), the Key Laboratory of Wheat Germplasm Innovation and Utilization Autonomous Region Higher School, and Forage Crops and Beneficial Microorganism Germplasm Resources and Molecular Breeding Team Funding (TD202103).
URL: https://kns.cnki.net/kcms/detail//11.1809.S.20230226.1541.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

