基于转录组学分析肠道菌群发酵褐藻胶寡糖对沙门氏菌的作用机制
程佳莹,肖梦诗,任昕淼,于 颖,付晓丹,牟海津
(1.中国海洋大学 食品科学与工程学院,山东 青岛 266003;2.南昌大学 食品科学与技术国家重点实验室/中国-加拿大食品科学与技术联合实验室(南昌)/江西省生物活性多糖重点实验室,江西 南昌 330047)
沙门氏菌(Salmonella)是一种革兰氏阴性致病菌,感染会引起动物腹泻、呕吐甚至死亡,给养殖行业造成经济损失。污染沙门氏菌的家禽肉制品和蛋制品是人感染沙门氏菌的主要来源,在家禽养殖中控制沙门氏菌在动物体内的定植对促进食品安全至关重要[1]。饲喂益生菌、益生元等抗生素替代品是减少沙门氏菌感染家禽的有效策略之一。常用的益生菌有乳酸菌、双歧杆菌、枯草芽孢杆菌,可以促进家禽肠道短链脂肪酸和抗菌素的产生,抑制沙门氏菌的定植[2]。低聚果糖可以调节肠道菌群组成,降低盲肠中的沙门氏菌,降低致病菌水平传播,提高动物抵抗沙门氏菌的能力[3]。
褐藻胶寡糖(Alginate oligosaccharides,AOS)是从褐藻中提取出来的线性酸性寡糖,由古罗糖醛酸(G)和甘露糖醛酸(M)组成,具有抗菌、免疫调节、抗炎等生物活性[4]。AOS 在家畜养殖中具有广阔的应用前景,可以提高营养物质消化率,增强免疫力,促进仔猪生长[5]。在家禽养殖中,AOS 的添加能够提高鸡的采食量和生长性能,增加盲肠中的乳酸菌丰度,降低致病性大肠杆菌丰度[6]。AOS 可以减轻由沙门氏菌引起的鸡体质量下降,降低死亡率[7]。前人研究表明,肠道是AOS 作用的靶点[8]。在饲料全面禁抗背景下,迫切需要开发更安全、高效的饲料添加剂以确保家禽健康养殖。AOS 已被批准作为新型饲料添加剂,然而,AOS 对肠道菌群及代谢调控的影响研究较少,在肠道中的抗菌机制尚不清楚。因此,阐明AOS 如何影响家禽的肠道致病菌将有助于开发新的治疗方法,以克服致病菌侵染后产生的不利影响。为此,通过酶解法制备AOS,采用体外模拟试验探究AOS 对胃肠消化液的抵御能力。建立体外模拟肠道发酵模型,将AOS 与鸡粪便共培养,探究AOS 在鸡肠道微环境中对沙门氏菌的抗菌效果,并采用转录组学方法分析沙门氏菌毒力因子表达量变化,以期为AOS 用作家禽养殖中的替抗产品提供理论依据。
1 材料和方法
1.1 材料和试剂
沙门氏菌(Salmonella entericasubsp.entericaserovar Typhimurium,S.enterica,CMCC50222)、褐藻胶裂解酶AlyM 由中国海洋大学海洋微生物工程实验室提供;胃蛋白酶、胰蛋白酶、胆汁盐、胰酶购自上海麦克林公司;RNA 提取试剂盒购自美国Omega Bio-tec公司;反转录试剂盒购自加拿大ABMgood公司;LB 培养基、BHI培养基、DHL 培养基购自青岛海博公司;其他试剂均为分析纯,购自国药集团化学试剂公司。
1.2 主要仪器
YQX-T 型厌氧培养箱购自上海龙跃公司;LAQUAtwin-pH-22 型手持pH 值计购自日本HORIBA 科学仪器事业部;DC150 型氮吹仪购自杭州佑宁仪器公司;1260 Infinity高效液相色谱仪购自美国Agilent 公司;Gene AmpR PCR 仪购自美国ABI公司;Centrifuge 5430R 型高速冷冻离心机购自德国Eppendorf 公司;FDU-1200 型真空冷冻干燥机购自东京理化机械株式会社;ELx800 酶标仪购自美国BioTek公司。
1.3 试验方法
1.3.1 AOS 的制备 根据文献[9]制备AOS:将褐藻胶裂解酶AlyM(70 U/mL)与2%海藻酸钠混合均匀,45 ℃条件下反应6 h。将酶解产物在90 ℃条件下灭菌15 min 使酶失活,4 ℃条件下10 000 r/min 离心10 min。将酶解液与5 倍体积乙醇混合均匀,4 ℃条件下5 000 r/min 离心10 min,收集沉淀,得到AOS,真空冷冻干燥后用于后续试验。AOS 分子质量为1.93 ku,M和G比例为0.37。
1.3.2 模拟胃液消化AOS 将310 mg NaCl、110 mg KCl、15 mg CaCl2、60 mg NaHCO3溶解在100 mL纯水中制成胃电解质溶液,并用0.1 mol/L HCl 溶液将胃电解质溶液的pH 值调节至2.0。将15 mL 胃电解质溶液、3.6 mg 胃蛋白酶、0.3 mL CH3COONa 溶液(1.0 mol/L,pH 值为5.0)混合,并用0.1 mol/L HCl 将溶液的pH 值调节至2.0,此为模拟胃液。加入30 mg AOS,37 ℃条件下水浴振荡反应,分别在0、2、4、6 h取出2 mL 样品,在水中煮沸10 min 使酶失活,最后用1 mol/L NaHCO3调节溶液pH值至7.0。
1.3.3 模拟肠液消化AOS 将540 mg NaCl、65 mg KCl、33 mg CaCl2溶 解 在100 mL 纯 水 中,并 使 用1 mol/L NaHCO3溶液将pH 值调节至7.0,此为小肠盐溶液。然后将6.5 mg 胰蛋白酶、200 mL 4%胆汁盐溶液、50 mL 7%胰酶溶液加入到50 mL 小肠盐溶液中。使用0.1 mol/L NaOH 溶液,在室温下连续搅拌,将溶液的pH 值调节至7.5,从而得到模拟小肠液。将3 mL 模拟小肠液与10 mL 的胃液消化物(将1.3.2 中模拟胃消化6 h 后的溶液用1.0 mol/L NaHCO3调节pH 值至7.0)混合,37 ℃条件下水浴振荡,分别在0、2、4、6 h 取出2 mL 样品,在水中煮沸10 min使酶失活。
1.3.4 消化液中还原糖含量的测定 称取3.25 g 3,5-二硝基水杨酸溶于少量纯水中,移入500 mL容量瓶,加2 mol/L NaOH 溶液162.5 mL,再加入22.5 g丙三醇,摇匀,定容至500 mL,得到DNS 溶液,储存于棕色瓶放置在冰箱中待用。
标准曲线绘制:称取大于1 g 的葡萄糖置于热风干燥箱,于100 ℃条件下干燥至恒质量,准确称取1 g 葡萄糖,用纯水溶解并定容至1 000 mL,梯度稀释。将0.2 mL 待测样品、0.48 mL 纯水、0.5 mL DNS充分混匀后于沸水浴中加热煮沸5 min,流水冲冷却后再分别向各试管中加入纯水,定容至5 mL,混匀,540 nm 波长下测定各管的吸光度。标准曲线方程为y=0.998 4x+0.072 9(R2=0.999 4)。
1.3.5 消化液中AOS 分子质量变化的测定 AOS分子质量采用高效液相色谱(HPLC)法测定,色谱条件:TSKgel G3000 色谱柱(7.8 mm×300 mm);流动相:0.2 mol/L NaNO3和0.01 mol/L NaH2PO4;流速:0.5 mL/min;进样量:10 μL;检测器:示差折光检测器。
1.3.6 AOS 的体外发酵 配制模拟肠道培养基,配制方法参照文献[10],在培养基中加入AOS 至质量浓度为15 g/L,不加AOS 的培养基作为对照组。取鸡粪便置于0.01 mol/L PBS,涡旋振荡后静置30 min,取上层菌悬液待用。粪便菌悬液按照体积分数为5%的接种量接种于对照组和AOS 组培养基中。使用LB 培养基活化沙门氏菌,在37 ℃条件下培养5 h,取1 mL 菌液,4 ℃条件下8 000 r/min 离心5 min,弃上清,细菌沉淀重悬于1 mL 0.01 mol/L PBS中。在50 mL AOS 组和对照组培养基中,各加入1 mL 细菌重悬液,模拟沙门氏菌侵染鸡肠道环境,在37 ℃条件下厌氧培养72 h。使用BHI 培养基和DHL 培养基分别对细菌菌落总数和沙门氏菌菌落计数。
1.3.7 AOS 对沙门氏菌转录的影响测定 分别筛选1.3.6 中AOS 组和对照组中的沙门氏菌,使用LB培养基培养5 h 至生长对数期,根据RNA 试剂盒的说明书进行RNA 抽提,用NanoDrop 2000 检测提取的RNA 浓度和纯度;用反转录试剂盒将提取的RNA 反转成cDNA,利用1%琼脂糖凝胶电泳检测cDNA 质量。选择符合RNA 质量指标的样品进行cDNA 文库制备和实时荧光定量PCR。文库构建及RNA-seq 测序委托上海美吉公司完成。根据Illumina MiSeq 平台(Illumina,SanDiego,USA)标准操作规程将纯化后的扩增片段构建PE2*300 的文库,然后用Phusion DNA polymerase(NEB)进行PCR扩增15 个循环。使用TBS380(Picogreen)仪器定量后,Illumina HiSeq X Ten 仪器进行RNA-seq 双端测序。利用Illumina 平台生成的数据进行生物信息学分析。基因表达量水平使用FPKM 方法计算。用DEseq 进行样本组间基因差异表达分析,以log2FC(Fold change)≥1 或≤-1,P<0.05 作为筛选差异表达基因(DEG)的标准。利用Goatools 软件和KOBA 2.1.1软件进行GO功能富集和KEGG富集分析。
1.3.8 实时荧光定量PCR 测定沙门氏菌基因表达量 基于RNA-seq 数据,选择沙门氏菌毒力、侵染、黏附基因为目标基因,以16S rRNA基因作为参考基因。使用DANMAN 软件设计引物,引物列于表1中。按照FU 等[11]的方法,使用RNA 提取试剂盒从细菌沉淀中提取总RNA,并使用DNase Ⅰ(Vazyme)去除基因组DNA,使用ND-2000(NanoDrop Technologies)进行定量。按照报道的方法进行cDNA 合成和基因扩增[12]。相对定量的结果采用2-△△CT法进行处理,利用16S内参基因进行校正。
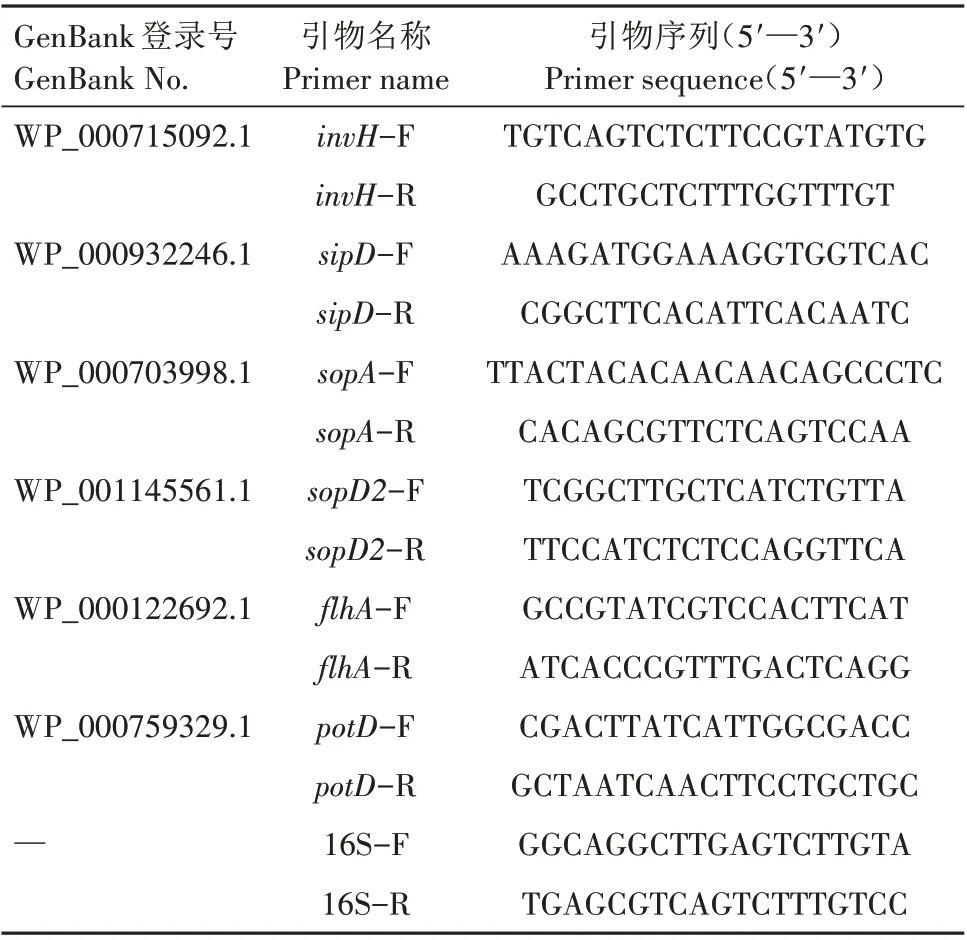
表1 实时荧光定量PCR引物名称和引物序列Tab.1 Primers name and sequences for quantitative real-time PCR
2 结果与分析
2.1 体外模拟消化对AOS的影响
不可消化的碳水化合物可以完整抵达肠道,作为肠道微生物发酵的益生元,为宿主提供能量和营养[13]。食物进入胃中,在胃酸、消化酶、胃的蠕动下被消化[14]。AOS 经胃液模拟消化后,其还原糖和分子质量的变化如图1A—1B 所示。采用DNS 法测定还原糖含量,还原糖含量并未发生明显变化(P>0.05,图1A)。经HPLC 测定0、2、4、6 h时的AOS,出峰时间在23.8~24.4 min,出峰时间和峰型也无明显差异(图1B)。肠液中有胰蛋白酶、胰酶、胆汁盐,经肠液处理后,AOS 的还原糖含量变化不明显(P>0.05),AOS 的出峰时间在23.3~24.3 min,出峰时间和峰型没有发生明显变化(图1C—1D)。以上结果表明,AOS基本不会在胃肠道中被消化。

图1 AOS在胃肠液消化过程中还原糖含量和分子质量变化Fig.1 Change of reducing sugar content and molecular weight during in vitro simulated digestion of AOS
2.2 AOS在肠道环境中对沙门氏菌生长的影响
在体外模拟肠道发酵模型中,0 h 时,沙门氏菌在AOS 组和对照组中相对丰度分别为4.6% 和4.5%,加入AOS 后,沙门氏菌利用培养基中的氮源和碳源等营养物质,导致菌落总数由初始时8.40×105cfu/mL 增长到70.00×105cfu/mL,但是在肠道菌群中相对丰度下降(表2)。发酵72 h 后,沙门氏菌的相对丰度降到1.1%。此时由于培养基中基础营养物质和AOS 被消耗殆尽,菌体生长缓慢,由稳定期过渡到衰亡期,活菌数降低,细菌逐渐自溶,导致平板计数测得总菌数和沙门氏菌菌落数降低。在对照组中,沙门氏菌的菌落总数和相对丰度都显著上升。由于对照组中营养物质较AOS 组匮乏,同时致病菌增殖导致有毒代谢产物快速积累,在48 h 时菌群生长进入衰亡期。经72 h 发酵后,沙门氏菌的相对丰度达到18.4%。以上结果表明,鸡感染沙门氏菌后,若不加以干预,沙门氏菌会在肠道中迅速增殖;加入AOS 干预后,可以减缓沙门氏菌在肠道环境中的生长速度。
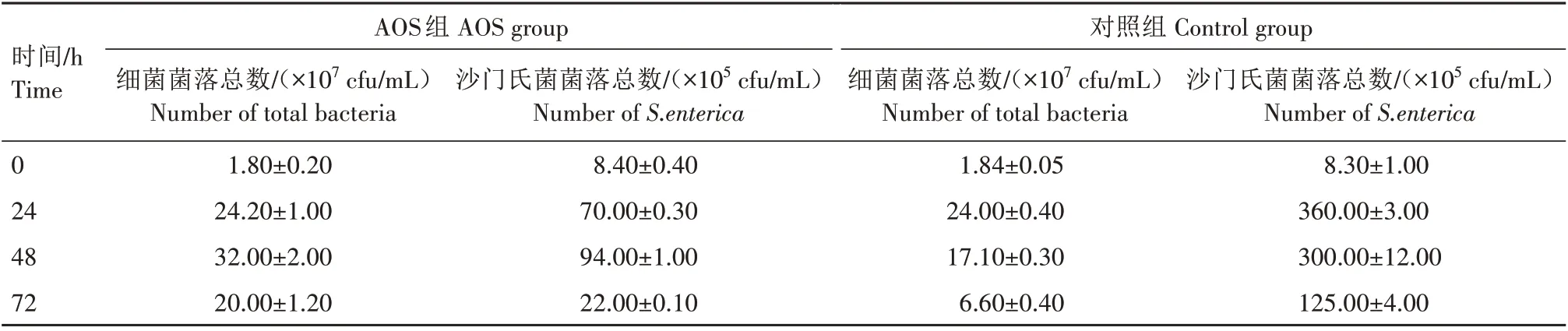
表2 模拟肠道发酵模型中细菌菌落总数和沙门氏菌菌落总数Tab.2 The total bacteria and S.enterica colonies counted during in vitro fecal fermentation
2.3 AOS在肠道环境中对沙门氏菌转录组的影响
2.3.1 沙门氏菌转录组的差异基因表达分析 图2A 为转录本读数密度,AOS 组的lg(TPM+1)在0~4内表达值较低,而在相同范围内,对照组基因表达水平更高。对照组的lg(TPM+1)在3~4 有大多数读数偏向,因此,对照组基因表达水平较高。总体而言,2 种样品类型之间大约83%的基因表达水平相似。图2B为两组基因关系的散点图,两样本之间的基因表达量呈正相关。从主成分分析(PCA)图(图2C)可以看出,AOS 组与对照组的组间差异明显,但组内重复性均较好。共有874 个差异表达基因,其中AOS 组表达量上调的基因有380 个,表达量下调基因有494个(图2D)。
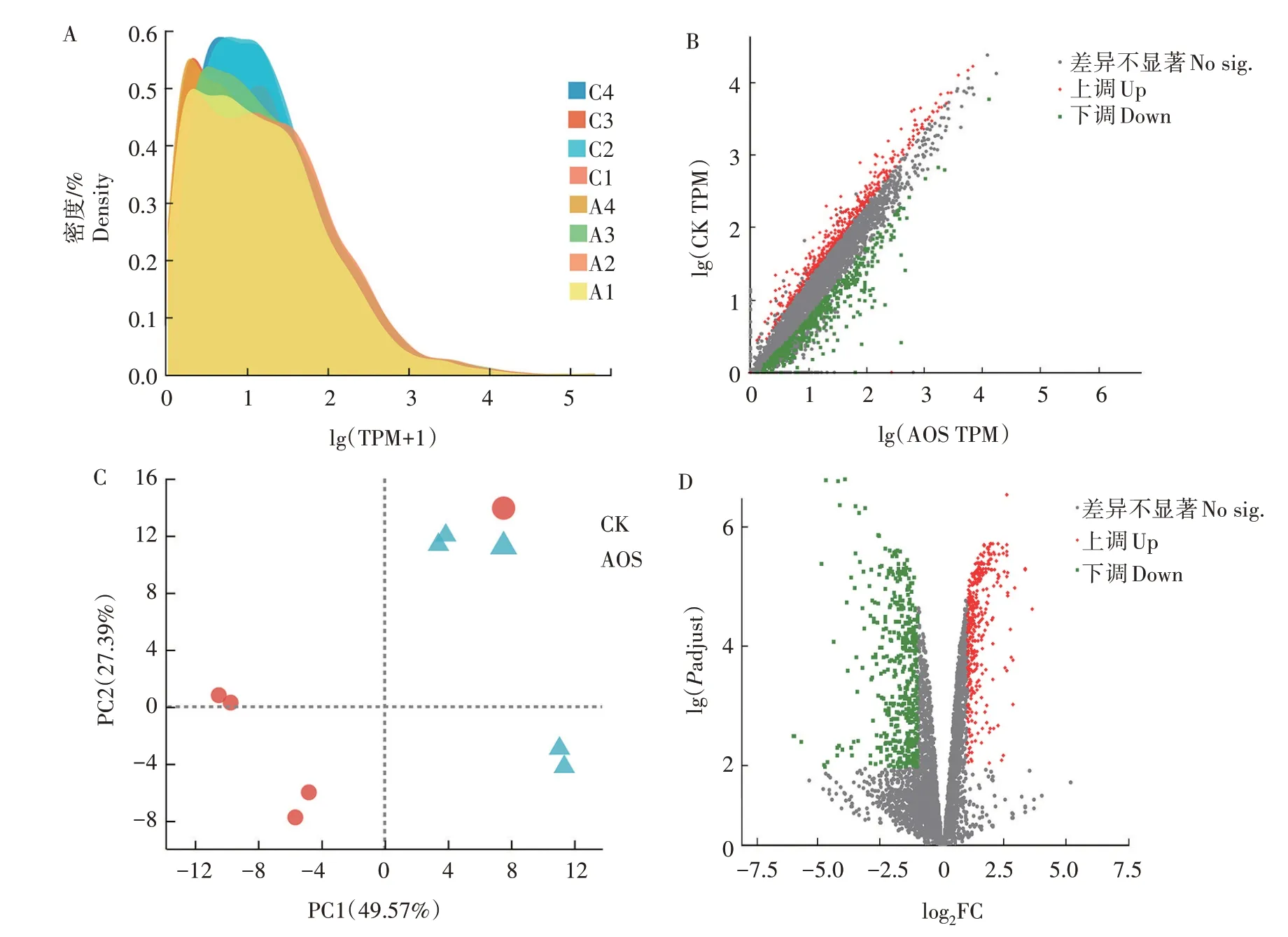
图2 AOS在肠道环境中对沙门氏菌转录组的影响Fig.2 Effects of AOS on S.enterica transcriptomie in the chicken intestinal microenvironment
2.3.2 沙门氏菌转录组的差异基因注释分析 为进一步分析表达差异基因的功能,对表达差异显著的基因进行GO 注释分析(图3A)。选取差异显著的条目绘制分类图,包括2 个生物学过程(Biological process)、6个细胞组分(Cellular component)、12个分子功能(Molecular function)。值得注意的是,表达量显著下调的基因在三大功能中均有分布,尤其以分子功能最为突出,ATP 连接(GO:0005524)、金属离子连接(GO:0046872)、DNA 连接(GO:0003677)、转移酶活性(GO:0008483)分别富集78、66、61、43个DEG。细胞组分中显著富集到膜整体成分(GO:0016021)、质膜(GO:0005886)、细胞质(GO:0005737)、细胞液(GO:0005829),分别富集到165、110、100、92个DEG。同时,对表达量差异显著的基因进行KEGG注释(图3B),共注释得到26条代谢通路,主要集中在信号转导(Signal transduction)、膜运输(Membrane transport)、碳水化合物代谢(Carbohydrate metabolism)、能 量 代 谢(Energy metabolism)、氨基酸代谢(Amino acid metabolism)、细菌传染病(Infectious disease:Bacterial)。
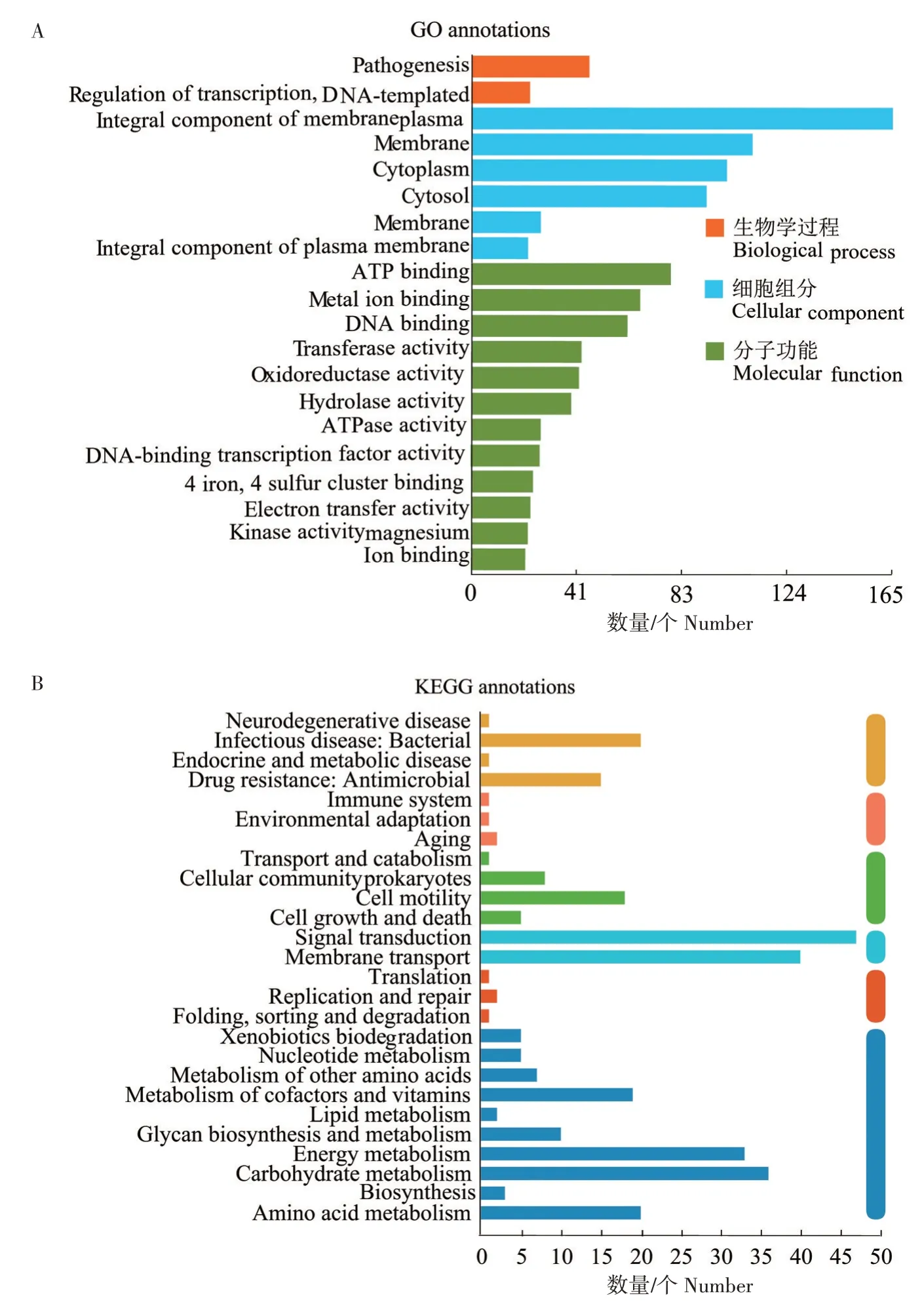
图3 沙门氏菌转录组的差异表达基因注释分析Fig.3 Annotation analysis of differentially expressed genes in Salmonella transcriptome
2.3.3 沙门氏菌转录组的差异基因富集分析 从图4A 中可明显看出,差异基因集中分布在Ⅲ型分泌系统的蛋白质分泌(Protein secretion by the type III secretion system,含13 个差异基因)、肽分泌(Peptide secretion,含24 个差异基因)、细胞分泌(Secretion by cell,含24个差异基因)、蛋白质定位到细胞外区域(Protein localization to extracellular region,含24个差异基因)。
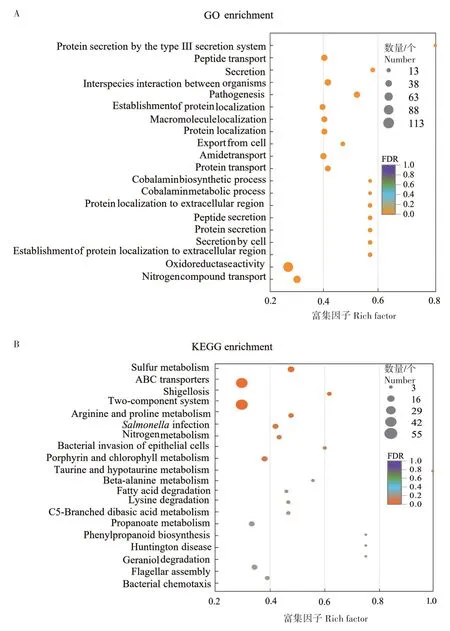
图4 沙门氏菌转录组的显著差异基因通路富集分析Fig.4 Enrichment analysis of significantly differential gene pathways in Salmonella transcriptome
在Ⅲ型分泌系统(Type Ⅲsecretion system,T3SS)通路中,表达量下调最显著的基因是steC(log2FC=-3.70)和ssaN(log2FC=-3.21),分别编码沙门 氏 菌 毒 力 岛-2(SPI-2)T3SS 效 应 激 酶SteC 和T3SS ATPase SctN 家 族 的SsaN(表3)。SPI-1 和SPI-2 编码的T3SS 注射装置,是一种针头形状的超分子结构,由PrgH、PrgI、PrgJ、PrgK、InvG 等蛋白质组成,负责将效应蛋白直接注入宿主细胞内[15]。前人研究表明,敲除SPI 基因或者编码效应蛋白的基因将会降低沙门氏菌的感染能力和侵袭宿主细胞的 能 力[16]。prgK(log2FC=-1.80)、prgH(log2FC=-1.83)、prgI(log2FC=-1.98)、prgJ(log2FC=-1.78)基因表达量都有不同程度显著下调。

表3 沙门氏菌转录组的差异显著基因及功能Tab.3 Significantly different genes and functions in S.enterica transcriptome
在某一特定的生物学功能中,基因通过彼此间的相互作用来发挥作用,基于KEGG 通路的分析可以更加深入了解沙门氏菌中基因的生物学功能。图4B是KEGG 富集分析的气泡图,图中标注富集的主要通路。从图4B可以看出,差异基因显著富集到双组分系统(Two component system,表达量上调基因9 个,表达量下调基因42 个)、鞭毛组装(Flagellar assembly,表达量下调基因13 个)、细菌侵入上皮细胞(Bacterial invasion of epithelial cells,表达量下调基因6个)、沙门氏菌感染(Salmonellainfection,表达量下调基因13个)4个通路。
在双组分系统通路中,表达量上调最显著的基因是gltJ(log2FC=2.14)和degP(log2FC=1.98),分别编码谷氨酸/天冬氨酸ABC 转运蛋白渗透酶GltJ 和丝氨酸内蛋白酶DegP;表达量下调最显著的基因是citX(log2FC=-4.74)和hybO(log2FC=-3.52),分别编码柠檬酸裂解酶和氢化酶。pagC是沙门氏菌PhoPQ 双组分重要组成基因,pagC表达量下调(log2FC 为-1.21)影响沙门氏菌囊泡形成,并且影响沙门氏菌在不利条件下存活。AOS 组的ttrB和ttrC表达量相对对照组显著下降(log2FC 为-2.70 和-1.70),将影响沙门氏菌的厌氧呼吸。ttrB和ttrC编码四硫酸还原酶结构基因,对沙门氏菌适应不同的厌氧环境至关重要,并且这2 个基因位于SPI-2,表达量下调也会影响沙门氏菌毒力。NarQ/P 是调控硝酸盐和亚硝酸盐相关基因表达的双组分系统,为沙门氏菌在肠道中的定植提供竞争优势。AOS 经肠道菌群发酵后,肠道菌群中的沙门氏菌narQ基因表达量受到明显抑制(log2FC=-1.46)。NarQ/P 双组分调节系统中的frdC(编码富马酸还原酶)表达量也降低(log2FC=-1.26)。CheA/B 调节细菌的趋化性,沙门氏菌暴露于AOS 干预后的肠道环境中时,cheY、cheW、cheA下调(log2FC 分别为-1.07、-1.51、-1.22),趋化性代谢活动减弱。
在鞭毛组装通路中,表达量下调最显著的基因是flgB(log2FC=-4.25),编码鞭毛基体杆蛋白FlgB。fliI、fliF、fliK、fliD、fliS、flhA、flgB、fliH影响鞭毛合成[17]。鞭毛马达flim基因(log2FC 为-1.54)表达量下降,进一步抑制鞭毛动力相关的motA(log2FC 为-1.14)和motB(log2FC 为-1.33)表达量。这表明在不利环境条件下,沙门氏菌的鞭毛聚集代谢活动减弱,以维持菌体生存所必需的代谢活动[18]。
在沙门氏菌感染通路中,sipA、sipC、sopE基因表达量下调,log2FC 分别为-1.94、-1.92、-2.40。hilA、hilC、hilD、invF等基因调节SPI-1 效应蛋白的表达量。长链脂肪酸会抑制HilD 结合DNA 的能力,当沙门氏菌进入回肠末端,长链脂肪酸浓度降低,沙门氏菌的毒性将会升高[19]。hilA和hilD是重要的调控子,在AOS 组中,其表达量下调(log2FC 为-1.48、-1.25)。
2.4 实时荧光定量PCR验证沙门氏菌基因表达量
为验证RNA-seq 分析的结果(图5A),以16S rRNA 基因作为内参基因,采用实时荧光定量PCR法测定参与鞭毛组装(flhA)、侵染(sopD2、sopA、invH、sipD)、关键毒力基因(potD)表达量情况。与对照组相比,在肠道环境中,AOS 下调flhA、sopD2、sopA、invH、sipD、potD的表达量(P<0.01),log2FC 分别 为-9.43、-3.57、-6.15、-9.09、-6.89、-9.88(图5B)。与RNA-seq 趋势一致(图5A)。以上结果表明,AOS 抑制沙门氏菌毒性相关的多个关键基因和多条通路。
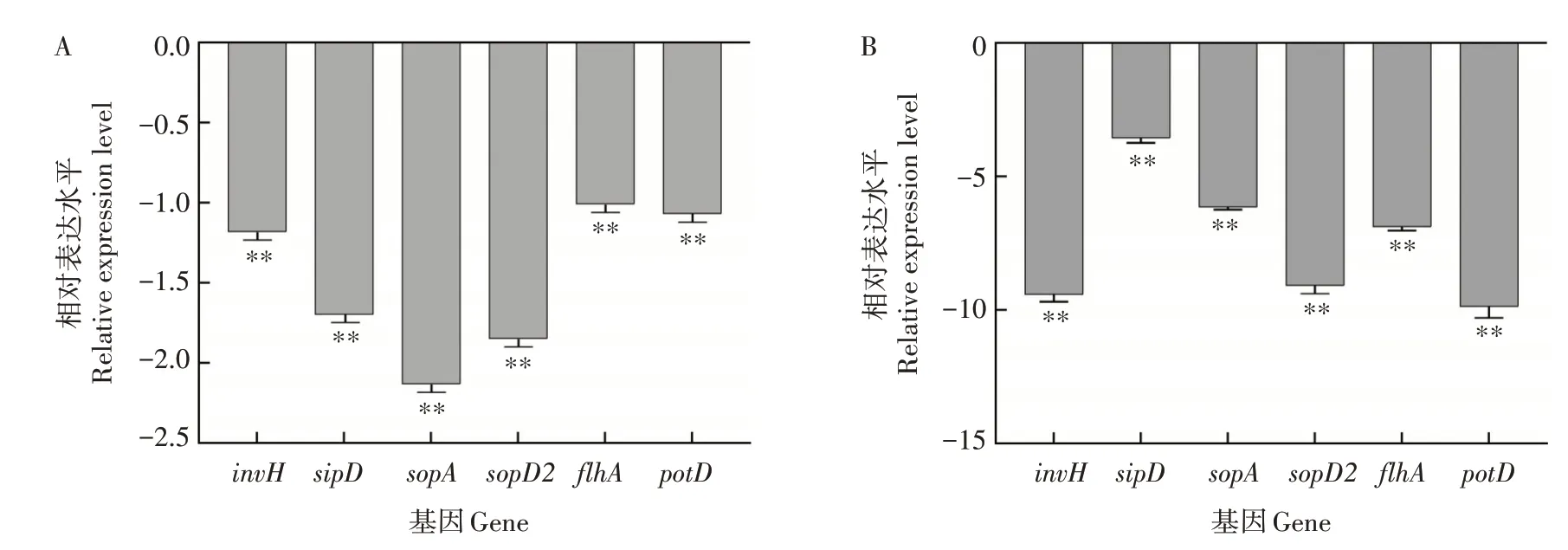
图5 沙门氏菌差异表达基因的RNA-seq分析(A)及实时荧光定量PCR验证(B)Fig.5 RNA-seq(A)and quantitative real-time PCR(B)analysis of the differential expressed genes of S.enterica
3 结论与讨论
在家禽养殖行业中,益生元是良好的抗生素替代品,其中AOS 的抑菌活性研究受到关注。HU等[20]研究表明,酶解制备的AOS 能抑制大肠杆菌、副伤寒沙门氏菌、金黄色葡萄球菌、枯草芽孢杆菌,最小抑菌浓度分别为0.312、0.225、0.016、0.325 μg/mL。由10 ~15 个G 聚合而成的OligoG 能破坏生物膜的形成,提高抗生素对假单胞菌属、不动杆菌属、伯克霍尔德氏菌属的治疗疗效,并且OligoG诱导铜绿假单胞菌中lasI-lasR和rhlI-rhlR群体感应系统的修饰,这可能会影响关键的下游功能,如毒力因子的产生和生物膜的形成[21]。LU 等[22]研究表明,AOS 的抗菌活性与单体的组成密切相关,单体M 发挥直接抗菌作用,单体G 主要抑制或破坏病原体的生物膜。在AOS 作为膳食补充剂的研究中,HAN 等[23]酶解获得的AOS 在体外试验中,经24 h 粪便菌群发酵,AOS 能够降低猪粪便中的大肠杆菌和志贺氏菌等条件致病菌的丰度,显著增加丁酸和戊酸的丰度。AOS 饲喂小鼠后,肠道菌群中双歧杆菌和乳酸杆菌的丰度升高,肠球菌和肠杆菌的丰度降低。然而,AOS 在肠道中调节致病菌的机制研究较少。本研究通过酶解海藻酸钠得到分子质量为1.93 ku、M与G比例为0.37的AOS,经模拟胃液和模拟肠液消化后,AOS 的还原糖含量和分子质量都未发生明显变化。将AOS 与鸡肠道菌群共培养,沙门氏菌的菌落总数较对照组减少,相对丰度从4.6%降到1.1%。
结合DEG 的KEGG、GO 富集与注释结果,分别从双组分调节、鞭毛组装、侵染途径3个方面分析在肠道环境中AOS 干预对沙门氏菌致病性和毒力抑制相关机制。双组分系统由一种感受外部刺激的膜蛋白和一种调节特定靶基因表达的细胞质调节蛋白组成,能感知环境刺激并调节特定基因的表达量以适应和启动感染过程[24]。沙门氏菌的鞭毛负责在肠上皮细胞附近定植肠腔[25]。沙门氏菌的SPI-1和SPI-2负责主要的毒力基因表达、分泌、转运效应蛋 白[26]。SPI-1 分 泌 效 应 蛋 白SipA、SipC、SopB/SigD、SopE、SopE 等,参与上皮细胞侵袭,重塑细胞骨架,有利于在细胞内的长期存活[27-29]。本研究对沙门氏菌进行转录组分析后发现,沙门氏菌鞭毛组装(flim、motA、motB等基因)、双组分系统(PhoPQ、NarQ/P、CheA/B)、侵染(sipA、sipC、sopE等基因)的基因表达量均受到抑制,这表明AOS 作为饲料添加剂,能在沙门氏菌进入鸡肠道后,调节沙门氏菌基因表达量,抑制沙门氏菌在肠道中的黏附、定植、侵染能力,降低沙门氏菌对宿主的致病力。
本研究结果表明,AOS 具有抑制沙门氏菌在动物肠道环境中生长和致病的作用,作为新型的饲料添加剂,能够促进家禽健康,具有替抗潜力。

