金黄色葡萄球菌小菌落突变体诱导筛选及特性研究
周宇, 李佳玉, 王乐, 贾晓爽, 高思琦, 王潇, 焦健*
(1.北京城市学院生物医药学部,北京 100094; 2.宁波大学医学院,浙江 宁波 315211)
金黄色葡萄球菌(Staphylococcus aureus)是一种常见的人类致病菌,约30%的人群是无症状携带者,60%是间歇性携带者[1]。作为一种重要的人畜致病菌,S. aureus在畜牧业中以引发奶牛乳房炎为主,其比例高达50%以上,产奶量下降20%左右,且治愈率较低,给养殖业造成巨大的经济损失[2]。目前,主要依靠抗生素进行针对性治疗,但在治疗过程中,存活下来的S. aureus会通过代谢途径的改变,形成较难清除的小菌落突变体(small colony variants, SCVs),导致细菌耐药性愈发严重[3]。
SCVs在临床S. aureus感染中发生率约为1%~30%[4],可诱发人类腹膜炎[5]和假体周围关节感染[6],甚至会引起血液、骨骼、人工关节、大脑、皮肤、起搏器和囊性纤维化肺感染[7]。SCVs在奶牛乳腺上皮细胞中可持续存在,诱发慢性牛乳房炎疾病,导致久病不愈[8]。目前,通常选择利福平与1种或多种敏感的抗生素联合用药治疗SCVs感染[9],极大程度上加重了耐药性菌株的出现,给医疗保健系统及畜牧业带来巨大的负担。此外,SCVs具有独特的表型特征和致病特性,如生长缓慢、毒力因子表达量降低、黏附因子表达量提高、类胡萝卜素色素流失、溶血活性降低和凝固酶活性降低等[10-11],同时形成生物膜的能力、免疫耐受能力[5]及抗生素耐受能力[12]均增强,进而使其在细胞内存活,诱发持续性、复发性感染[13-14]。因此,对于防控此类疾病蔓延、开展SCVs致病机理研究及新型抗SCVs药物研发工作,稳定型SCVs的获得显得至关重要。
目前,获得SCVs常用的方法有低水平抗菌剂诱导法、基因敲除法以及分离鉴定法。低水平抗菌剂诱导筛选法是利用S. aureus最小抑菌浓度(minimum inhibitory concentration, MIC, µg·mL-1)筛选具有SCVs特定性状的突变体,如在培养基中添加2×MIC庆大霉素[3]、三氯生[15]、莫西沙星、克林霉素以及利福平等抗菌类药物对金黄色葡萄球菌进行孵育,可筛选得到SCVs[16]。研究表明,利用低水平抗菌剂诱导技术,约5%~10%的菌体可转化为SCVs,诱导筛选得到的SCVs稳定性较高,不易恢复野生表型,并产生耐药性[16]。研究者在利用基因敲除手段获得SCVs相关研究中,发现SCVs的形成与Agr及SigB调控系统中相关基因表达调控有关[4,17-21]。对影响上述调控系统的agr基因敲除,可获得稳定的SCVs菌株[22],为利用敲除或过表达手段对参与SCVs形成的相关基因编辑,获得稳定型SCVs提供更多思路。除此之外,利用选择分离鉴定方法,在奶牛乳房炎的病变组织中分离鉴定并获得SCVs,在SCVs感染患者的血液、尿液、痰、脓液、耳朵分泌物等样本中也分离得到SCVs,并对其进行测序鉴定[23]。
目前,对S. aureus的SCVs获得方法的研究较少,由于低水平抗生素诱导法获得SCVs的方法较简单,且部分抗生素不仅对金黄色葡萄球菌杀伤能力有限,还能够促进SCVs的形成[24-25],同时利用低水平抗生素筛选SCVs方法已有报道,为本研究提供了坚实的理论基础,但其筛选得到的SCVs不稳定[3]。因此,本试验将选择利用低质量浓度(1.25~5.00 µg·mL-1)庆大霉素二次诱导野生型S. aureusATCC 43300,旨在获得更稳定的SCVs,并对筛选得到的SCVs菌株进行形态学观察和稳定性及部分特性研究,为探究高效、安全、低耐药、新型针对SCVs药物提供稳定的受试菌株。
1 材料与方法
1.1 试验材料
本研究中使用的菌株为S. aureusATCC43300。
TSA与TSB培养基(青岛高科技工业园海博生物技术有限公司)用于S. aureusATCC43300和SCVs生长的基本培养基,121 ℃灭菌20 min。
试验所用抗生素为庆大霉素(西典化学科技有限公司),用于对S. aureusATCC43300的诱导及SCVs培养。
1.2 试验方法
1.2.1 低质量浓度庆大霉素诱导获得SCVs方法 参照文献[26]的方法,对S.aureusATCC43300的最小抑菌浓度(MIC)进行测定。首先,挑取S. aureusATCC43300单菌落过夜活化培养,1%转接于TSB培养基中,37 ℃培养4 h至对数生长期,用TSB培养基将其稀释至1×105CFU·mL-1,加入90 µL稀释后的菌液于96孔无菌细胞培养板内。然后,利用二倍梯度稀释法将庆大霉素梯度稀释至不同质量浓度(1 mg·mL-1和500.000、250.000、125.000、62.500、31.250、15.625 µg·mL-1),取10 µL不同质量浓度的庆大霉素分别加入上述96孔培养板,置于37 ℃恒温培养箱静置培养12 h,测定庆大霉素对S. aureusATCC43300的MIC。阴性对照组(PBS)和空白对照组(ddH2O)做相同处理,每组3个重复。同时从上述有抑菌效果的孔中取10 µL培养物涂布于TSA平板上,进一步测定S. aureusATCC43300的最小杀菌浓度(minimum bactericidal concentration,MBC,µg·mL-1)。
本试验选用低质量浓度(1.25~5.00 µg·mL-1)庆大霉素二次诱导法获得SCVs。将活化后的S. aureusATCC43300菌液1%转接于含1/2×MIC庆大霉素的TSB培养基中,37 ℃、250 r·min-1振荡培养6 h,取1 mL菌液置于1.5 mL的离心管中,4000 r·min-1离心5 min,弃上清,用 0.3 mLTSB重悬并梯度稀释涂布于TSA培养基中,培养24~48 h。挑取8个较小的单菌落转接于2×MIC庆大霉素(5 µg·mL-1) TSB培养基中,37 ℃、250 r·min-1诱导培养12 h,10倍梯度稀释并涂布于TSA平板上,置于37 ℃恒温培养箱中培养24 h,同时将S. aureusATCC43300接种于TSB培养基中作为对照。选取3个SCVs菌株于甘油管中保存菌株。测定庆大霉素对野生型及SCVs的MIC及MBC,方法同上。
1.2.2 SCVs表型分析及生长曲线测定方法 划
线点板及生长曲线测定方法参考文献[27],将酵母培养的方法替换为S. aureusATCC43300及SCVs培养方法,且生长曲线采样时间稍作变化。具体方法如下:利用划线培养法和稀释点板法观察SCVs表型。划线培养法将S. aureusATCC43300和SCVs分别在TSA平板及含5 µg·mL-1庆大霉素的TSA平板上划线培养48 h,观察菌落生长情况。稀释点板法将S. aureusATCC43300和SCVs过夜活化培养后分别10倍梯度稀释至108、109和106、107。将上述稀释后的菌液分别取5 µL于TSA培养基进行点板。37 ℃培养48 h,观察菌落生长情况。为研究SCVs与野生型菌株生长的快慢,对其生长曲线进行测定。分别将S. aureusATCC43300和SCVs菌液,1%转接至50 mL的TSB培养基中,其中SCVs的TSB培养基中加入5 µg·mL-1庆大霉素,每组3个重复。每隔1 h取样,在紫外分光光度计OD600处测量其光密度值,并绘制生长曲线。
1.2.3 结晶紫染色法验证SCVs形成生物膜的能力 结晶紫染色法测定生物膜的方法参照文献[28]。将培养至对数期的S. aureusATCC43300和SCVs用TSB稀释至OD600为3,每孔200 µL接种于96孔板中,6个重复,并以TSB培养基为空白对照,37 ℃培养24 h。将每孔的上清液用移液枪小心吸弃,PBS溶液将剩余菌液清洗3次,自然晾干后向每孔中加入100 µL的2.5%戊二醛固定,90 min后吸弃固定液,PBS清洗2次。再向每孔加入100 µL的0.1%结晶紫溶液染色15 min,用蒸馏水冲洗掉多余染液,置于室温干燥。最后向每孔中加入200 µL的95%乙醇溶解30 min,用酶标仪在OD570处测量吸光值。通过结晶紫染色法进行鉴定,阴性对照的平均OD600定义为ODc,待测菌株OD与ODc比较,将菌株生物膜形成能力分为4类:阴性(-),OD<ODc;少量(1+),ODc<OD≤2 ODc;中量(2+),2 ODc<OD≤4 ODc;大量(3+),OD>4 ODc。
1.2.4 恢复突变率测定方法 首先,挑取活化后的SCVs单菌落分别置于TSB培养基和含5 µg·mL-1庆大霉素的TSB培养基中,37 ℃过夜培养,取菌液稀释涂布于不含有庆大霉素的TSA平板中37 ℃过夜培养。观察并记录大小菌落个数,计算SCVs的恢复突变率[3]。然后,将第1代的SCVs经20次传代后,置于含5 µg·mL-1庆大霉素的TSB培养基中,37 ℃过夜培养。培养后,取菌液稀释涂布于不含庆大霉素的TSA平板中37 ℃过夜培养。观察并记录大小菌落个数,计算SCVs经20次传代培养后的恢复突变率。
1.2.5 药敏试验 为探究SCVs对其他广谱类抗菌药物的敏感性,对SCVs及野生型S. aureusATCC43300菌株进行药物敏感性测定[29]。将活化后的野生型S. aureusATCC43300菌液与液体状态下的TSA培养基混合,并将活化后的SCVs菌液与含有5 µg·mL-1庆大霉素的液体状态的TSA培养基混合,均进行倒平板,待凝固后分别将青霉素、氨苄西林、头孢曲松、四环素、红霉素、林可霉素、复方新诺明、氯霉素8种药物的药敏片按顺序贴在含有野生型S. aureusATCC43300及SCVs的TSA平板上。37 ℃过夜培养,观察并记录透明圈大小。
1.2.6 凝血试验 为观察其凝血快慢,分别取100 µL活化后的SCVs与野生型S. aureusATCC43300菌液于1.5 mL离心管中,向菌液中加入400 µL含柠檬酸钠(3.2%)的人血,吹吸混匀后置于37 ℃培养箱中孵育,前4 h每30 min观察1次,然后每隔2 h观察1次,观察并记录凝块时间[30]。
1.2.7 胁迫试验 为验证SCVs在极端情况下的存活率,分别对SCVs和S. aureusATCC43300进行高渗透压胁迫分析试验[31]。将S. aureusATCC43300与SCVs分别培养至对数期,分装为500 µL·支-1,各分装4支离心管,3000 r·min-1离心5 min,弃上清,将沉淀分别重悬于500 µL无菌25%、30%、35%及对照0.9%的NaCl溶液中,室温静置1 h,3000 r·min-1离心5 min,弃上清,并用500 µL无菌0.9% NaCl溶液重悬,进行梯度稀释涂平板,37 ℃过夜培养,对菌落进行计数。将上述计算得到的菌落数按照如下公式计算S. aureusATCC43300与SCVs的存活率。
1.2.8 SCVs相关特性基因表达 挑取活化后的S. aureusATCC43300和SCVs单菌落于TSB及含5 µg·mL-1庆大霉素的TSB培养基中过夜培养,1%转接培养至对数期,并稀释到1×108CFU·mL-1,按RNAprep Pure细菌总RNA提取试剂盒(DP430)说明书提取RNA,再将RNA反转录成cDNA作为荧光定量PCR的模板,按ChamQ Universal SYBR qPCR Master Mix试剂盒说明书进行操作。以S. aureusATCC43300为对照与SCVs中Agr及SigB调控系统和毒力基因及生物膜相关基因表达情况进行对比分析。引物如表1所示。

表1 Agr及SigB调控系统中相关基因的扩增引物[32-37]Table 1 Amplification primers of Agr and SigB regulatory system genes[32-37]
2 结果与分析
2.1 低质量浓度庆大霉素诱导获得SCVs分析
利用低质量浓度抗生素诱导法获得SCVs,首先对S. aureusATCC43300的MIC进行测定,由表2所示,庆大霉素对S. aureusATCC43300的MIC为2.5 µg·mL-1。

表2 MIC和MBC的测定Table 2 Determination of MIC and MBC
然后,在含1/2×MIC庆大霉素TSB培养基中对S. aureusATCC43300进行诱导,筛选得到SCVs。在TSA平板上,未诱导的对照组菌落大小均匀、大而突起、不透明、圆形、表面光滑,与对照组相比,经1/2×MIC庆大霉素诱导的S. aureusATCC43300,菌落生长大小不均匀,出现明显较小的菌落(图1A)。选取8个较小的单菌落,转接至含2×MIC庆大霉素TSB培养基再次诱导培养并涂布于TSA平板。与未诱导的S. aureusATCC43300相比,筛选到表型均一、较小且生长缓慢的SCVs(图1B),且庆大霉素对SCVs的MIC及MBC均是野生型的5倍(表2)。

图1 低质量浓度庆大霉素对SCVs的筛选Fig. 1 Screening of SCVs with gentamicin at low mass concentration
2.2 SCVs表型及生长曲线测定分析
为进一步验证SCVs表型的稳定性,通过划线法和点板法在TSA和含5 µg·mL-1庆大霉素的TSA平板上观察SCVs与S. aureusATCC43300的生长情况(图2),在TSA平板上,S. aureusATCC43300与SCVs均生长,而在含5 µg·mL-1庆大霉素的TSA平板上,S. aureusATCC43300不生长,SCVs可以正常生长,且SCVs与S. aureusATCC43300相比菌落较小、细胞数较少,与图1结果一致。

图2 SCVs表型的鉴定Fig. 2 Identification of SCVs phenotypes
由于SCVs菌体比S. aureusATCC43300小,为进一步验证SCVs生长情况,对其生长曲线进行测定。由图3可知,SCVs生长速度较慢,需培养至7 h后才可达到对数生长期,菌落数可达5×108CFU·mL-1,与S. aureusATCC43300培养至对数期时菌落数一致。

图3 SCVs生长曲线的测定Fig. 3 Determination of SCVs growth curve
2.3 结晶紫染色法验证SCVs形成生物膜的能力分析
利用结晶紫染色对SCVs和S. aureusATCC43300进行产生物膜能力测定,结果如表3所示,SCVs产生物膜能力较强,在波长570 nm处其产生物膜能力是S. aureusATCC43300的2倍以上。

表3 结晶紫法鉴定形成生物膜能力Table 3 Identification of biofilm forming ability of crystal violet staining
2.4 SCVs恢复突变率分析
为进一步验证SCVs的稳定性,对SCVs恢复突变率进行统计。将SCVs在含5 µg·mL-1庆大霉素的TSB培养基中过夜培养转接至TSA平板培养,其恢复突变率为0%;而SCVs在无抗性的TSB培养基中培养后转接至TSA平板上过夜培养,菌株发生了恢复突变,其恢复突变率为30%。经过20次传代后,SCVs在无抗性的TSB培养基中培养后转接至TSA平板过夜培养,其恢复突变率为0%。
2.5 药敏试验分析
培养12 h后,SCVs抑菌圈不明显,但仍可测量出此时抑菌圈大小,野生型S. aureusATCC43300抑菌圈清晰可见。培养24 h后,SCVs与野生型S. aureusATCC43300抑菌圈均清晰可见,且经测量发现SCVs抑菌圈直径与12 h时相同。SCVs及野生型S. aureusATCC43300药敏试验结果(表4)显示,SCVs对红霉素不敏感,对头孢曲松轻微敏感。

表4 小菌落突变体与野生型S. aureus ATCC43300药敏试验Table 4 SCVs and S. aureus ATCC43300 drug susceptibility test
2.6 凝血试验分析
在3.2%柠檬酸钠抗凝的血浆样品中,野生型S. aureusATCC43300形成凝块的时间是SCVs的5.5倍,其中,S. aureusATCC43300和SCVs形成凝块的时间分别为4和22 h。
2.7 胁迫试验分析
SCVs和野生型S. aureusATCC43300在高渗透压胁迫下的存活率如表5所示,在25% NaCl溶液胁迫下,S. aureusATCC43300和SCVs的存活率分别为58%和57%;30% NaCl溶液胁迫下,S. aureusATCC43300和SCVs的存活率分别为11%和38%;35% NaCl溶液胁迫下,S. aureusATCC43300和SCVs的存活率分别为10%和31%。盐胁迫试验表明,随NaCl含量的升高,S. aureusATCC43300与SCVs存活率均降低,但在30%和35%的NaCl溶液中SCVs的存活率明显高于S. aureusATCC43300。

表5 高渗透压下野生型S. aureus ATCC43300与SCVs的存活率Table 5 Survival rate of S. aureus ATCC43300 and SCVs under high osmotic pressure(%)
2.8 SCVs相关特性基因表达分析
利用荧光定量PCR方法,对SCVs及野生型S. aureusATCC43300菌株中Agr及SigB调控系统和毒力基因及生物膜相关基因表达情况进行分析。结果表明,在形成SCVs后,Agr调控系统中相关基因呈下调趋势(图4A),其中agrA、agrC、RNAIII转录水平分别下调至野生型S. aureusATCC43300的39%、27%和26%,agrB和agrD转录水平分别下调至0.04%和0.02%;而SigB调控系统中相关基因(sigB、rsbV、rsbU、rsbW)上调0.6~1.2倍(图4B);图4C结果显示,除sarA外,形成生物膜基因呈上调趋势,其中clfA表达量上调27.7倍,sarA下调至39%,relQ、relP、rsh、luxS、ccp、icaD、eno基因表达量是野生型菌株的1.0~5.4倍,上述结果表明所筛选的SCVs为胸苷突变体;同时,SCVs毒力水平下降(图4D),其中,毒力基因spa下调至0.4%,pvl及hla表达量分别下调至35.0%和2.8%。
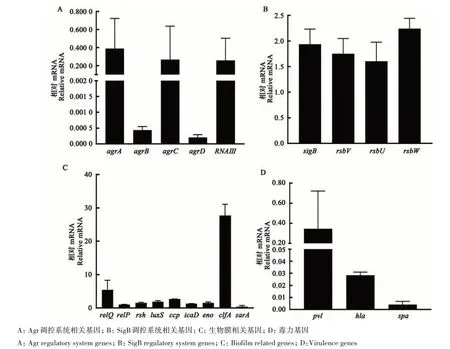
图4 SCVs特性基因相对表达Fig. 4 Relative expression of characteristic genes in SCVs
3 讨论
S.aureus是引起医疗和畜牧业获得性感染的主要致病菌之一,在营养缺失、活性氧、低pH及抗菌药物作用等应激环境下可形成SCVs[38]。通常,抗生素可有效杀死SCVs,但持续用药会降低膜电位,从而限制氨基糖苷(如庆大霉素)的摄取,诱发慢性、持续性和复发性感染,并加重细菌耐药性,为根治此类疾病带来困难[39-40]。现有的筛选方法具有筛选时间长、表型不稳定、恢复突变率高、基因敲除困难等弊端,给SCVs致病机制的研究及抗SCVs药物的研发带来难题。因此,稳定型SCVs方法的建立,为探究高效、安全、低耐药、新型针对金黄色葡萄球菌SCVs药物提供稳定的生物学材料。
SCVs的形成均受Agr及SigB调控途径影响[38],Agr及SigB调控系统分别在SCVs定植阶段、入侵阶段及应激反应中发挥重要作用,同时提高其黏附及产生物膜能力,降低毒力基因表达,保持其定植状态,形成稳定型SCVs。本试验利用荧光定量PCR方法证实,SCVs中agrA和agrC转录水平分别下调至野生型S. aureusATCC43300的39%和27%,agrB和agrD转录水平分别下调至0.04%和0.02%,Agr调控系统相关基因呈下调趋势致使下游RNAIII表达量下降至26%,达到其稳定定植的目的。而SigB作为革兰氏阳性菌的主要压力应答因子,在应激状态下感知环境变化,调节菌体基因表达,抑制毒力基因表达,诱发表型转换,形成SCVs[18-20]。本试验结果再次验证,SigB调控系统中相关基因(sigB、rsbV、rsbU、rsbW)上调(0.6~1.2倍),可有效下调免疫原性毒力因子,抑制毒力基因spa、pvl及hla的表达。同时,产生物膜能力的提高对SCVs复发性感染密切相关,通过上调ica相关因子可增加产膜能力,与本结果一致[41]。因此,利用低水平庆大霉素诱导法筛选得到的SCVs,具有菌落较小、生长缓慢、产生物膜能力增强、毒力因子下调、Agr调控系统相关因子下调、SigB调控系统中基因上调、除sarA外形成生物膜基因呈上调趋势、表型稳定的特性,上述结果与已有结果一致[42-43]。
同时,由sarA下调推测所筛选的SCVs为胸苷突变体[25],或仅通过调控途径降低致病菌毒力,使其达到长期定植的目的。S. aureus对庆大霉素的摄取取决于膜电位,当电子传递链中的电子流受损时,膜电位会大大降低,限制了质子在细胞膜上梯度的建立,这不仅导致氨基糖苷类物质的摄取减少,还出现无法利用大多数糖类和乳酸的现象,最终导致菌体生长变慢,出现小菌落,逃避宿主免疫反应[44]。然而,在缺乏抗生素选择压力的情况下,SCVs表型可能存在不稳定的现象,伴随氨基糖苷类耐药性的丧失,进而恢复到野生型菌落表型[1]。Martin等[3]利用低水平庆大霉素诱导技术获得点突变的SCVs,在非抗生素压力条件下其恢复突变率高达80%,其中,15个SCVs中有12个菌株可恢复至野生型表型,其余未恢复突变的3个菌株均为片段缺失的菌株。为解决恢复突变率高的问题,本研究采用二次诱导法获得SCVs,经1/2×MIC及2×MIC庆大霉素分别诱导6和12 h,可获得SCVs,在5 µg·mL-1庆大霉素培养条件下可维持稳定的表型,其恢复突变率为0%,然而在非抗生素压力条件下,有30%的恢复突变率。为进一步提升其稳定性,降低恢复突变率,在5 µg·mL-1庆大霉素培养条件下连续传代20次,在非抗生素压力条件下,其恢复突变率为0%。为了维持其稳定性,后续药敏、凝血、胁迫及荧光定量PCR试验仍加入庆大霉素维持其稳定表型。基于以上结果,推测所筛选的SCVs为胸苷突变体,并受Agr及SigB调控系统中相关调控途径影响。后续将进一步验证,同时增加恢复突变的筛选数量,得到片段缺失的无需抗生素环境培养的更为稳定的SCVs。
目前,除利用低浓度抗诱导法获得SCVs外,常用的SCVs获得方法还有基因敲除技术和分离筛选鉴定技术。利用敲除法获得的SCVs表型稳定,不产生恢复突变的SCVs,并可进一步探究其致病机制[22,45]。但与基因敲除法相比,利用低水平庆大霉素诱导技术获得的SCVs虽然在非抗生素压力条件下存在不稳定的现象,但低剂量添加抗生素维持其稳定表型对新药研发影响极小。此外,从首次诱导到成功筛选稳定型SCVs仅需3 d,而利用基因敲除手段获得SCVs用时较长,且成功率较低,存在风险。另外,与临床样本中分离鉴定法相比,低浓度抗诱导法较为安全,且具有操作简单、无需采集病理样本及16S rRNA测序诊断等优点[23,46]。因此,本研究利用低水平庆大霉素二次诱导方法获得SCVs,具有操作简单,耗时较短,表型稳定,特性明确等优点,为SCVs获得提供新方法,同时为新型药物在持续性、复发性SCVs感染防治研究中提供稳定的生物学材料。

