低氧胁迫对近江牡蛎生理能量的影响
李昂 石雯静 赵晟

摘要 [目的]探究低氧胁迫对近江牡蛎生理能量的影响。[方法]设置了0.5、1.0、2.0、3.0和5.0 mg/L(CK)共5个溶解氧梯度,研究低氧适应和低氧突变2种低氧胁迫方式对近江牡蛎存活率、滤水率、耗氧率、排氨率以及氧氮比的影响。[结果]低氧适应组的生理代谢水平显著高于低氧突变组(P<0.05),其中,当溶解氧浓度为0.5 mg/L时,低氧突变组和低氧适应组的滤水率最低,分别为1.47 和3.57 L/(g·h)。溶解氧浓度越低,近江牡蛎生理能量水平越差,存活率也越低,当溶解氧水平在2.0 mg/L以上时,低氧胁迫7 d后,近江牡蛎的存活率保持在90%以上。[结论]相对于突变的低氧环境,近江牡蛎对低氧适应一段时间后,具有一定耐受性,能够在低氧环境下进行生理活动。
关键词 低氧胁迫;溶解氧;近江牡蛎;生理能量
中图分类号 S 96 文献标识码 A
文章编号 0517-6611(2023)12-0074-04
doi:10.3969/j.issn.0517-6611.2023.12.016
Effects of Hypoxia Stress on Physiological Energy of Crassostera ariakensis
LI Ang,SHI Wen-jing,ZHAO Sheng
(Dept.of National Engineering Research Center of Marine Facility Aquaculture of Zhejiang Ocean University,Zhoushan,Zhejiang 316000)
Abstract [Objective]In order to explore the effects of hypoxia stress on the physiological energy of Crassostrea ariakensis.[Method]Five dissolved oxygen gradients of 0.5,1.0,2.0,3.0 and 5.0 mg/L (control group) were set in this experiment.The effects of hypoxia adaptation and hypoxia burst on the survival rate,water filtration rate,oxygen consumption rate,ammonia excretion rate and oxygen nitrogen ratio of Crassostrea ariakensis were measured and analyzed.[Result]In the experiment,the physiological metabolic level of hypoxia adaptation group was significantly higher than that of hypoxia mutation group (P<0.05).When dissolved oxygen was 0.5 mg/L,the water filtration rate of hypoxia mutation group was the lowest,which were 1.47 and 3.57 L/(g·h) respectively.The lower the concentration of dissolved oxygen,the worse the physiological energy level and the lower the survival rate of Crassostrea ariakensis.In addition,when the level of dissolved oxygen was above 2.0 mg/L,the survival rate of Crassostrea ariakensis remained above 90% after 7 days of hypoxia stress.[Conclusion]The results showed that compared with the mutated hypoxic environment,Crassostrea ariakensis could have a certain tolerance to hypoxia and carry out physiological activities in the hypoxic environment.
Key words Hypoxia stress;Dissolved oxygen;Crassostrea ariakensis;Physical energy
基金項目 科技部国家重点研发计划蓝色粮仓科技创新专项(2019YFD0901204)。
作者简介 李昂(1996—),女,山东菏泽人,硕士研究生,研究方向:生态足迹。*通信作者,教授,博士,硕士生导师,从事海洋生态、生态经济、环境管理与规划及可持续发展研究。
收稿日期 2022-12-11
近江牡蛎(Crassostrea ariakensis)俗称“赤耗”,广泛养殖于华南沿海地区,在该地区年产量超过130万t,其富含营养,肉质鲜美,是一种重要的水产经济动物[1-3]。近年来,随着近江牡蛎养殖密度的不断加大,区域缺氧情况时常发生,从而出现了大规模的死亡现象[4-5]。
溶解氧(DO)是影响水产动物生长代谢的重要环境因子[6]。随着全球气候变暖,海洋含氧量不断减少,近岸海域的低氧区数量不断增加,而近江牡蛎作为近海养殖生物,极易受到影响[7]。研究表明,水体缺氧不仅会影响水产动物的生长存活,还会影响其呼吸代谢[8]。笔者以低氧胁迫为条件,通过低氧适应和低氧突发2种方式来探究低氧胁迫对近江牡蛎生理能量的影响。
1 材料与方法
1.1 试验材料
近江牡蛎:取自广西北部湾近江牡蛎养殖区,挑选无损伤300个个体,用毛刷去除表面附着物。暂养于实验室300 L塑料桶中,持续充气,每天换水1/2,海水盐度29±1,水温 28 ℃,pH 8.0,溶解氧浓度大于5.0 mg/L,饵料用球等鞭金藻,投喂浓度为 3×105 cells/mL,3 d后开始试验。
1.2 试验方法
1.2.1 低氧适应。
参考 Baker等[9]的方法,低氧环境通过向水体中连续充氮气和氧气的方式实现。试验设置5个溶解氧质量浓度,分别为 0.5、1.0、2.0、3.0和5.0 mg/L共5个梯度,其中5.0 mg/L 为对照(CK)。试验在 5 L 塑料桶中进行,每个溶解氧浓度下设置 4 个重复和 1 个空白对照(不放置牡蛎,消除饵料自然沉降的影响), 每个重复 1 个牡蛎。当下降到目标溶解氧的浓度后, 在试验桶上紧贴水面覆盖一层塑料膜,隔绝水体与外界空气的气体交换。试验中用 YSI Professional Plus测定不同试验组溶解氧。
1.2.2 低氧突发。
按上述溶解氧的梯度设置,从采集后暂养3 d的牡蛎中随机挑选15个牡蛎,立即放置在溶解氧浓度为 0.5、1.0、2.0、3.0和5.0 mg/L的塑料桶中进行生理试验。
1.2.3 能量摄食。
低氧适应7 d后的牡蛎,每个溶解氧浓度处理挑选6个牡蛎,其中3个进行滤水率试验,即分别放在5个5 L塑料桶中,溶解氧浓度分别为0.5、1.0、2.0、3.0和5.0 mg/L,球等鞭金藻浓度为3×105 cells/mL,设置3个平行,试验时间为2 h,试验前后取50 mL水体,用血球计数板计算藻浓度。另外3个进行呼吸代谢试验,即分别放在5个5 L塑料桶中,浓度设置同上,无投喂,每桶放入1个牡蛎后,立即用封口膜盖住塑料桶,试验时间为3 h,试验前后测量溶解氧浓度,并取50 mL水体,检测氨氮浓度。
滤水率(Clearance rate,CR)由以下公式计算:
CR=V×ln[(C0-C0×Sd)/Ct]/(N×t) (1)
式中,CR表示滤水率,L/(g·h);V表示溶液的体积,L;C0和Ct分别表示试验开始时和t时间后的藻液浓度,cells/mL;N表示试验所用的牡蛎数量,g;t表示试验所用的时间,h;Sd表示对照组中饵料变化系数:Sd=(C0d/Ctd)=C0d,式中,C0d和Ctd分别为对照组试验开始和t时间后藻液的浓度,cells/mL。
耗氧率(Oxygen consumption,OR)与排氨率(Ammonia-Nexcretionrate,AER)分别按下式计算:
OCR=(DO0-DOt)×V/(W×t)(2)
AER=(N0-Nt)×V/(W×t)(3)
(2)、(3)式中,OCR、AER分别表示单位干质量的耗氧率[mg/(g·h)]和单位干质量的排氨率[mg/(g·h)];DO0、DOt分别表示试验开始时及t时间后水中的溶解氧含量,mg/L;N0、Nt表示试验开始时以及t时间后水中的氨氮浓度,mg/L;V表示呼吸瓶容积,L;W表示试验所用的贝软体部干重,g;t表示试验所用时间,h。
2 结果与分析
2.1 低氧胁迫对近江牡蛎滤水率的影响
近江牡蛎的滤水率对低氧胁迫的响应情况如图1所示。方差分析结果显示,溶解氧浓度对滤水率有显著影响(P<0.05)。溶解氧浓度0.5、1.0、2.0 和3.0 mg/L下,滤水率逐渐上升,但与CK相比有显著差异(P<0.05);除3.0 mg/L处理外,低氧适应组的滤水率显著高于低氧突变组。溶解氧浓度为0.5 mg/L时,两者滤水率最低,分别为1.47 和3.57 L/(g·h)。
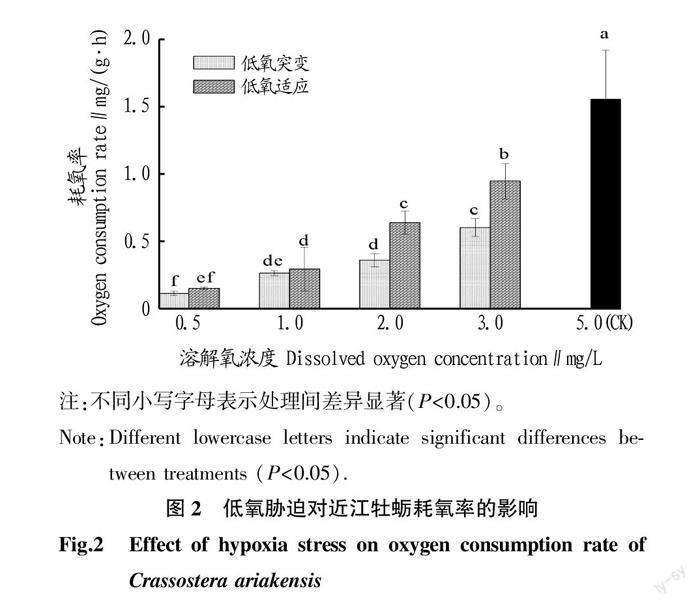
2.2 低氧胁迫对近江牡蛎耗氧率的影响
从图2可见,溶解氧浓度对耗氧率有显著影响(P<0.05),随着溶解氧浓度的降低,耗氧率逐渐下降,其中浓度为0.5 mg/L时,耗氧率最低,低氧突变组和低氧适应组分别为0.16 和0.21 mg/(g·h);当浓度为2.0、3.0 mg/L时,低氧突变组耗氧率显著低于低氧适应组(P<0.05)。
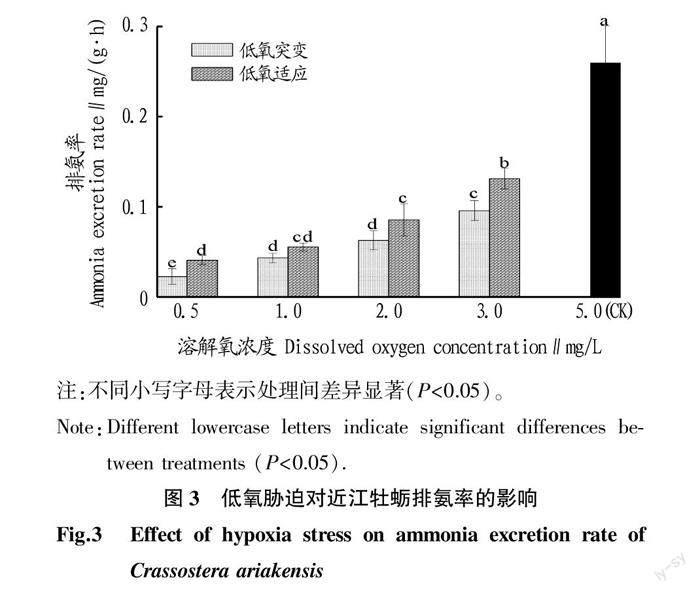
2.3 低氧胁迫对近江牡蛎排氨率的影响
从图3可见,溶解氧浓度对排氨率有显著影响(P<0.05),其表现趋势与耗氧率一致。其中,浓度为2.0、3.0 mg/L时,低氧突变组与低氧适应组间有显著差异(P<0.05),且低氧适应组排氨率较高。此外,随着溶解氧浓度的升高,其排氨率呈显著上升趋势,但显著低于CK(P<0.05)。
2.4 低氧胁迫对近江牡蛎O∶N的影响
从图4可见,溶解氧浓度对氧氮比有显著影响(P<0.05)。随着溶解氧浓度的升高,两者的氧氮比均呈显著上升趋势。除溶解氧浓度为0.5 和 3.0 mg/L外,低氧突变组与低氧适应组的氧氮比具有显著差异(P<0.05)。其中,溶解氧浓度为1.0 mg/L时,低氧突变组的氧氮比顯著高于低氧适应组(P<0.05),分别为7.1和5.2。而浓度为2.0 mg/L时,低氧突变组的氧氮比显著低于低氧适应组(P<0.05),分别为7.2和8.1。
2.5 低氧胁迫对近江牡蛎存活率的影响
从图5可见,随着胁迫时间的延长,近江牡蛎的存活率呈下降趋势,方差分析结果显示,溶解氧浓度和胁迫时间对存活率有显著影响(P<0.05)。从试验开始到7 d结束,CK的存活率一直稳定在100%;浓解氧浓度为2.0 和 3.0 mg/L试验组的存活率达到90%以上,分别为92.31%和96.15%。而溶解氧浓度为0.5 和 1.0 mg/L试验组,2~4 d存活率快速下降,在第4天时,浓解氧浓度为0.5 mg/L组的存活率为0,而溶解氧浓度为1.0 mg/L组在第6天时,全部死亡。近江牡蛎在溶解氧浓度为0.5、1.0、2.0、3.0和5.0 mg/L组7 d后的存活率分别为0、0、92.31%、96.15%和100%。
3 分析与讨论
3.1 低氧胁迫对近江牡蛎滤水率的影响
随着养殖规模和养殖密度的急剧上升,导致养殖环境日益恶化,造成水体富营养化及暂时性缺氧,目前,全球部分海区已经出现水层性缺氧,尤其是潮间带[10-12]。在养殖区,情况可能会变得更糟,因为培养的生物会产生大量有机沉积物,在分解过程中可能会消耗大量氧气。低氧对许多海洋生物来说是致命的,因为在严重的低氧条件下经常会导致大规模死亡,故溶解氧作为影响水生动物的生理活动重要的环境因子之一,对其摄食等方面都产生影响[13]。有关双壳贝类缺氧的影响大多集中于免疫方面。如Wang[14]等研究的翡翠贻贝(Perna viridis)在缺氧状态下血淋巴中的血细胞总数量(THC),发现低氧组THC低于溶氧组,且其吞噬活性显著低于溶氧组。Yu等[15]研究结果表明,缺氧会导致四角蛤喇(Mactra veneriformis)的THC水平降低。该试验主要研究低氧对近江牡蛎生理能量方面的影响,结果表明,低氧处理组的近江牡蛎单位干重滤水率显著低于对照组(P<0.05)。这与刘傲东等[16]
研究的缺氧因素会使马氏珠母贝(Pinctada martensi)的滤水率降低的结果一致。溶解氧为0.5 mg/L的条件下,近江牡蛎贝壳的开口接近于闭合,这种摄食行为也得到了滤水率降低的证明。试验中低氧适应组的滤水率显著高于低氧突变组,说明近江牡蛎对低氧适应一段时间后,具有一定耐受性,能够在低氧环境下进行生理活动,而突变的低氧环境下,近江牡蛎会进行迅速地自我防御,减少其滤食活动。大多数研究表明,较重的环境胁迫会导致贝类的体内机制发生变化,如贝类行为上关闭进出水管甚至闭合贝壳,使机体与环境相对隔离,从而其摄食行为减弱,通常都降低到基础水平以下,以减少对自身的伤害[17-18]。
3.2 低氧胁迫对近江牡蛎生理代谢的影响
耗氧率和排氨率是评价水生动物在不同胁迫环境下利用能源物质和消耗能量的指标。外界环境中溶解氧作为水生动物的重要生态因子之一,其浓度的变化会导致水体环境的变化,直接影响水生生物的生存[19]。研究表明,当溶解氧在一定范围内,大多数贝类耗氧率随溶解氧浓度的升高而增大,当溶解氧浓度低于其耐受范围后,会引起贝类的生理功能紊乱,从而耗氧率也随之下降[20]。该试验发现,低氧胁迫组与对照组正常溶氧条件下的耗氧率相比具有显著差异(P<0.05),如低氧突变组和低氧适应组在溶解氧浓度为2.0 mg/L时的耗氧率分别为0.38 和0.62 mg/(g·h),是正常溶氧条件下的3~4倍。且随着溶解氧浓度的降低,耗氧率逐渐下降,这表明该研究的试验溶解氧已达到近江牡蛎最高耐受氧浓度,当低于正常溶解氧浓度时,近江牡蛎会减少其生理活动及降低耗氧水平,以适应并维持水中的溶解氧水平。很多研究证明,水生生物为了在低氧中生存,新陈代谢会被抑制以節省能量,即水中溶解氧不足时,其有氧代谢活动受到限制,以适应缺氧环境[21]。此外,对于低氧突变组,近江牡蛎的耗氧率较低,低于低氧适应组。这表明在较低溶解氧条件下,近江牡蛎对低氧环境的适应需要一个过程,突然转移到胁迫环境使近江牡蛎难以适应,从而耗氧活动减少[21]。
排氨率反映了贝类的代谢强度和胁迫程度[22]。由于无氧代谢的效率远低于有氧代谢,因此在水中溶解氧不足的情况下节约能量至关重要,有研究发现,低氧胁迫会引发海洋生物的生理补偿,比如摄食和消化等生理活动减弱,进而导致了排氨率变化,这是潮间带的生物对生存环境变化而做出的适应机制[23-24]。氨氮是贝类氮代谢的主要终产物,排氨率能反映贝类蛋白代谢水平[25-26]。研究发现,与对照组正常溶氧条件下的排氨率相比,低氧胁迫组的排氨率呈显著下降趋势。这表明近江牡蛎在低氧胁迫的环境下,较低的溶解氧浓度使得其减少蛋白和氨基酸的分解代谢,从而导致氨氮排泄较低。一般认为,排氨活动的增加将消耗更多的能量,同时需要更多的氧气,低氧环境可能使贝类关闭进、出水管或贝壳,与胁迫环境相隔离,这是贝类长期适应自然生活环境而产生的一种生理性保护反应。然而,代谢异常或抑制的时间过长,可能会对近江牡蛎造成潜在的损害。
水体中溶解氧含量作为水生动物的重要限制因子,水体的缺氧会对贝类的存活、生长、代谢等产生重要影响[27-29]。通常,水生动物的耐低氧能力从强到弱依次为软体类、环节类、棘皮类、甲壳类、鱼类[30]。该研究证明,当溶解氧浓度为0.5 mg/L时,其胁迫下的近江牡蛎耗氧率明显下降(P<0.05)。这与Furr等[31]对美洲牡蛎(Crassostrea virginica)研究的结果一致,与常氧组相比,1.0 mg/L组的美洲牡蛎的代谢水平显著降低。由此可知,低氧可使近江牡蛎的代谢减弱,这是其应对低氧胁迫环境的一种生存策略。该研究中溶解氧浓度为0.5 mg/L胁迫下的近江牡蛎排氨率显著降低。这说明短时间低氧对近江牡蛎的排泄有明显的抑制作用。
3.3 低氧胁迫对近江牡蛎存活率的影响 该试验中,近江牡蛎在试验7 d后,低氧组2.0和3.0 mg/L 处理的存活率大于90%,表明其缺氧的耐受性比大多数其他双壳类动物强,如海湾扇贝,在溶解氧浓度为2.0~3.0 mg/L时,只能存活8~24 h[32]。需要注意的是生存率与溶解氧无线性变化关系。该研究结果表明,2.0 和3.0 mg/L 溶解氧浓度组的存活率接近,而1.5和0.5 mg/L低氧处理差异有统计学意义。这说明近江牡蛎存在一个氧气阈值1.5和2.0 mg/L。意味着当溶解氧低于这个氧气阈值时,其体内的压力会达到极限,从而破坏代谢调节。另一个值得注意的现象是存活率并不是随着时间而下降。这说明在一段时间的缺氧后暴露时,近江牡蛎能适应一定程度较低水平的溶解氧浓度。此外,死亡率可能代表近江牡蛎适应低氧机制的反应速度,如2.0和3.0 mg/L 溶解氧浓度时,在6 d后,存活率保持不变。自然环境下如果溶解氧浓度为2.0 mg/L时,在7 d后如何溶解氧升高,则能够保护近江牡蛎避免全部死亡。如双壳贝类,也发现同样的现象[33]。
作为一种能够生活在潮间带附着生活的双壳贝类,近江牡蛎与其他潮间带底栖生物一样,在反复缺氧和复氧的过程中具有很强的耐受性[34]。另外,在该试验中,第1次缺氧的近江牡蛎(低氧突变组),其生理代谢水平均显著低于第2次缺氧的近江牡蛎(低氧适应组),证明作为潮间带生物的近江牡蛎具有较强的低氧耐受性。另外,实际生产中,养殖户也应注重及时监测养殖水体中的溶解氧浓度,并在低氧环境时采取必要的处理措施,以减少养殖水产品的死亡率。
参考文献
[1] 张兴志,官俊良,何苹萍,等.香港牡蛎野生群体家系建立及耐高盐性筛选[J].南方农业学报,2019,50(2):385-390.
[2] 佘智彩,贾真,彭业韶,等.盐度胁迫对香港牡蛎部分生化指标的影响[J].海洋科学,2019,43(3):40-45.
[3] MA H T,ZHANG Y H,XIANG Z M,et al.Development of tri-nucleotide microsatellite markers from Crassostrea hongkongensis using enriched genomic libraries and cross-species amplification in two closely related species[J/OL].Aquaculture reports,2021,19[2022-04-25].https://doi.org/10.1016/j.aqrep.2021.100592.
[4] 潘英,李坚明,黄伟德.广西贝类养殖现状及产业发展策略建议[J].海洋科学,2015,39(11):132-137.
[5] 陈润,王鲁民,王亚冰,等.低氧和酸化胁迫对大黄鱼早期发育阶段消化生理的影响[J].海洋渔业,2021,43(5):586-594.
[6] 凌晨,张美东,沙航,等.低氧胁迫对鲢抗氧化酶活性及SODs基因表达的影响[J].淡水渔业,2021,51(3):53-59.
[7] 田东凡.低氧环境下海水溶解无机氮的转化机制探析[D].青岛:中国科学院大学(中国科学院海洋研究所),2020.
[8] 夏玉莹,张继红,刘毅.低氧胁迫下虾夷扇贝的行为特征及生理生化响应[J].中国水产科学,2021,28(10):1319-1328.
[9] BAKER S M,MANN R.Effects of hypoxia and anoxia on larval settlement,juvenile growth,and juvenile survival of the oyster Crassostrea virginica[J].The biological bulletin,1992,182(2):265-269.
[10] 张福绥,杨红生.山东沿岸夏季栉孔扇贝大规模死亡原因分析[J].海洋科学,1999(1):44-47.
[11] XIAO J,FORD S E,YANG H S.Studies on mass summer mortality of cultured zhikong scallops (Chlamys farreri Jones et Preston) in China[J].Aquaculture,2005,250(3/4):602-615.
[12] WANG M Q,WANG B J,JIANG K Y,et al.A mitochondrial manganese superoxide dismutase involved in innate immunity is essential for the survival of Chlamys farreri[J].Fish & shellfish immunology,2018,72:282-290.
[13] VAQUER-SUNYER R,DUARTE C M.Thresholds of hypoxia for marine biodiversity[J].Proceedings of the national academy of sciences,2008,105(40):15452-15457.
[14] WANG Y J,HU M H,CHEUNG S G,et al.Immune parameter changes of hemocytes in green-lipped mussel Perna viridis exposure to hypoxia and hyposalinity[J].Aquaculture,2012,356/357:22-29.
[15] YU J H,CHOI M C,PARK K I,et al.Effects of anoxia on immune functions in the surf clam Mactra veneriformis[J].Zoological studies,2010,49(1):94-101.
[16] 劉傲东,李力,侯令,等.缺氧与饥饿对马氏珠母贝滤水率和耗氧率的影响[J].基因组学与应用生物学,2016,35(3):595-602.
[17] SEIBEL B A.Critical oxygen levels and metabolic suppression in oceanic oxygen minimum zones[J].Journal of experimental biology,2011,214:326-336.
[18] BREITBURG D,LEVIN L A,OSCHLIES A,et al.Declining oxygen in the global ocean and coastal waters[J].Science,2018,359(6371):1-11.
[19] 王青林,董云偉,董双林,等.高温刺激对刺参浮游期幼体存活率及 Hsp70 表达量的影响[J].中国海洋大学学报(自然科学版),2011,41(3):47-51.
[20] STRAHL J,DRINGEN R,SCHMIDT M M,et al.Metabolic and physiological responses in tissues of the long-lived bivalve Arctica islandica to oxygen deficiency[J].Comparative biochemistry and physiology part A:Molecular & integrative physiology,2011,158(4):513-519.
[21] SMOLINSKI M M B.Regulation of pyruvate kinase in hypometabolic states[D].Ottawa:Carleton University,2016.
[22] 杨俭,魏伟,唐保军,等.温度胁迫对文蛤耗氧率和排氨率的影响[J].渔业信息与战略,2018,33(4):279-283.
[23] LAGERSPETZ K Y H.What is thermal acclimation?[J].Journal of thermal biology,2006,31(4):332-336.
[24] GOBLER C J,BAUMANN H.Hypoxia and acidification in ocean ecosystems:Coupled dynamics and effects on marine life[J].Biology letters,2016,12(5):1-8.
[25] WIDDOWS J.Physiological indices of stress in Mytilus edulis[J].Journal of the marine biological association of the United Kingdom,1978,58(1):125-142.
[26] SILVIA G J,ABEL ANTONIO U R,FRANCISCO V O,et al.Ammonia efflux rates and free amino acid levels in Litopenaeus vannamei postlarvae during sudden salinity changes[J].Aquaculture,2004,233(1/2/3/4):573-581.
[27] STEVENS A M,GOBLER C J.Interactive effects of acidification,hypoxia,and thermal stress on growth,respiration,and survival of four North Atlantic bivalves[J].Marine ecology progress series,2018,604:143-161.
[28] JANSSON A,NORKKO J,DUPONT S,et al.Growth and survival in a changing environment:Combined effects of moderate hypoxia and low pH on juvenile bivalve Macoma balthica[J].Journal of sea research,2015,102:41-47.
[29] HAIDER F,FALFUSHYNSKA H I,TIMM S,et al.Effects of hypoxia and reoxygenation on intermediary metabolite homeostasis of marine bivalves Mytilus edulis and Crassostrea gigas[J/OL].Comparative biochemistry and physiology part A:Molecular & integrative physiology,2020,242[2022-07-25].https://doi.org/10.1016/j.cbpa.2020.110657.
[30] BREITBURG D L.Behavioral response of fish larvae to low dissolved oxygen concentrations in a stratified water column[J].Marine biology,1994,120(4):615-625.
[31] FURR D,KETCHUM R N,PHIPPEN B L,et al.Physiological variation in response to Vibrio and hypoxia by Aquacultured eastern oysters in the Southeastern United States[J].Integrative and comparative biology,2021,61(5):1715-1729.
[32] ZHANG L Q,WANG F,LI M X,et al.Effects of hypoxia on survival,behavior,and metabolism of Zhikong scallop Chlamys farreri Jones et Preston 1904[J].Journal of oceanology and limnology,2020,38(2):351-363.
[33] LAUDIEN J,SCHIEDEK D,BREY T,et al.Survivorship of juvenile surf clams Donax serra (Bivalvia,Donacidae) exposed to severe hypoxia and hydrogen sulphide[J].Journal of experimental marine biology and ecology,2002,271(1):9-23.
[34] IVANINA A V,NESMELOVA I,LEAMY L,et al.Intermittent hypoxia leads to functional reorganization of mitochondria and affects cellular bioenergetics in marine molluscs[J].Journal of experimental biology,2016,219(Pt11):1659-1674.

