基于网络药理学和分子对接模拟探析山慈菇治疗骨肉瘤的潜在药效机制
段辛威,勾伟颖,杨燕妮,郑春松,3,陈友琴,李西海
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建中医药大学药学院,福建 福州 350122;3.福建省中西医结合老年性疾病重点实验室,福建 福州 350122;4.美国凯斯西储大学医学院,美国 俄亥俄州 44106;5.福建中医药大学中西医结合学院,福建 福州 350122)
骨肉瘤(osteosarcoma,OS)是一种多发于儿童和青少年的原发性骨恶性肿瘤,属于中医学“石痈”“石疽”“石岩”等范畴。OS 的病理机制尚不完全清楚,目前临床主要采用新辅助化疗联合保肢术进行治疗,但仍面临化疗药物耐药、毒副作用大等问题[1],而中医药在降低化疗药物毒副作用和提高化疗敏感性方面有独特优势。山慈菇是独蒜兰或杜鹃兰的干燥假鳞茎,其味甘、微辛、凉,归肝、脾经,具有清热解毒、化痰散结的功效,是临床常用的抗肿瘤中药之一[2],也是治疗OS 的常用药。研究显示,山慈菇提取物对OS 细胞体内生长具有抑制作用[3],但其发挥作用的活性成分及其相关分子机制尚不清楚,有待深入研究。因此,本研究采用网络药理学和分子对接模拟的方法,探析山慈菇治疗OS 的潜在药效机制,为揭示中药的药效分子、药效靶点与药效机制提供新思路。
1 方 法
1.1 山慈菇活性成分筛选和靶点预测 选择TC⁃MSP 数据库(https://old.tcmsp−e.com/tcmsp.php),以类药性(oral bioavailability,OB)≥0.18 为条件,筛选山慈菇的活性成分和靶点[4];从HERB 数据库(https://ngdc.cncb.ac.cn/databasecommons/database/id/7435)筛选出山慈菇活性成分,同时在2 个数据库中检索活性成分的靶点,去重后作为山慈菇的预测靶点。
1.2 OS 差异基因筛选及山慈菇治疗OS 靶点预测 从GEO 数据库中筛选出OS 相关基因测序芯片GSE36001(OS 细胞和成骨细胞全RNA)、GSE28424(OS 细胞与成骨细胞miRNA)、GSE19276(OS 活检组织与正常骨组织全RNA),利用log2 算法对基因数据进行整理(logFC>1,adjP>0.05),筛选出3 个芯片中的差异基因,将3 个芯片中的差异基因取并集,作为OS 疾病基因数据集。将山慈菇的预测靶点与OS 差异基因数据集取交集,这一部分交集基因即山慈菇治疗OS 的预测靶点。
1.3 山慈菇活性成分−OS 靶点调控网络构建 将山慈菇−OS 调控网络导入Cytoscape 3.8.1 进行可视化编辑,构建山慈菇治疗OS 的活性成分−靶点网络。
1.4 蛋白相互作用网络构建及核心靶点筛选 导入山慈菇−OS 预测靶点到STRING 数据库(https://cn.string−db.org/),设置分析条件为默认值,构建PPI(protein−protein interaction,PPI)互作网络后保存。采用Cytoscape 3.8.1 在PPI 网络基础上进行拓扑分析,即选取介数中心性(betweenness centrality,BC)、接近中心性(closeness centrality,CC)、度中心性(degree centrality,DC)、特征向量中心性(eigen⁃vector centrality,EC)、局部边连通性(local average connectivity−based method centrality,LAC)和网络中心性(network centrality,NC)作为筛选条件,以参数值均不小于中位数作为筛选条件,即可得到核心网络及靶点。
1.5 生物信息学分析 基于R 语言的Bioconductor软件合集对山慈菇−OS 预测靶点进行基因本体(gene ontology,GO)、京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,GO 选取q值排名前10 的条目绘制柱状图,KEGG 选取q值排名前30 的条目绘制柱状图,探析山慈菇治疗OS 预测靶点的生物学功能和潜在调控通路。
1.6 分子对接模拟验证 将PPI 核心网络中的靶点及其对应的活性成分作为分子对接的模拟验证对象,Pubchem 数据库获得活性成分的sdf 文件,ChemBio3D Ultra 14.0.0.117 将活性成分转换为mol文件备用,PDB 数据库获得核心靶点的pdf 文件,PyMOL 2.4.1 软件去除核心靶点的水分子和原有配体备用,AutoDockTools−1.5.6 对靶蛋白加氢,设置对接口袋和配体的构象、位置及方向,运用Vina 获得分子对接的结合评分和结合位置,一般认为配体与受体结合的能量越低构象越稳定,结合能<0 kcal/mol 说明配体和受体可以自发结合,结合能<−5.0kcal/mol则表示两者结合稳定。
2 结 果
2.1 山慈菇中活性成分及其靶点筛选结果 从2个数据库中筛选出有调控靶点的山慈菇活性成分20 个,对应的调控靶点共96 个,见表1、图1。
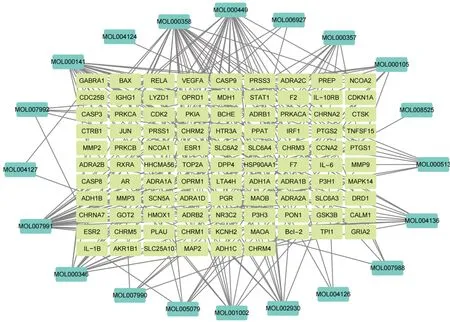
图1 山慈菇活性成分调控靶点图

表1 山慈菇活性成分
2.2 山慈菇治疗OS 的潜在靶点预测及调控网络构建 GEO 数据库筛选出OS 差异基因3 178 个。将96 个山慈菇调控靶点和3 178 个OS 差异基因取交集得到山慈菇−OS 预测靶点43 个,即认为这43 个靶点为山慈菇治疗OS 的调控靶点,共对应12 个活性成分,见图2。
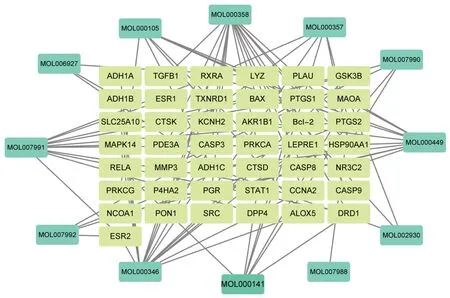
图2 山慈菇-OS 调控网络图
采用Cytoscape 3.8.1 对12 个活性成分和43 个山慈菇−OS 靶点构建调控网络,见图2。作用于1 个靶点的化合物为loroglossin,作用于2 个及以上靶点的有11 个(原儿茶酸、琥珀酸、酪醇、西多糖苷、羟基酪醇、flavanthrinin、2−methoxy−9,10−dihydrophen⁃anthrene−4,5−diol、loroglossin、β−谷甾醇、豆甾醇、Curcumadiol),显示出山慈菇多成分、多靶点地发挥抗OS 作用的特点。
2.3 共同靶点蛋白相互作用网络及核心靶点筛选 应用STRING 数据库对43 个调控靶点进行PPI拓扑分析,设置物种分析条件为默认值,去除游离节点,获得PPI 网络,该网络由43 个节点、331 条边构成。核心网络筛选出前列腺素内过氧化物合酶2(prostaglandin−endoperoxide synthase 2,PTGS2)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、雌激素受体1(estrogen receptor 1,ESR1)、胱天蛋白酶3(caspase−3,CASP3)、原癌基因酪氨酸蛋白激酶Src(proto−oncogene tyrosine−protein kinase Src,SRC),共4 个节点,6 条边,见图3。
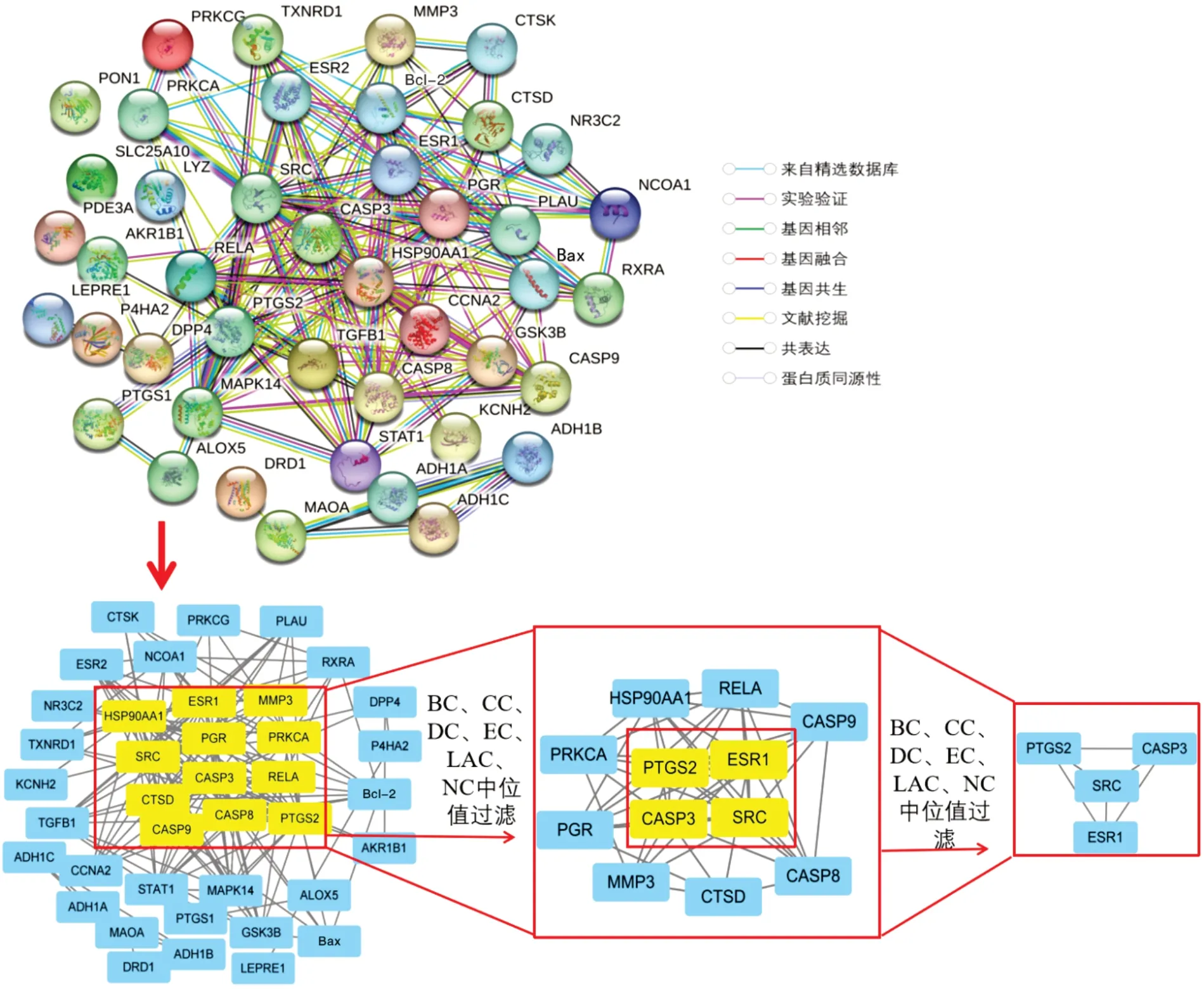
图3 PPI 及其核心网络图
2.4 生物信息学分析 对43个预测靶点进行GO和KEGG 富集分析,GO 富集结果1 518 条,其中生物进程(biological process,BP)结果1 419 条,细胞组分(cellular component,CC)结果13 条,分子功能(molecular function,MF)结果85 条,见图4。KEGG富集分析得到山慈菇治疗OS 的相关通路共133 条,包括细胞凋亡、肿瘤坏死因子、P53 等信号通路,见图5。
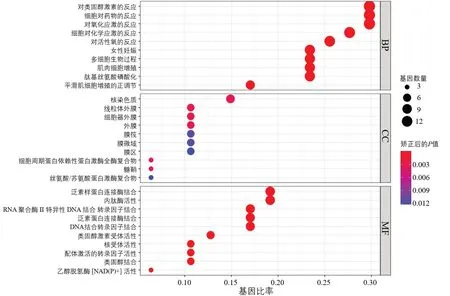
图4 GO 富集分析图
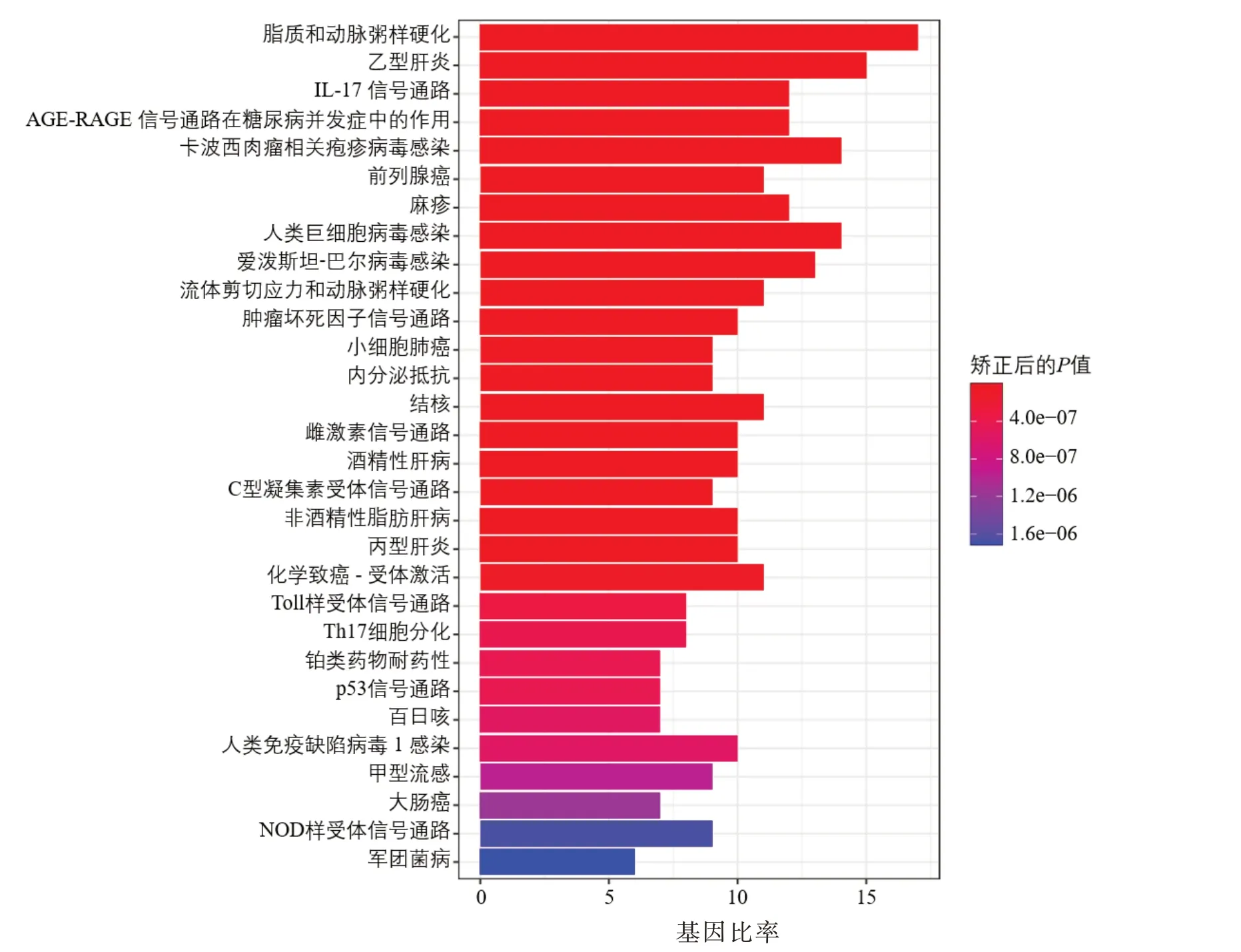
图5 KEGG 富集分析图
2.5 分子对接模拟验证 选取PPI 核心网络上的4 个靶点(PTGS2、SRC、ESR1、CASP3)和对应的9 个山慈菇活性成分进行分子对接,虚拟验证山慈菇活性成分与核心靶点的结合能力,通过结合自由能判断靶蛋白与活性成分的结合能力。结果显示,结合能<−5 kcal/mol 的共11 组,结合活性较好,结合能排名前6 的均为PTGS2 及其对应化合物,见表2、图6。
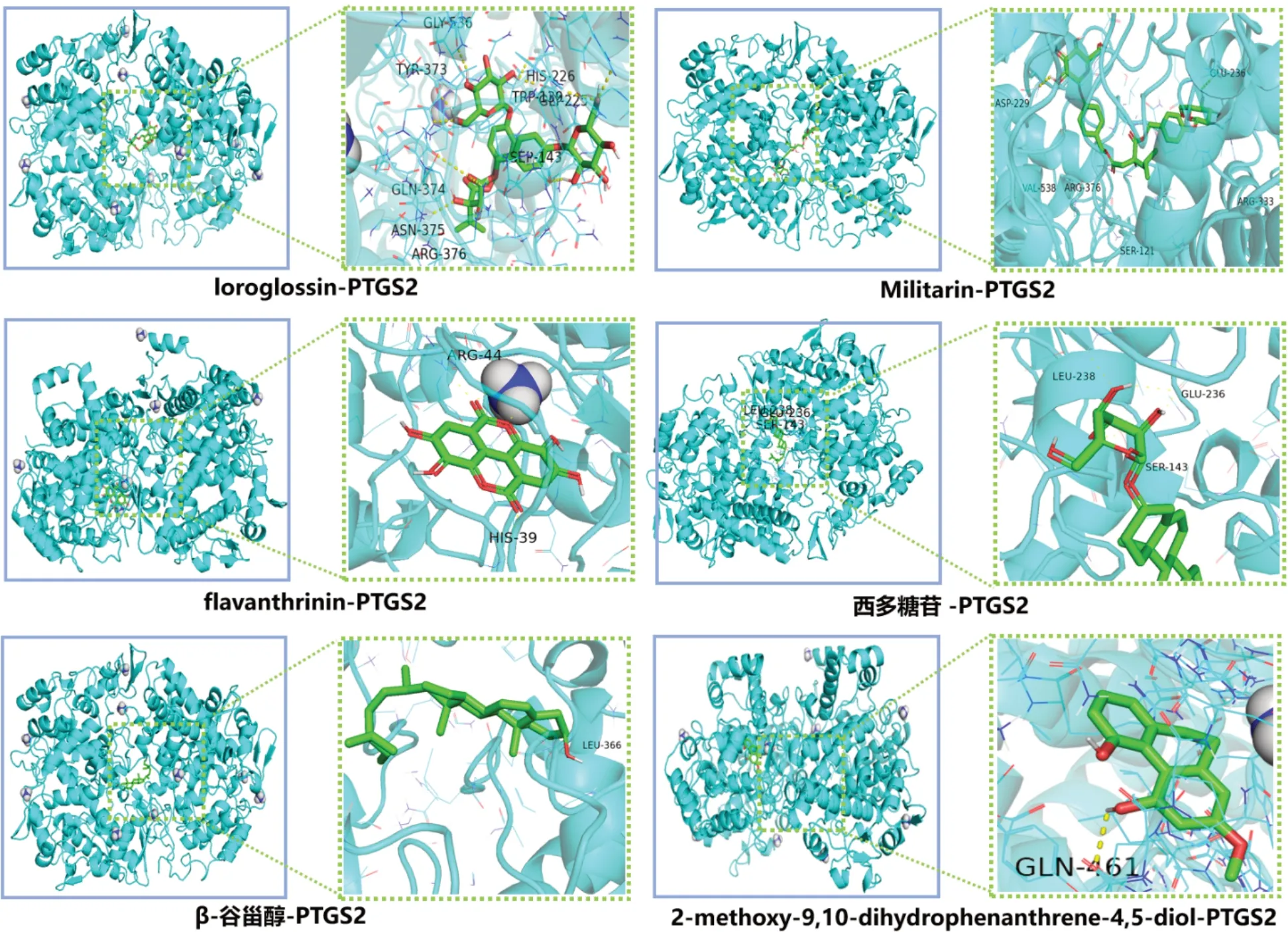
图6 分子对接结果示意图
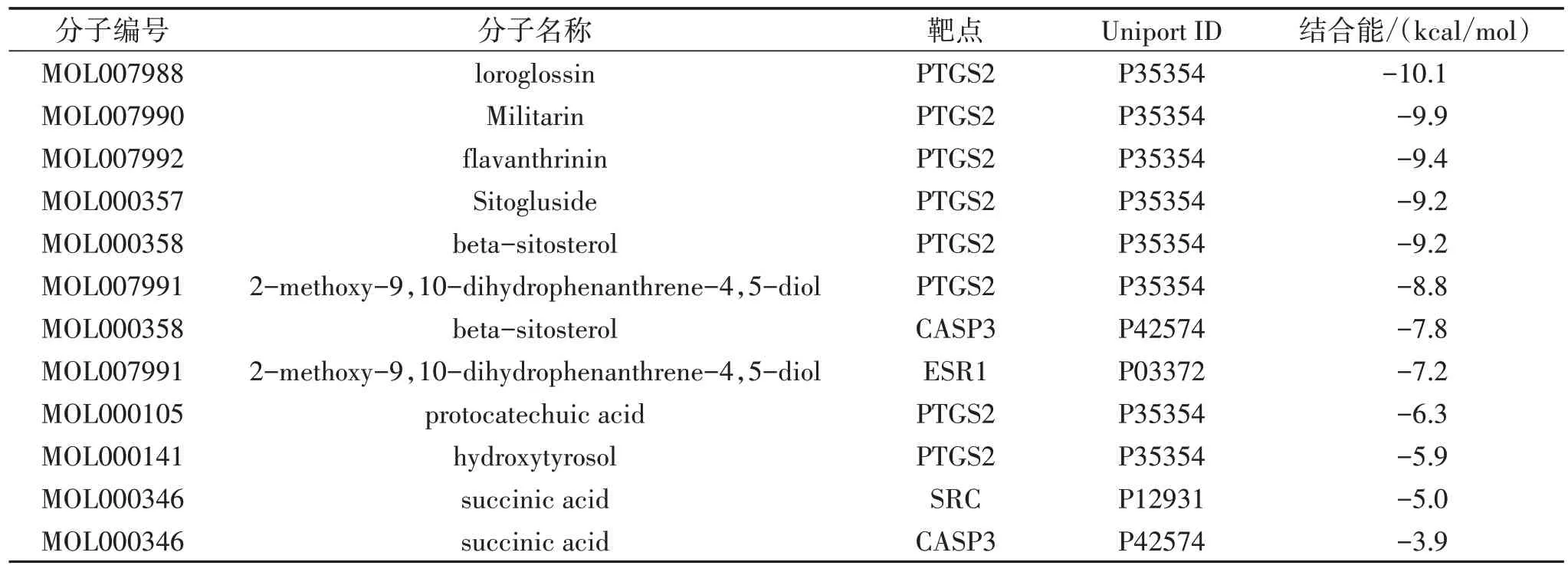
表2 分子对接结果
3 讨 论
OS 的中医病机是本虚标实,正气亏虚为本,痰浊瘀湿为标,先天肾气亏虚,骨失所养使邪毒趁虚内侵于骨,痰瘀内生致邪毒闭郁在骨,外感邪毒内伤于骨,导致OS 发病[5]。中医药在OS 治疗方面具有控制病灶大小、防治远处转移和对化疗增效减毒等优势[6]。因此,从中医药筛选具有增效减毒的抗OS 活性成分是亟待解决的关键科学问题。山慈菇可改善肿瘤化疗患者中医症状和生活质量,提高临床疗效[7],本文通过网络药理学和分子对接方法研究山慈菇对OS 的药效机制,揭示了山慈菇治疗OS具有多成分、多途径、多靶点的调控特征。
对山慈菇−OS 调控网络分析结果显示,山慈菇治疗OS 具有多成分特点,羟基酪醇、柯里拉京、西多糖苷、原儿茶酸和β−谷甾醇可能是治疗OS 的主要成分。柯里拉京是一种天然单宁,可诱导肿瘤细胞的凋亡和自噬,对包括OS 细胞在内的多种肿瘤细胞有明显的抑制作用[8−9]。羟基酪醇可通过抑制增殖和NF−κB 介导的凋亡途径发挥抗肿瘤作用[10−11]。仙茅苷可抑制肝癌HepG2 细胞增殖,并诱导其凋亡[12]。鞣花酸通过抑制S180、H22 荷瘤小鼠肿瘤生长及微血管形成,从而发挥抗肿瘤作用[13]。原儿茶酸通过下调血红素氧合酶1(heme oxygenase−1,HO−1)和上调细胞周期蛋白依赖性激酶抑制因子1A(cyclin dependent kinase inhibitor 1A,CDKN1A/P21)促进氧化应激,从而诱导结肠癌细胞凋亡[14]。西托糖苷可抑制人肝癌细胞HepG2 增殖并促进其凋亡[15]。β−谷甾醇可阻滞人肺腺癌A549细胞G2/M细胞期,并诱导凋亡对肝癌和肺癌发挥抗肿瘤作用[16]。因此,山慈菇可能是通过羟基酪醇、柯里拉京、仙茅苷、鞣花酸等多种成分对OS发挥治疗作用。
ESR1 和Caspase−3 调节OS 细胞程序性死亡。由ESR1 编码的雌激素受体ERα 和ERβ 位于细胞膜、细胞质或细胞核,可调节OS 细胞凋亡和自噬发挥抗肿瘤作用[17−18]。ERβ 可调节凋亡抑制蛋白(in⁃hibitor of apoptosis proteins,IAP)、B 细胞淋巴瘤/白血病−2相关X蛋白(Bcl−2 assaciated X protein,Bax)、Caspase−3 和聚二磷酸腺苷核糖聚合酶(poly ADP−ribose polymerase,PARP),并影响NF−κB/Bcl−2信号诱导OS细胞凋亡[19];也可通过抑制PI3K/AKT/mTOR通路和激活AMPK 通路参与自噬的诱导[20−21]。
PTGS2 的高表达促进OS 细胞增殖和侵袭。PTGS2,又名COX−2,是非甾体类药物的作用靶点之一。临床研究发现,OS 患者肿瘤组织和血液样本中的COX−2 表达随着恶性程度的升高而显著增加,而抑制COX−2可显著抑制OS的增殖和侵袭[22−24]。由SRC 编码的非受体酪氨酸激酶Src,通过介导其下游的受体在肿瘤增殖和转移中发挥重要作用,在OS 凋亡抵抗的细胞中持续活化,而抑制其活性后,可促进OS 细胞凋亡[25−27]。故山慈菇可能通过Cas⁃pase−3、PTGS2、SRC、ESR1 调控OS,而分子对接模拟验证结果也表明,除琥珀酸外,这4 个核心靶点与其对应的活性成分结合性良好。
GO 富集前10 的结果中,BP 富集显示DNA−模板转录这一结果与核心靶点中JUN 同源/异源二聚体形成的AP−1 复合体这一转录调节因子功能一致,而AP−1 复合体的转录调节需要CC 富集中的配体−激活转录因子活性、类固醇激素受体活性、RNA聚合酶Ⅱ−特异性DNA−结合转录因子结合、DNA−结合转录因子结合等分子功能参与;雌二醇是一种类固醇激素,BP 结果中,细胞对类固醇激素刺激的反应以及对雌二醇的反应表明,山慈菇可能通过这2 个进程发挥治疗作用,而核心靶点中雌激素受体ESR1 是这一进程的主要信号传递承担者。
KEGG 富集前30 的结果中,TNF 信号通路可以诱导OS 细胞凋亡。TNF 相关的凋亡诱导配体TRAIL 与其受体结合激活后,受体的死亡域与接头分子Fas 相关死亡域蛋白(fas−associated with death domain,FADD)相互作用,形成死亡诱导信号复合体并激活Caspase−8 前体,Caspase−8 前体激活Cas⁃pase−8 随后裂解效应半胱氨酸酶以介导细胞凋亡[28];P53 信号通路对OS 的调控,表现为p53 基因通过其蛋白过度表达抑制OS 细胞线粒体凋亡途径[29]。这提示山慈菇通过多个细胞功能和多条信号通路发挥增效减毒的治疗作用。
综上所述,本研究采用网络药理学方法对山慈菇治疗OS 的活性成分、作用靶点和通路进行系统的探析,结合分子对接模拟验证核心靶点与活性成分的结合活性,揭示了山慈菇治疗OS 多成分、多靶标、多途径的作用机制,提示山慈菇治疗OS 的潜在活性成分可能是羟基酪醇、柯里拉京、仙茅苷、鞣花酸等;调控靶点可能是Caspase−3、PTGS2、SRC、ESR1;作用方式与OS 细胞增殖、凋亡、侵袭密切相关。鉴于网络药理学和分子对接的局限性,山慈菇治疗OS 的确切作用机制有待进一步的实验研究。

