耐热性α-半乳糖苷酶突变体的筛选及酶学性质研究
马 焕 张秀江 胡 虹 冯 菲 解复红 向凌云 武艳芳 刁文涛
(1.河南省科学院生物研究所有限责任公司,河南 郑州 450008;2.河南省工业酶工程技术研究中心,河南 郑州 450008;3.棕榈生态城镇发展股份有限公司,河南 郑州 450000)
α - 半乳糖苷酶(α -galactosidase, α -gal, EC 3.2.1.22)能够特异性地水解蜜二糖、水苏糖、人B 型红细胞抗原和pNPG等底物,使底物中的非还原性末端α-1,6-半乳糖苷键断裂,释放位于底物末端的半乳糖残基。单胃动物肠道内没有α-半乳糖苷酶,不能吸收利用玉米-豆粕型饲粮中含有的α-半乳糖苷类物质等抗营养因子。将α-半乳糖苷酶作为饲用酶制剂可消除饲料中抗营养因子带来的不良反应,提高饲料的利用率和单胃动物的进食量[1]。但目前的α-半乳糖苷酶的传统生产方式主要是从动物、植物中提取和利用微生物发酵进行生产,这些传统方法普遍存在酶的活性以及生产的效率不高、酶的热稳定性不好、提取的工艺复杂等问题。在实际工业化饲料生产中,α-半乳糖苷酶受到了耐温性等方面的约束和限制。
为获得耐温性较高的α-半乳糖苷酶,本试验将改造株链球菌(Streptococcus)来源的α-半乳糖苷酶基因Gal27A,重组质粒电转至毕赤酵母进行高效表达,对耐温性提高的重组酶进行了酶学性质的初步探讨,以期获得耐高温的α-半乳糖苷酶,为α-半乳糖苷酶在饲料添加剂中的应用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 菌种来源
大肠杆菌(Escherichiacoli)Top10 感受态细胞由江苏康为世纪生物科技有限公司提供;毕赤酵母(Pichia pastoris)GS115细胞、毕赤酵母表达载体pGAPZαA均由武汉淼灵生物科技有限公司提供;α-半乳糖苷酶基因GalA为根据Genebank 中登录的氨基酸序列(XM_001390670.1),委托华大基因股份有限公司进行密码子改造后合成。
1.1.2 培养基及相关试剂
YPD 酵母培养基:酵母提取物1%、蛋白胨2%、琼脂2%,pH值自然。
YPDS培养基:酵母提取物1%、蛋白胨2%、山梨醇18.22%、琼脂2%,pH值自然。
低盐LB:酵母提取物0.5%、蛋白胨1%、NaCl 0.5%、琼脂2%,pH值自然。
MRS肉汤培养基:山梨醇。
处理液:100 mmol/L 醋酸锂(LiAc)、10 mmol/L 二硫苏糖醇(DTT)、0.6 mol/L 山梨醇、10 mmol/L Tris-HCl,pH值7.5。
限制性内切酶BamHⅠ、EcoRⅠ、Not Ⅰ由美国赛默飞世尔科技公司提供;T4 连接酶、FastPfu DNA 聚合酶、引物GAP-mF、GAP-mF、3'AOX1、博来霉素(zeocin)均由郑州森美生物技术有限公司提供。
1.2 试验方法
1.2.1 α-半乳糖苷酶突变质粒的构建
根据Genebank 中登录的GalA 氨基酸序列(XM_001390670.1)合成α-半乳糖苷酶基因Gal27A[2-3],并在两端设计酶位点EcoRⅠ和NotⅠ。对基因和质粒进行双酶切,利用T4 连接酶进行连接,转化Top10 感受态细胞[4-5],涂布于低盐LB抗性平板(zeocin 30 mg/L),提取重组质粒pGAPZαA-Gal27A。
1.2.2 毕赤酵母GS115感受态的制备
使用灭菌后的牙签挑取转化至毕赤酵母的单菌落,接种到YPD(3 mL/管)液体培养基中,30 ℃、180 r/min振荡培养培养24 h。取3 mL 培养物转接至YPD 培养基中,30 ℃、180 r/min 充分振荡5~6 h,OD600nm1.0~1.3 时收集细胞。4 ℃离心收集菌体,沉淀用预冷的无菌水冲洗2 次,离心,25 mL 处理液30 min(室温),再次4 ℃离心收集菌体,1 mol/L 山梨醇重悬细胞(2 次),8 000 r/min离心10 min。细胞重悬在2 mL的1 mol/L山梨醇溶液中制成感受态细胞,分装于80 μL/管,-70 ℃保存。
1.2.3 易错PCR
使用普通的Taq 酶作为聚合酶,将10 mmol/L 的dGTP 和5 mmol/L MnCl2加入反应体系中(50 µL),使MnCl2在PCR反应体系中的终浓度达到0.3~1.0 mmol/L。
将构建的表达质粒pGAPZαA-Gal27A 为模板,进行易错PCR,反应程序参考文献[5]。
1.2.4 PCR产物纯化
PCR产物切胶回收和沉淀DNA[6-7]:加入1/10倍体积的饱和醋酸钠(pH值5.3)和3倍体积乙醇,12 000 r/min离心10 min,弃掉上清液;加入200 μL 70%乙醇进行清洗,12 000 r/min 离心10 min,弃掉上清液,在室温环境中自然晾干,直到乙醇完全挥发,加入10 μL无菌去离子水溶解PCR反应所得到的产物,测定DNA水平[8]。
1.2.5 毕赤酵母转化
取80 µL GS115 酵母感受态细胞和10 µg 的线性化质粒[8],两者混合后转移至2 mm 电转杯(4 ℃预冷)中,冰上静置5 min;电击至GS115 酵母感受态细胞中[9-10],设置电压为1.5 kV,脉冲6 ms(1.5 kV,200 Ω,25 µF);电击后加入200 µL 提前4 ℃预冷的1 mol/L 山梨醇溶液中,重悬细胞,从电转杯中转移重悬液到1.5 mL 离心管中,30 ℃金属浴培养1 h;将培养物涂布于YPDS抗性平板上,培养箱30 ℃避光培养3 d。
1.2.6 α-半乳糖苷酶耐热性突变体的筛选
牙签挑取平板上长出的单克隆162个,接于5 mL/管YPD 液体培养基中,30 ℃、180 r/min 摇床培养3 d;12 000 r/min离心2 min收集上清液,用上清测定酶活。
1.2.7 α-半乳糖苷酶酶活测定
取1.5 mL离心管,加入稀释的酶液90 μL和pH值4.5的缓冲液10 µL 及10 mmol/L pNPG 溶液100 μL,水浴65 ℃反应10 min,水中冷却,加入800 μL 的Na2CO3(0.5 mol/L)溶液终止反应,OD405nm处测定吸光值[11-14]。
α-半乳糖苷酶酶活定义:在一定条件下,每分钟分解底物(pNPG)生成1 μmoL对硝基苯酚(pNPG)所需的酶量为1个酶活力单位(U)。
1.2.8 酵母基因组DNA的提取
在转化好的平板上挑取单克隆菌落于1.5 mL 离心管中,加入100 µL裂解液(0.2 mol/L乙酸锂,1%十二烷基磺酸钠)后重悬细胞,75 ℃加热10 min,加入无水乙醇300 µL,用70%乙醇漂洗DNA,离心,放置室温至无味,加入无菌水50 µL 溶解沉淀,离心5 min,以上清液为模板进行PCR 反应。挑选耐热突变体保温前后的酶活比高于野生型的单克隆,在实验室进行PCR 检测,检测成功的PCR产物送至华大基因进行测序。
1.3 酶学性质研究
1.3.1 最适温度及温度稳定性的测定
在最适pH 值6.5 条件下,按1.2.7 方法测定不同温度(30~80 ℃)下的α-半乳糖苷酶,以酶活最高者为100%,计算相对酶活力。
酶液分别置于不同水浴(30~80 ℃),保温10 min,冷却,测定α-半乳糖苷酶的残余酶活力,根据酶活力计算相对酶活力,以未经温度处理的酶活为100%,计算相对酶活力。
1.3.2 最适pH值和pH值稳定性的测定
分别以磷酸二氢钾-柠檬酸配制一系列的缓冲液,pH 值分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0 的缓冲液。酶液使用不同pH 值的缓冲液稀释,在最适温度65 ℃条件下测定α-半乳糖苷酶活力,以酶活最高者为100%,计算相对酶活力。
将酶液与不同pH值(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0)的缓冲液混合,冰上处理1 h,测定α-半乳糖苷酶的残余酶活力,以酶活力最高者是100%,计算相对酶活力。
1.3.3 金属离子对酶活力的影响
在α-半乳糖苷酶反应体系中加入Mg2+、K+、Na+、Fe3+、Al3+、Ca2+、Cu2+、Ag2+、Mn2+、EDTA(终浓度为1 mmol/L),测定α-半乳糖苷酶的残余酶活,以未加金属离子的酶活力为100%,计算酶活力保留率。
2 结果与讨论
2.1 α-半乳糖苷酶表达质粒的构建结果(见图1)
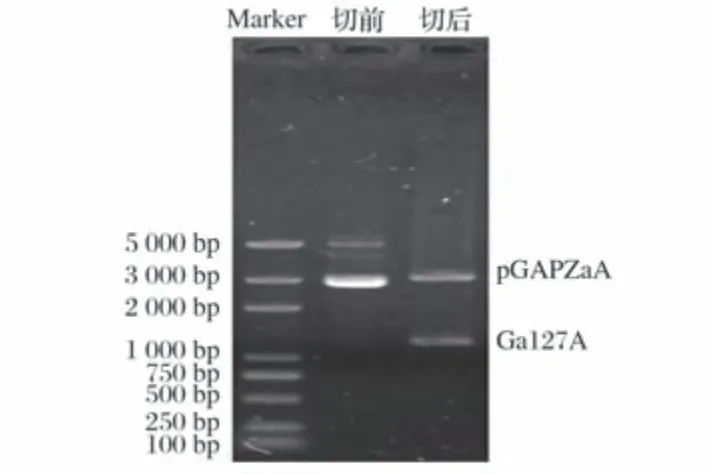
图1 质粒pGAPZαA-Gal27A酶切检测结果
由图1 可知,表达质粒pGAPZαA-Gal27A 构建成功。
2.2 易错PCR体系中MnCl2浓度(见图2)
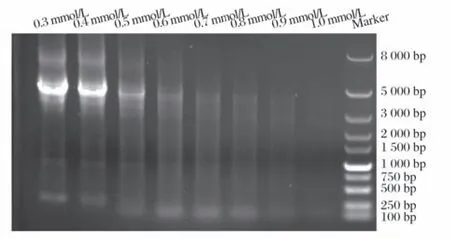
图2 pGAPZαA-Gal27A易错PCR中MnCl2浓度
PCR 体系中加入dGTP(终浓度为0.5 mmol/L)和MnCl2(终浓度分别为0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mmol/L)。由图2 可知,0.3、0.4 mmol/L 试验的PCR产物中均有明显pGAPZαA-Gal27A条带。
2.3 质粒pGAPZαA-Gal27A易错PCR(见图3)
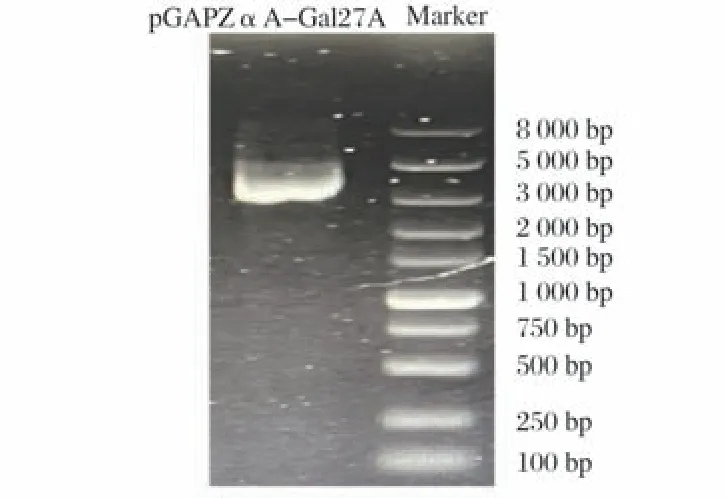
图3 质粒pGAPZαA-Gal27A易错PCR
由图3可知,易错PCR产生了特异性的PCR条带。
2.4 耐热突变体工程菌的构建
将PCR 产物纯化后电转化至毕赤酵母GS115 中,在含100 mg/L zeocin 的YPDS 平板上筛选阳性克隆,并对所有克隆的发酵液的α-半乳糖苷酶耐热性进行检测[15]。
2.5 α-半乳糖苷酶耐热突变体酶活测定
根据标准曲线和酶活定义[11,16-17]将筛选出的耐热突变体29 和54 在55 ℃保温10 min,保温前酶活为12.086、16.861 U/mL,保温后的酶活为2.438、3.273 U/mL,保温前后保留酶活比分别为20.21%和19.41%,野生型菌株55 ℃保温10 min后保留酶活比为13.12%,相比较得出加热前后的保留酶活比增幅大于45%。
2.6 突变体转化子的验证
pGAPZαA-Gal27A易错PCR结果见表1。
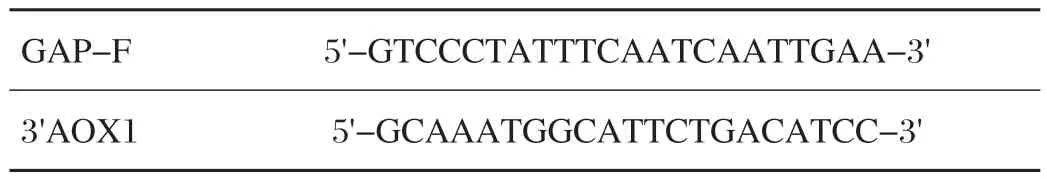
表1 PCR引物
pGAPZαA-Gal27A易错PCR结果见图4。由图4基因组PCR 产物琼脂糖凝胶结果可见分子量正确的特异性PCR条带,说明Gal27A已经成功重组进酵母基因组中。
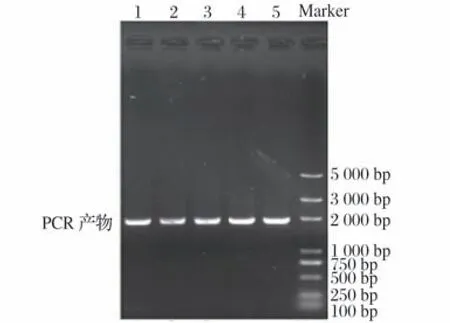
图4 pGAPZαA-Gal27A易错PCR结果
对PCR产物进行测序,基因突变结果见表2。

表2 基因突变结果
由表2 可知,29 号和54 号的碱基突变率分别为0.017 5%、0.292%[18-19],收集重组菌的发酵液,研究其酶学性质。
2.7 重组酶的酶学性质分析
2.7.1 温度对重组酶活性和稳定性的影响(见图5)
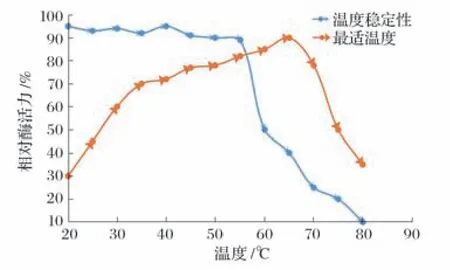
图5 温度对重组酶活性和稳定性的影响
由图5 可知,温度为35~60 ℃,相对酶活力稳定在45%~80%,期间相对酶活随着温度上升而增加;65 ℃保温10 min,相对酶活力达最高90%;65 ℃后,相对酶活力呈下降趋势;80 ℃保温10 min,相对酶活力保持在35%左右,表明该重组酶的最适温度为65 ℃。
温度从35 ℃缓慢上升至55 ℃,相对酶活力变化不大;温度为60 ℃时,相对酶活力下降至48%,相比55 ℃时下降了40%;随着温度增加,相对酶活力也随之下降;80 ℃时,相对酶活力为10%。
2.7.2 pH值对重组酶活性和稳定性的影响(见图6)
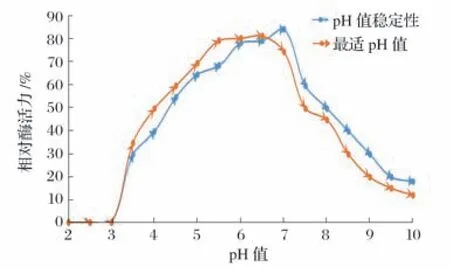
图6 pH值对重组酶活性和稳定性的影响
由图6 可知,该酶的最适pH 值是6.5。pH 值3.5~7.5时,相对酶活力随着pH值增加而增加,说明该酶具有较广泛的pH值范围。
2.7.3 金属离子对重α-半乳糖苷酶活力的影响(见表3)
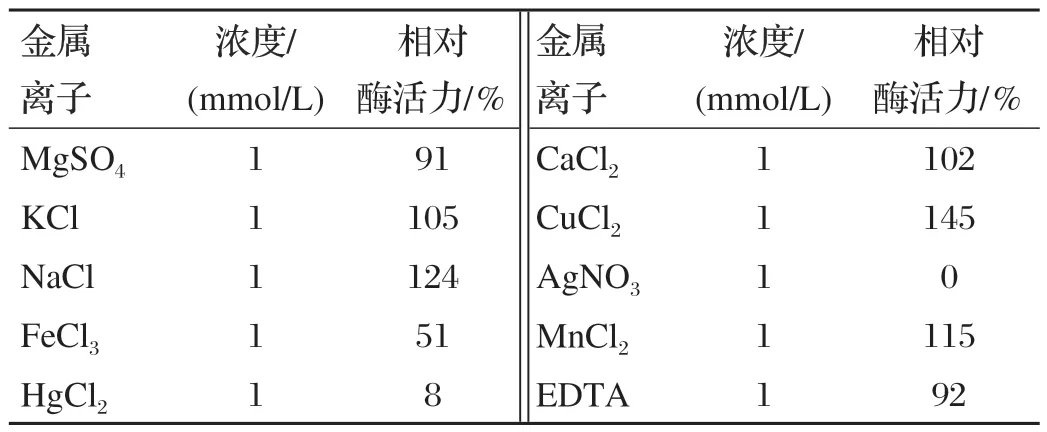
表3 金属离子对重α-半乳糖苷酶活力的影响
由表3可知,金属离子Ag2+、Hg2+对该重组酶具有较强的抑制作用,Mg2+、Ca2+、K+和EDTA对酶活力影响不大,Cu2+和Na+对该酶具有一定的促进作用,以Cu2+的促进作用较为明显。
3 讨论
自然界中产α-半乳糖苷酶的微生物很多,原菌发酵产酶的产量高低不一,部分还需要特定的诱导条件,低产量和高成本使得该方法不适用于工业化生产,工程菌相较具有较大的优势[18]。找到高表达且活性高的α-半乳糖苷酶基因,并进行克隆表达的方法受到了国内外研究者的青睐。国内外对这一方面的研究已取得一定进展,α-半乳糖苷酶基因工程表达系统主要有大肠杆菌、酵母、枯草芽孢杆菌和昆虫等。但由于大肠杆菌缺乏对真核蛋白质的修饰加工系统,细胞周质含有多种内毒素等缺点不利于进行真核生物源蛋白的表达。目前,利用毕赤酵母、生产α-半乳糖苷酶的研究较多,如来自Bisporasp.MEY-1、Penicilliumsp. F63、Rhizomucormiehei等的α-半乳糖苷酶基因均已在酵母中实现了有效的胞外表达,在甲醇诱导96 h 后,利用pNPG 法测定的酶活分别为105、111、240 U/mL[19]。
在饲料中添加α-半乳糖苷酶可解决豆粕型饲料中抗营养因子(多聚糖和低聚糖等)的问题,对提高豆粕蛋白能量利用率及有改善消化均具有较明显的效果。酶在加工应用过程中先经受原料混合、加工高温制粒后才能够在动物胃肠道溶解发生作用,因此酶制剂的温度和稳定性备受关注[20]。
本试验以提高α-半乳糖苷酶的耐热性为目的,围绕筛选出α-半乳糖苷酶的耐热性突变体,解决α-半乳糖苷酶在高温下易丧失活性甚至失活这一问题。本试验通过构建表达质粒pGAPZαA-Gal27A,控制MnCl2浓度,利用易错PCR技术扩增使其碱基发生错配,将易错PCR过程完成后的表达质粒pGAPZαA-Gal27A 通过电转化的方法导入感受态的毕赤酵母GS115 表达系统,利用毕赤酵母表达系统对其进行了重组表达。温度在35~55 ℃之间较稳定,相对酶活力一直稳定在90%以上;温度大于55 ℃,相对酶活力下降迅速;当温度达到80℃时,相对酶活力仅为10%,可见该酶的温度稳定性较差。该酶最适pH 值是6.5,pH 值在4.0~7.0 范围内相对酶活力较高,但是该酶的pH 值应用范围不是很广。Heravi 等[21]克隆了一种来自TalaromycesleycettanusJCM12802 的新型α-半乳糖苷酶基因也实现了酵母表达,但是与本试验结果相对比,本试验筛选出的突变体不具有更高的耐温性和pH值广泛性。
4 结论
本试验通过易错PCR 对基因进行定点突变的方法,获得了两个株链球菌(Streptococcus)来源的α-半乳糖苷酶Gal27A 的耐热突变体,分别是29 号和54 号耐热突变体。对应这两个突变体的氨基酸T32A、N16D、N44S、E412G 有突变时,测定α-半乳糖苷酶酶活并与野生型对比,结果显示在耐热性方面显著提升。使用毕赤酵母系统对该酶进行了异源表达,该酶具有良好的酶学性质,该酶的最适反应温度是65 ℃,65 ℃以下保温1 h,相对酶活力保留达到75%以上,说明该酶在30~65 ℃的热稳定性较好。最适pH 值是6.5,pH 值在4.0~7.0 时可保持35%以上的对酶活力。本研究中的耐高温突变体文库具有较好的酶学性能。

