复合添加剂对斜带石斑鱼生长、免疫和肠道形态的影响
赵转转 杨红玲 赵 芸 汪 攀, 朱传忠 孙云章
(1.集美大学水产学院 厦门市饲料检测与安全评价重点实验室,福建 厦门 361021;2.福建大北农华有水产科技集团有限公司,福建 漳州 363500)
本课题组前期从石斑鱼肠道筛选到一株益生菌——短小芽孢杆菌SE5,饵料中添加SE5(1.0×108CFU/g)能够有效提高斜带石斑鱼饲料效率,改善免疫功能,调节肠道菌群平衡[7-8]。益生菌和益生元组合成的饲料添加剂为合生素,其功效往往优于单独添加益生元或益生菌[9-10]。丁酸是在肠道中存在的一种短链脂肪酸,可为肠上皮细胞生长发育直接供能,但丁酸半衰期很短,极易挥发,不适合在饲料中直接添加[11]。三丁酸甘油酯半衰期长,安全无毒副作用,被肠道胰脂肪酶水解后产生3个分子的丁酸,是动物良好的丁酸来源。本课题组前期研究发现,不同梯度果寡糖(FOS)能够提高斜带石斑鱼的生长性能、免疫力和肠道健康[12-13]。本研究在此基础上,探究不同梯度果寡糖添加短小芽孢杆菌(SE5)和三丁酸甘油酯(Tb)对斜带石斑鱼生长、免疫和肠道形态的影响,为复合添加剂的开发利用提供参考。
1 材料与方法
1.1 试验材料
斜带石斑鱼幼鱼购自厦门小嶝岛某石斑鱼育苗场。FOS和Tb由江苏易实生物科技有限公司提供。本试验以鱼粉和豆粕为蛋白源,鱼油和豆油为脂肪源,配制4 组等氮、等脂饵料。基础饵料组成及营养水平见表1。

表1 基础饵料组成及营养水平(风干基础) 单位:%
1.2 试验设计与饲养管理
正式试验前进行10 d 的驯养,驯养期间从商品饵料过渡至基础饵料,每天饱食投喂2 次(8:30、17:30)。驯养结束后选取300尾平均体重为(18.13±0.02) g的健康石斑鱼,随机分为4 组,每组3 个重复,每个重复25 尾鱼,置于75 cm×45 cm×50 cm 的玻璃水族缸进行56 d 养殖试验。T1 组(对照组)斜带石斑鱼饲喂基础饵料,T2 组、T3 组、T4 组在T1 组的基础上分别添加0.05% FOS+SE5+0.10% Tb、0.10% FOS+SE5+0.10% Tb和0.20% FOS+SE5+0.10% Tb。将原料粉碎,过60 目筛,按照配方比例采用逐级扩大法混匀。短小芽孢杆菌SE5添加量均为1×108CFU/g,均匀喷洒在已混匀的饵料原料中,使用双螺杆制粒机制成直径为2.5 mm的软颗粒饵料,在室温下风干12 h,分装于自封袋,置于4 ℃保存。
养殖用水为一级砂滤海水,试验期间水温保持在25~29 ℃,pH值约为8,盐度为24‰~30‰,连续24 h充气,每日换水量为养殖水体的50%。
1.3 样品采集
分别于试验第28、56 d对每个缸的鱼计数,称总重,统计各组鱼的生长性能、饵料利用率和存活率。
于试验第28、56 d分别从每个缸中随机捞取4尾鱼,用40 mg/L 丁香酚麻醉,血样取自尾静脉,于1.5 mL 离心管保存,在4 ℃恒温24 h离心(10 000 r/min、10 min)后收集血清。采集血液后,取出肠道,其中两尾鱼的肠道于-80 ℃冰箱保存,用于测定消化酶活性;另外2尾鱼的前肠(2 cm左右)置于Bouin氏液中固定超过12 h,用于制作肠道切片。
1.4 测定指标及方法
1.4.1 生长性能
2.确定资金计划管理的范围。根据资金的经营流程明确资金支出和收入的相关部门、团队。明确资金收入和支出类型。资金收入包括盈利收入、债务收入等,资金支出包括经济投资、友情投资等。企业将收入和支出情况作出详细的分化。
根据公式计算增重率(WGR)、特定生长率(SGR)、饵料系数(FCR)和存活率(SR)。
式中:W0为鱼的初重(g);Wf为鱼末重(g);FI为每尾鱼饵料摄入总量(g);T为饲养天数(d);N0为初始鱼尾数;Nf为最终鱼尾数。
1.4.2 血清免疫指标
采用南京建成生物工程研究所试剂盒测定血清超氧化物歧化酶(SOD)、溶菌酶(LZM)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)的活性。
1.4.3 肠道消化酶活性
肠道样品测定前经4 ℃冰箱解冻,使用滤纸吸干表面水分,剪取肠道组织约0.1 g,加入9 倍体积的灭菌生理盐水匀浆,4 ℃、3 000 r/min离心10 min,取上清液保存。采用福林酚法测定蛋白酶活性,采用分光光度计法测定淀粉酶(AMY)和脂肪酶(LPS)活性。
1.4.4 肠道形态观察
固定在Bouin 氏液中的前肠经一系列乙醇溶液脱水,使用二甲苯清除并嵌入石蜡中,切割为5 μm的切片,进行HE染色,使用Image-Pro Plus 6.0软件测量前肠绒毛高度、绒毛宽度、绒毛数量和肌层厚度。
1.5 数据统计与分析
采用SPSS 22.0 软件中的单因素方差分析和Duncan's多重比较法检验各组间差异,结果以“平均值±标准误”表示,P<0.05表示差异显著。
2 结果与分析
2.1 复合添加剂对斜带石斑鱼长性能的影响(见表2)

表2 复合添加剂对斜带石斑鱼生长性能的影响
由表2 可知,不同日粮饲喂的斜带石斑鱼饵料系数差异不显著(P>0.05)。试验28 d,与T1组相比,T2组、T3组、T4组斜带石斑鱼末重、增重率、特定生长率均有提高,其中T3组增幅最大(P>0.05)。试验56 d,T2组、T3组、T4组斜带石斑鱼末重、增重率、特定生长率均显著高于T1组(P<0.05),各组存活率均接近100%。
2.2 复合添加剂对斜带石斑鱼肠道消化酶活性的影响(见表3)

表3 复合添加剂对斜带石斑鱼肠道消化酶活性的影响
由表3 可知,试验28 d,与T1 组相比,T2 组、T3组、T4组斜带石斑鱼肠道蛋白酶和脂肪酶活性显著升高(P<0.05);淀粉酶活性随复合添加剂中果寡糖含量增加呈上升趋势,与T1组相比,T4组斜带石斑鱼淀粉酶活性显著升高(P<0.05)。试验第56 d,与T1 组相比,T3 组、T4 组斜带石斑鱼蛋白酶和淀粉酶活性显著升高(P<0.05),T4 组斜带石斑鱼的脂肪酶活性显著升高(P<0.05)。
2.3 复合添加剂对斜带石斑鱼免疫指标的影响(见表4)

表4 复合添加剂对斜带石斑鱼免疫指标的影响
由表4 可知,试验28 d 时,与T1 组相比,T2 组、T3 组、T4 组斜带石斑鱼血清溶菌酶活性显著升高(P<0.05)。
试验28、56 d 时,与T1 组相比,T2 组、T3 组、T4组斜带石斑鱼血清超氧化物歧化酶活性均有升高,其中T3组和T4组显著高于T1组(P<0.05);T3组斜带石斑鱼血清酸性磷酸酶活性最高,显著高于T1组(P<0.05)。
2.4 复合添加剂对斜带石斑鱼肠道组织形态的影响(见图1~图3)
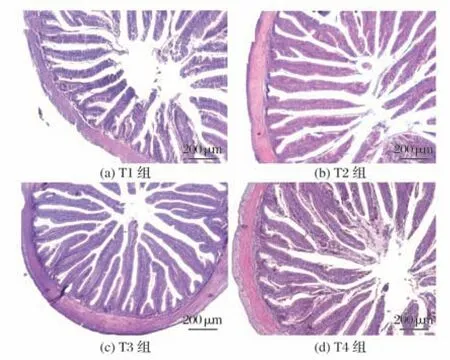
图1 复合添加剂对28 d时斜带石斑鱼肠道形态的影响(100×)

图2 复合添加剂对56 d时斜带石斑鱼肠道形态的影响(100×)

图3 复合添加剂对斜带石斑鱼肠道形态的影响
由图1和图2可知,各组石斑鱼肠黏膜形态结构都较为完整,绒毛排列整齐,与T1 组相比,T2 组、T3 组、T4组石斑鱼肠绒毛高度、绒毛宽度、肌层厚度和绒毛数量均有所增加。
由图3(a)可知,与对照组相比,T2 组、T3 组、T4 组石斑鱼肠绒毛高度显著增加(P<0.05),T4 组显著高于T2 组和T3 组(P<0.05)。试验28 d 时,T2 组、T3 组、T4 组石斑鱼肠绒毛宽度和肌层厚度显著高于T1 组(P<0.05),T4 组肠绒毛宽度显著高于T3 组(P<0.05);T2 组和T3 组绒毛数量显著高于T1 组(P<0.05)。试验56 d 时,T2 组~T4 组石斑鱼肠绒毛宽度和绒毛数量显著高于T1组(P<0.05);T2组和T4组肌层厚度显著高于T1组(P<0.05)。
3 讨论
3.1 复合添加剂对斜带石斑鱼生长性能的影响
合生素由于结合了益生元和益生菌的积极作用,通常表现出更好的促生长作用[14]。研究表明,与单独添加益生菌或益生元相比,日粮中添加合生素可使锦鲤(Cyprinuscarpio)[15]、奥尼罗非鱼(Oreochromisniloticus♀×O.aureus♂)[16]、卵形鲳鲹(Trachinotusovatus)[17]、日本鳗鲡(Anguillajaponica)[18]表现出更高的WGR。此外,三丁酸Tb可维持菊黄东方鲀(Takifuguflavidus)肠道微生物平衡[19],增强建鲤(Cyprinuscarpiovar)肠道抗氧化能力[20],从而促进鱼生长。本研究中,复合添加剂(FOS+SE5+Tb)饲养斜带石斑鱼56 d,显著提高了斜带石斑鱼WGR和SGR,与Rodriguez-Estrada等[21]发现在饵料中添加甘露寡糖+粪肠球菌+聚羟基丁酸在虹鳟(Oncorhynchusmykiss)上的应用结果一致。
肠道的消化和吸收能力对鱼类生长具有重要作用[22]。消化酶活性尤其是蛋白酶、淀粉酶和脂肪酶活性,与鱼类的消化能力密切相关。张春暖等[15]研究发现,锦鲤饵料中添加0.3% FOS和1×107CFU/g德式乳酸菌可提高锦鲤肠道蛋白酶和脂肪酶活性。李富东[23]发现,将FOS 和克劳氏芽孢杆菌联合添加到牙鲆(Paralichthysolivaceus)饵料中,牙鲆肠道蛋白酶和淀粉酶活性均有升高。Liu等[24]发现,凡纳滨对虾饵料中联合使用Tb 和FOS,其效果优于单独添加Tb。金子博[25]研究发现,三丁酸甘油酯和凝结芽孢杆菌在提升虎龙杂交斑(E.fuscoguttatus♀×E.lanceolatus♂)肠道脂肪酶活性上具有协同作用。本研究发现,试验28 d时,T2组、T3组、T4组斜带石斑鱼肠道蛋白酶和脂肪酶活性显著高于对照组,T4组肠道淀粉酶活性显著高于对照组,试验56 d,T3组和T4组肠道蛋白酶和淀粉酶活性显著高于对照组,表明复合添加剂(FOS+SE5+Tb)可提高斜带石斑鱼肠道消化酶活性,进而改善生长性能。
3.2 复合添加剂对斜带石斑鱼血清免疫功能的影响
Tb可通过增强机体免疫物质的活性和提高抗氧化能力增强机体免疫力[26]。Cheng等[27]研究发现,在饵料中添加Tb 可显著改善草鱼(Ctenopharyngodonidella)血清LZM 和SOD 活性。Liu 等[24]在高豆粕日粮中补充Tb,发现可显著改善凡纳滨对虾血淋巴ACP 和AKP 活性。研究表明,FOS 和芽孢杆菌均可以通过抑制病原微生物、增强免疫力及水生动物的疾病抵抗力[28-30],并且FOS和芽孢杆菌具有协同作用,联合应用能够更好地提高三角鲂(Megalobramaterminalis)[30]、海参(Apostichopus japonicus)[31]和锦鲤[15]的免疫功能。本研究发现,斜带石斑鱼血清SOD、LZM活性显著升高,表明复合添加剂有效增强了机体的免疫功能。可能是因为FOS和Tb作为肠道微生态平衡的调节因子,能够促进肠道乳酸菌等有益菌的增殖[19,30],而乳酸菌可以通过与病原菌竞争黏附位点增强宿主的免疫机能[32]。
3.3 复合添加剂对斜带石斑鱼肠道组织形态的影响
肠道既是营养物质消化和吸收的主要场所,也是抵御外部环境各种刺激的重要屏障[33-34]。研究表明,在饵料中补充Tb 能够修复黑鲷(Acanthopagrusschlegelii)[35]和黄姑鱼(Nibeaalbiflora)[36]高豆粕引起的肠道损伤,并维持肠道结构的完整性。与单独补充Tb 相比,Tb 和FOS 联合使用可进一步改善凡纳滨对虾肠绒毛高度[24],Tb和甘露寡糖(MOS)联合添加可有效提高菊黄东方鲀前肠和后肠绒毛高度和宽度[19]。肖世玖等[37]研究发现,团头鲂饵料中补充合生素(地衣芽孢杆菌、纳豆芽孢杆菌和低聚木糖)能够显著提高绒毛高度。本研究发现,饵料中补充复合添加剂(FOS+SE5+Tb)可显著提高斜带石斑鱼肠绒毛高度、绒毛宽度、绒毛数量和肌层厚度,以T4组效果较好。
4 结论
复合添加剂(FOS+SE5+Tb)能够改善斜带石斑鱼的生长性能、免疫力以及肠道形态,且T4 组(0.2% FOS+1.0×108CFU/g SE5+0.1%Tb)效果较好。

