丁酸梭菌的分离鉴定及生物学特性研究
刘 瑾 赵 华
(天津科技大学生物工程学院 天津市微生物代谢与发酵过程控制技术工程中心 天津市工业微生物重点实验室,天津 300457)
丁酸梭菌属于梭菌属,是革兰氏阳性菌中特有的肠道益生菌,具有较高的耐受性,菌体呈直杆状或稍弯曲,被鞭毛包围,是一种在恶劣环境中可通过形成芽孢增强自身对外界环境适应能力的菌株[1]。丁酸梭菌的芽孢抗逆性强,能够经受制备过程中高温、干燥、酸碱性的侵蚀,还具有稳定性强的特性[2]。芽孢在适当的条件下可重新萌芽并形成细菌。在肠道中,梭菌属与乳酸菌属等益生菌之间互利共生,可促进乳酸菌属等益生菌的生长,达到调节动物肠道微生态平衡的作用[3]。
丁酸梭菌具有独立的消化酶系统,可分泌多种代谢产物,其中丁酸是其最主要的代谢产物之一,可作为宿主胃肠道的能量来源[4],促进胃肠上皮组织发育并巩固其屏障功能[5],达到促生长目的[6]。丁酸梭菌能够产生较高浓度和纯度的丁酸,具有较好的生长稳定性以及较低的营养需求等优点,极具开发潜力及商业价值[7]。近年来,丁酸梭菌作为益生菌被广泛用于胃肠道疾病的临床治疗,如肠道菌群失调、药物相关性肠炎、急性和慢性腹泻、肠道应激综合征和便秘等,具有极强的肠道整理作用,对维持肠道正常生态有益;与其他益生菌制剂相比,丁酸梭菌的生长速度快、抗应激能力强、可以在肠道内持续定植,能够产生有机酸和丁酸梭菌肽[8-11]。丁酸梭菌发酵产生的分泌物可调节体内菌群结构和组成,改善动物机体内环境稳态,促进家畜生长[12]。丁酸梭菌及其代谢产物具有提高动物抗氧化能力、缓解炎症、调节肠道免疫和屏障功能等作用[13-14]。这些特性使丁酸梭菌在食品、发酵工业、饲料、医学医药等多个重要领域中具有得天独厚的优势[15-17]。
本研究从浓香型白酒窖泥中筛选丁酸梭菌,并对其进行生理生化试验鉴定,采用气相色谱法对其产酸量进行检测,为丁酸梭菌在畜禽生产中的应用提供参考。
1 材料与方法
1.1 试验材料
窖泥样品采自中国安徽文王酒业有限公司。
1.2 试验方法
1.2.1 窖泥悬浮液的制备
称取窖泥样品3.0 g,加入盛有80 mL RCM培养基和20 个无菌玻璃珠(φ=3 mm) 的螺口瓶中,37 ℃、220 r/min 振荡30 min,得窖泥悬浮液。将获得的窖泥悬浮液置于80 ℃下加热10 min,杀死营养体细胞,获得仅含孢子的灭活窖泥悬浮液。
1.2.2 丁酸梭菌的筛选
将10%灭活窖泥悬浮液接种于300 mL RCM 培养基中,平行3 组。摇匀后,封口膜隔绝氧气,置于37 ℃厌氧培养箱中培养10 d,观察螺口瓶内产气情况,选用产气多的螺口瓶吸取5.0 mL加入装有RCM培养基的螺口瓶内,重复上述步骤,富集培养4~5 次。吸取富集培养菌液100 μL涂布,封口膜隔绝氧气,放入厌氧袋中,35 ℃恒温培养箱静置培养3 d。挑取单菌落三区划线重复此步骤2~3 次,得到纯化单菌落。显微镜下观察菌体,将筛选出的细菌在4 ℃下保存。
1.2.3 筛选菌株的鉴定
1.2.3.1 菌落形态学观察
点接单菌落于RCM 固体培养基上,37 ℃倒置培养3 d,观察记录初筛菌的菌落形态、颜色、透明程度、光泽、大小等,分离纯化后的菌株进行革兰氏染色。
1.2.3.2 生理生化鉴定
参照《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》中的方法对疑似菌株进行相关生理生化鉴定。
1.2.3.3 16S rDNA序列分析
(1)脱氧核糖核酸(DNA)提取。
将获得的单菌接入RCM 液体培养基内进行厌氧培养,培养3 d得到新鲜培养液,8 000 r/min离心10 min收集菌体,使用1 mL RCM培养基重悬。
(2)PCR扩增。
利用PCR 扩增得到目的16S rDNA,将得到验证的PCR 产物送至金唯智生物科技有限公司测序,选定目的菌株。引物为细菌通用引物,序列为27F(5'-AGAGTTT GATCCTGGCTCAG-3')、1492R(5'-ACGGTTACCTTG TTACGACTT-3')。
PCR 扩增体系:2×Es Taq MasterMix 12.5 μL、27F 1 μL、1492R 1 μL、菌株培养液1 μL,加入ddH2O补至总体系25 μL。
PCR 反应参数:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,30 个循环;72 ℃终延伸2 min。
取扩增好的PCR产物3 μL,用0.8%的琼脂糖凝胶电泳进行进一步验证,剩余PCR 扩增产物于4 ℃冰箱内保存。若电泳验证获得较好的PCR 扩增产物,则将剩余PCR 扩增产物送至苏州金维智生物工程有限公司进行测序分析,并通过NCBI 中的BLAST 数据库对测序结果进行比对,选择相似性较高的模式菌株序列。
1.2.4 测定筛选菌株生物学性能
1.2.4.1 菌株产酸量的测定
(1)酸类物质的定性检测。
分别吸取乙酸、丁酸、己酸标准品1 mL于气相色谱瓶内进行检测,气相色谱分析条件见表1,获得单独短链脂肪酸(SCFAs)出峰保留时间。气相色谱仪的配备为氢离子火焰检测器(FID)、DB-FFAP(30 m×320 μm×0.5 μm)色谱柱。

表1 气相色谱分析条件
(2)酸类物质的标准曲线建立。
SCFAs 标准溶液质量浓度见表2,根据表2 配制SCFAs 的混合标准液,分别吸取酸类混合标准溶液1 mL,使用0.22 μm的有机相滤膜机型过滤,将溶液过滤至气相色谱瓶内,按照表1方法进行检测,获得3种酸的气相分析结果,以峰面积Y为纵坐标,质量浓度(g/L)X为横坐标进行线性回归,得到混合酸的各标准曲线。
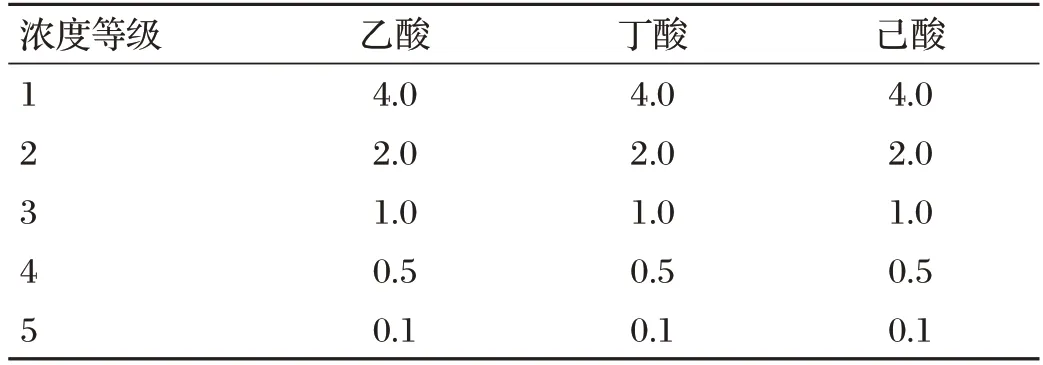
表2 SCFAs标准溶液质量浓度 单位:g/L
(3)分析方法的精密度分析。
取表2内浓度等级1的混合标准溶液,按照表1的气相分析条件连续进样6 次,每次进样结束后为样品换上未使用的气相色谱瓶的螺口盖,最终结果选择以丁酸的峰面积作为酸的代表计算相对标准偏差(RSD)用于表示分析测试结果的精密度。
式中:X为单次进样峰面积,μ为6次进样峰面积平均值,n为6次试验。
(4)培养液的前处理。
将筛选获得的2 株单菌接种于RCM 固体培养基上,厌氧袋内37 ℃培养3 d。使用接种环挑取少许菌落接种于300 mL RCM液体培养基内,培养6 d。
取菌体培养液1 mL,加入2%稀硫酸溶液,混匀,调节pH值为2,充分混匀完全酸化。用1 mL色谱纯二氯甲烷1∶1 进行萃取,萃取液用0.22 μm 滤膜过滤作为待测样品。
(5)气相色谱分析培养液的酸类物质。
将单菌的培养液样品前处理后,按照表1 进行气相色谱分析,利用混合酸类物质的标准曲线定量得到2 株单菌的产酸种类以及产量。
1.2.4.2 筛选菌株活菌数的测定
筛选菌株培养6 d 后测定其发酵液生物量OD600nm值判断发酵液中菌株活菌数,3个平行,重复3次。
1.2.4.3 筛选菌株芽孢率的测定
将培养6 d的培养液80 ℃水浴10 min稀释涂布于LB培养基,重复3次,计算芽孢率。
1.2.4.4 筛选菌株淀粉酶活性的测定
各取相同OD600nm值的1 mL发酵液滴加到淀粉琼脂平板指定位置,厌氧培养72 h,在表面覆盖一层碘液,观察并测定透明圈的直径。
2 结果与分析
2.1 窖泥菌的筛选
利用RCM培养基从窖泥中共分离出15株菌落形态存在差异的单菌落,通过继续培养筛选出2 株菌,其生长发育较为稳定,不易变性,命名为菌株J-1和菌株J-2。
2.2 筛选菌株的鉴定
2.2.1 菌落形态学观察结果
将分离得到的菌株J-1、菌株J-2在RCM培养基厌氧培养5~7 d观察其菌落形态,对单菌落进行革兰氏染色并使用油镜观察,结果见图1。
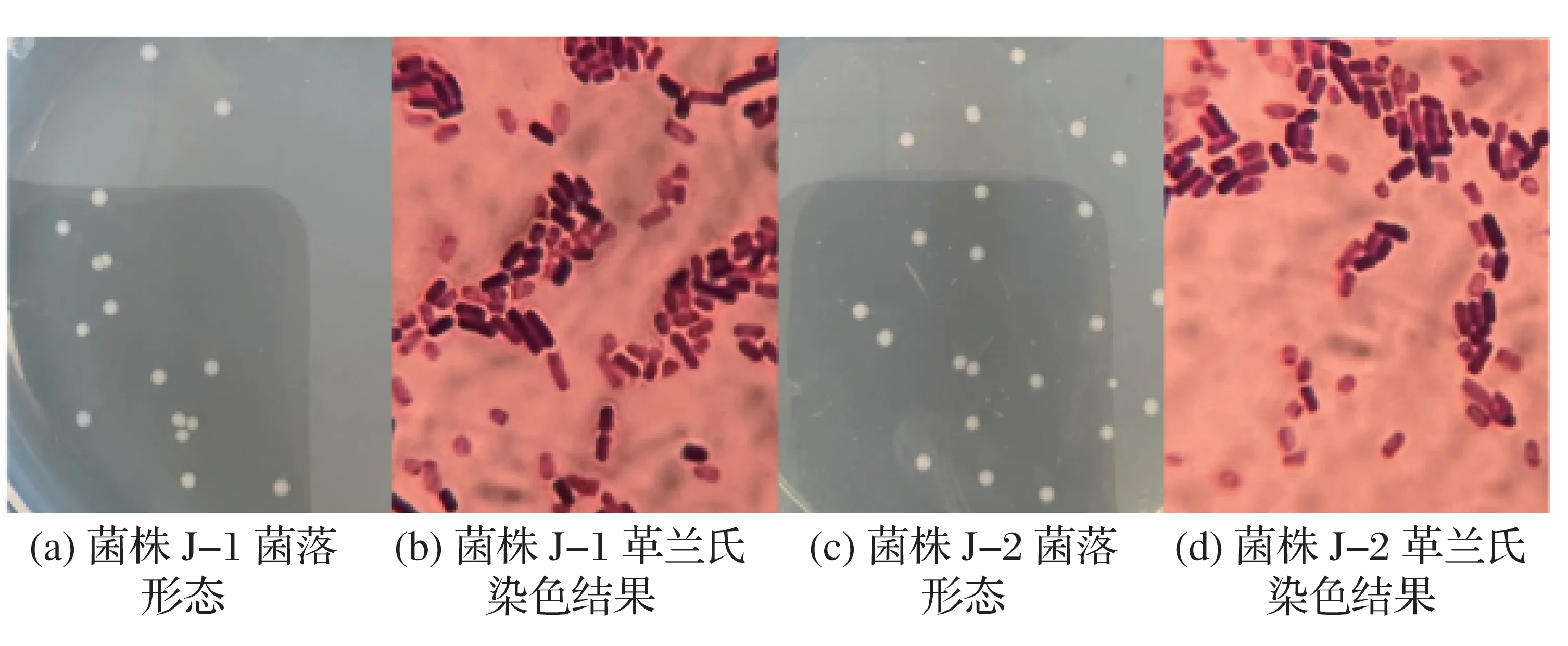
图1 菌落形态及革兰氏染色结果(100×油镜)
由图1(a)、图1(c)可知,菌株J-1分离后的菌落形态在RCM 平板培养基上皆呈现菌落大,白色不透明,中间深四周浅,菌落中心微微凸起,表面粗糙、扁平、不规则。
由图1(b)、图1(d)可知,菌株J-2为革兰氏阳性菌,菌体呈现长棒状。
2.2.2 生理生化鉴定结果
对分离株进行单糖分解试验、H2S试验、明胶液化试验、吲哚试验、MR试验、V-P试验、硝酸盐还原试验等生理生化试验,结果见表3。根据《伯杰氏系统细菌手册》可初步判断菌株J-1、菌株J-2均为丁酸梭菌。

表3 菌株生理生化鉴定结果
2.2.3 分子生物学鉴定结果
将分离得到的菌株J-1、菌株J-2 在35 ℃的RCM 液体培养基内培养2 d,得到新鲜菌体培养液,提取16S rDNA 进行PCR 扩增,将扩增结果在0.8%的琼脂糖凝胶电泳中进行DNA验证,使用凝胶电泳成像系统得到的结果见图2。
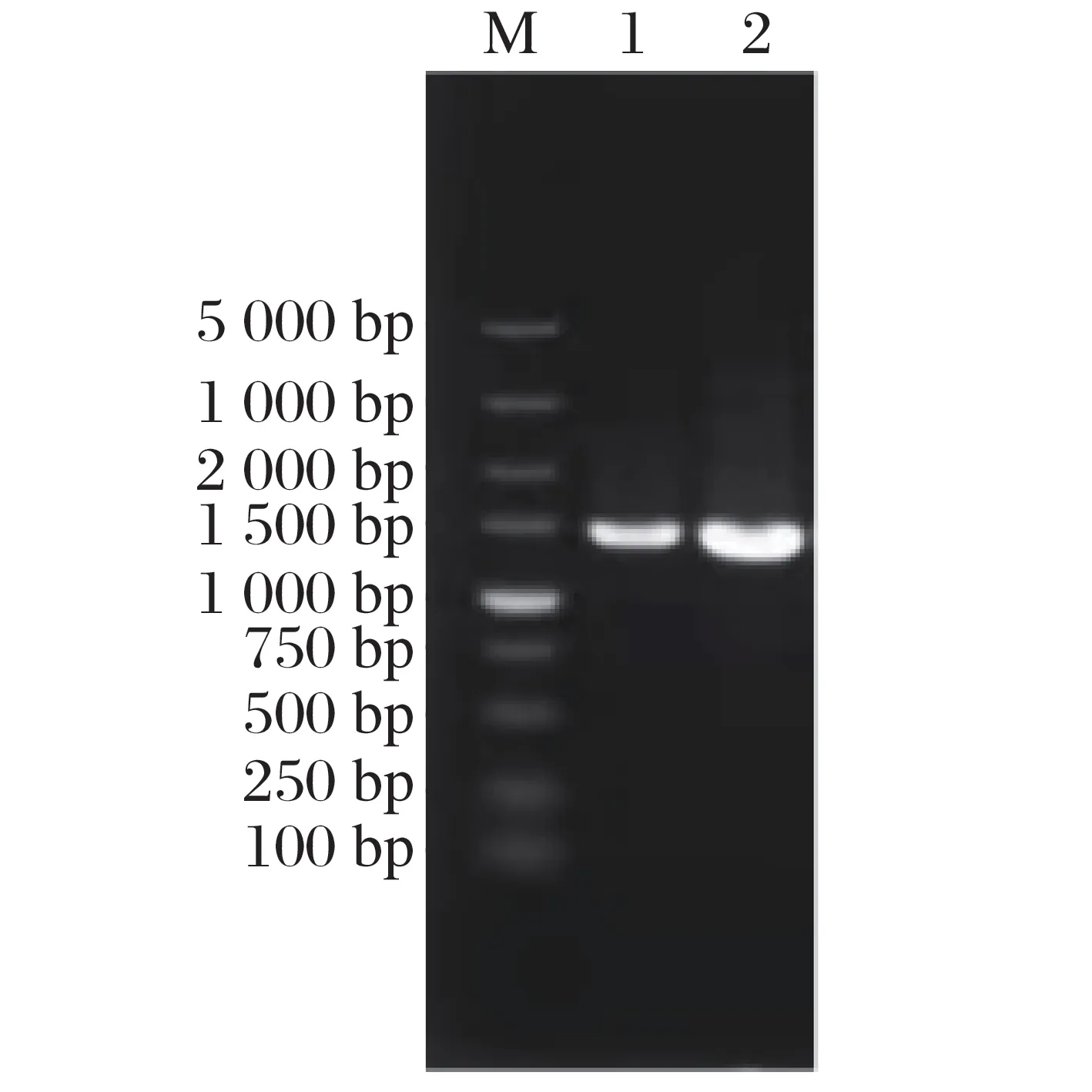
图2 PCR扩增产物
由图2 可知,筛选获得的2 株单菌PCR 扩增产物在1 500~2 000 bp之间均出现了清晰且无弥散的条带,表明得到了较高质量的PCR扩增产物。
将扩增所得的产物送样进行测序,测序完成后将菌株16S rDNA全序列基因组在NCBI中的BLAST数据库进行比对。根据对比结果可知,菌株J-1 与酪丁酸梭菌(Clostridiumtyrobutyricum)序列同源性为98.41%,菌株J-2 与酪丁酸梭菌序列同源性为98.32%,均与酪丁酸梭菌具有较高的亲缘性。采用MEGA-X软件进行系统发育树的构建,结果见图3。
由图3 可知,根据NCBI 的比对及系统发育树可知,菌株J-1、J-2 与酪丁酸梭菌有较高的亲缘性,为梭状芽孢杆菌属(Clostridium)。
2.3 筛选菌株生物学特性测定结果
2.3.1 菌株产酸量的测定结果
2.3.1.1 酸类物质的定性检测
根据步骤可得单独酸类物质的气相定性分析结果,可知乙酸、丁酸、己酸的出峰保留时间分别为5.868、7.458、9.770 min。
混合酸的气相分析结果见图4。由图4可知,气相分析图清晰明了,峰形对称性高,色谱图峰形尖锐,且无杂质峰干扰,物质分离单一,可准确定性,气相分析方法分离快速、操作实用以及分析周期短。

图4 混合酸的气相分析结果
混合酸的标准曲线见表4。由表4 可知,乙酸、丁酸、己酸的标准曲线在线性范围内具有良好的线性关系,相关系数均大于0.999,表明该气相分析方法具有可靠性。

表4 混合酸的标准曲线
根据连续进样浓度等级1的混合标准溶液6次得到丁酸的色谱峰面积计算RSD,见表5。
根据RSD 计算公式可得,6 次连续进样,以丁酸为代表获得RSD为0.185%。结果表明该气相色谱分析方法精密度优良。
2.3.1.2 菌株培养液中的酸种类及含量对比
将培养6 d的培养液通过前处理,并使用气相进行定性及定量分析,菌株产酸种类及产量见表6。
2.3.2 菌株生物学性能比较(见表7)

表7 菌株生物学性能比较
由表7可知,两株菌的生物量无明显差异,菌株J-1的生孢率比菌株J-2高17.16%,菌株J-1产生的淀粉酶活性高于菌株J-2。益生菌在肠道内产生的淀粉酶可将碳水化合物降解为低聚糖,促进益生菌对碳源的利用。研究表明,菌株J-1生物学性能最优。
3 讨论
3.1 丁酸梭菌的分离、鉴定分析
丁酸可降低环境的pH值,改变菌群的生长环境,影响其他菌群的生长繁殖,维持肠道菌群的平衡,改善肠道消化吸收功能。目前,大部分丁酸梭菌分离自人的肠道和土壤,来自白酒窖泥中的丁酸梭菌较少。白酒酿造过程中丁酸梭菌的含量以及发酵分泌物可在一定程度上影响白酒风味,将其应用于饲料中不仅具备良好的整肠作用,还能够起到一定的风味调整作用,增强饲料的益生价值[18-20]。本研究从浓香型白酒窖泥中筛选出15 株形态各异的菌株,最终选择两株菌株,通过生理生化鉴定和16S rRNA测序比对,确定其为丁酸梭菌。系统发育树分析发现,两株分离株与酪丁酸梭菌种属关系最近。
3.2 丁酸梭菌产酸量分析
丁酸梭菌代谢产物中含有大量丁酸、乳酸等物质,这些物质可促进双歧杆菌和乳酸菌等益生菌生长,抑制金黄色葡萄球菌、伤寒沙门杆菌、霍乱沙门杆菌等致病微生物的生长,在动物肠道中发挥巨大作用[21-22]。丁酸梭菌代谢产生的丁酸、蛋白酶、维生素、抗菌肽物质等物质可提高机体的消化功能,增强免疫系统,清理肠道中的有毒物质,提高肠道抗病能力[23]。本研究筛选得到的菌株J-1丁酸产量可达411.7 mg/L,为后续优化发酵培养基及培养条件以提高丁酸产量提供试验基础。
3.3 丁酸梭菌制剂的肠道益生性分析
目前,丁酸梭菌制剂被广泛应用于畜牧业中[24]。丁酸梭菌作为饲料添加剂,具有促进机体肠道有益菌群增殖,抑制有害菌群生长繁殖的保健功能,食用添加丁酸的饲料可使畜禽获得更高的营养价值并提高免疫力,为肠道上皮组织细胞的再生和修复提供营养物质,改善肠道形态和结构,抑制机体炎症反应,增强动物机体免疫力以及抗氧化等生物学功能[25-26]。丁酸梭菌在生长过程可形成芽孢,在最终商品化的菌剂中,活菌大多以芽孢的形式存在,而非芽孢形态的菌制剂不具备耐药性[27]。因此,提高丁酸梭菌在发酵过程中的菌体数量以及菌体形成芽孢的条件与配方进行一系列研究对其在饲料中应用具有重要意义。本研究中,菌株J-1 的生孢率为77.64%,可为后续提高生孢率提供参考
4 结论
本研究从窖泥中筛选获得菌株J-1、菌株J-2,经形态学观察、生理生化试验、分子生物学鉴定,确定菌株为丁酸梭菌。对两株丁酸梭菌进行生物学性能对比,菌株J-1在产酸种类及含量、活菌数、芽孢率、淀粉酶活性等方面均明显优于菌株J-2,可作为菌制剂储备菌株。

