含ACC脱氨酶的植物促生菌对荷花耐镉性及镉富集的影响
江婷,李泽鑫,胡途,徐迎春,金奇江,王彦杰
(南京农业大学园艺学院/农业农村部景观农业重点实验室/国家林业与草原局华东地区花卉生物学重点实验室/农业农村部花卉生物学与种质创制重点实验室,南京 210095)
近几十年来,由于工业污水和生活污水的不合理排放,大量重金属污染物进入河流、湖泊,对生态环境造成了严重污染[1]。据不完全统计,我国80%以上的水体都受到重金属污染[2]。镉(Cd)是我国水体主要重金属污染物之一,容易在植物或动物体内积累并难以被排出体外,这不仅影响动植物正常生长,而且其还能通过食物链进行转移和富集,最终危害人类健康[3]。因此,水体Cd 污染的治理迫在眉睫。重金属污染水体的修复方法包括物理修复、化学修复和生物修复等[4]。其中,植物修复作为一种重要的生物修复技术,因具有绿色环保且成本低廉等特点而被广泛关注[5]。而利用观赏植物修复污染环境不仅具有生态效果,还能够美化环境,因此成为近年来的研究热点[6-7]。但这种修复方法常因为植物受到重金属不同程度的毒害而影响修复效率[8]。因此,提高植物对重金属的耐受性对于改善植物修复方法十分重要。
植物促生菌(PGPB)是指生活在植物健康组织或根际土壤中的一类可以促进植物生长的有益微生物[9]。一些PGPB 的代谢产物如1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid,ACC)脱氨酶可以将乙烯合成前体ACC 水解为α-酮丁酸和氨,降低植物体内乙烯的水平,从而缓解逆境胁迫下植物的不良反应,促进植物生长,进而提高植物修复的效率[10-11]。目前,已有一些有关产ACC 脱氨酶的PGPB 可提高植物Cd 耐受性的报道。如Zafar 等[12]发现对Cd 胁迫下的小麦接种产ACC 脱氨酶的PGPB 能够通过提高植株体内光合色素的含量减少小麦对Cd的吸收,从而促进植物生长;Pramamnik等[13]指出对水稻接种产ACC 脱氨酶的菌株MCC3091,能够减少植物体内应激乙烯的产生,进而缓解Cd 胁迫对水稻根长和芽长的抑制;Liu 等[14]从Cd 污染土壤中筛选出一株产ACC 脱氨酶的PGPB,将其接种于五节芒后,其能够促进植物生长并增加植物对土壤中Cd 的富集。然而,这些产ACC 脱氨酶的PGPB 增强植物重金属耐性的相关研究主要集中在模式植物和农作物方面,其对重金属胁迫下水生观赏植物的生长及抗逆性的作用研究还鲜见报道。
荷花(Nelumbo nucifera)为莲科莲属多年生挺水花卉,是中国十大传统名花之一,具有很高的观赏价值、经济价值和文化价值。荷花根据用途不同可分为花莲(观赏荷花)、藕莲和子莲,其中观赏荷花花大色艳,是现代园林水景营造中不可或缺的重要植物材料[15]。近年来的研究表明,荷花具有高效吸收重金属的能力,其对水中Cd 的去除率高达85%[16-17],另外荷花适应性广、生长快、生物量大,因此可以作为修复污染水体的候选植物。然而荷花长时间处于高浓度Cd胁迫下会出现毒害表型[18-20]。乙烯被证实在荷花响应Cd 胁迫中起重要作用,减少乙烯含量或控制乙烯感知能增强荷花耐Cd 性[20]。但有关产ACC 脱氨酶的PGPB 能否影响Cd 胁迫下荷花生长及耐Cd 性的研究迄今尚未见报道。鉴于此,本研究选取从重金属污染区的双子叶植物中分离出来的具有较高耐Cd性的两种产ACC 脱氨酶的PGPB——Pantoea vagansSo23 和Pseudomonas veroniiE02[21],通过盆栽试验,对观赏荷花品种“秣陵秋色”分别接种So23和E02,研究这两种PGPB 对Cd 胁迫下荷花生长、生理代谢及其Cd 吸收积累能力的影响,以期为利用PGPB 提高荷花及其他水生观赏植物对重金属逆境的适应能力、提高植物修复效率提供理论依据,本研究对推动水生植物联合微生物治理重金属污染水体具有重要实践意义。
1 材料与方法
1.1 试验材料及培养
供试菌株Pantoea vagansSo23 和Pseudomonas ve-roniiE02由南京农业大学生命科学学院提供,菌株均从重金属污染区的双子叶植物地上部分离,具有较高耐Cd 性且具有产ACC 脱氨酶、产IAA 等特性[21]。将甘油保存的菌株So23 和E02 从超低温保藏冰箱中取出后分别活化,并接入无菌LB 液体培养基,30 ℃、180 r·min-1条件下振荡培养18~24 h后于室温下3 000 r·min-1离心10 min,收集菌体,用无菌水重悬制成浓度为1×108CFU·mL-1的菌悬液。
观赏荷花品种“秣陵秋色”(N.nucifera‘Molingqi-use’)为中小株型,花为重瓣型、黄色,种藕由南京艺莲苑花卉有限公司提供。4 月选取生长健壮、大小一致的带顶芽种藕,种植在直径为53.5 cm 的无孔塑料花盆中,每盆装土30 kg,每盆种植一支种藕,荷花生长期间进行正常的水肥管理。
1.2 盆栽试验
盆栽试验在南京农业大学龙潭荷花基地通风透光的塑料棚中进行。试验共设4 个处理:(1)Cd 胁迫下接种So23 处理(So23+Cd);(2)Cd 胁迫下接种E02处理(E02+Cd);(3)未接菌Cd 处理(Cd);(4)未接菌且未进行Cd 处理的对照(CK)。每个处理4 个重复。具体处理方法如下:待每盆荷花长出5~6 片立叶时,选取生长健壮且长势一致的荷花,在其根际周围分别注射浓度为1×108CFU·mL-1的So23 和E02 菌悬液各150 mL,每7 d 注射一次,共注射4 次,未接菌组以注射等体积无菌水代替。第一次接菌后对荷花进行Cd胁迫处理,Cd 添加量以现行土壤环境质量标准[22]及前人对盆栽荷花Cd 添加量的筛选[18]为依据,设置为30 mg·kg-1。将CdCl2·2.5H2O 溶于无菌水中,以水溶液的形式施入盆中,未进行Cd 处理组用等体积无菌水代替。试验过程中定期补水,保持水位距离盆上口边10 cm。Cd处理当日计为第0天,每隔7 d进行一次形态指标的观测,并在Cd 处理后第28 天对荷花各器官及底泥进行取样,用于后续试验测定。
1.3 测定指标与方法
1.3.1 形态指标观测
试验期间持续观察荷花株高、叶面积、立叶数和开花数的变化。其中株高指从水面到荷花叶片顶端的距离;每盆随机选择3片立叶量取荷花叶面积。
1.3.2 丙二醛含量测定
丙二醛(MDA)含量测定参考李合生[23]的方法。取0.2 g 荷花叶片,加入2 mL 10%的三氯乙酸(TCA),研磨成匀浆,4 ℃、4 000g条件下离心10 min。取0.5 mL上清液,加入0.5 mL 0.6%的硫代巴比妥酸(TBA),以0.5 mL蒸馏水代替提取液作为空白对照,混匀后沸水浴中煮沸15 min,离心取上清液测定600、532 nm 和450 nm处的OD值。计算MDA含量的公式如下:
式中:C为上清液MDA 的浓度,µmol·L-1;A532、A600、A450分别为上清液在532、600 nm和450 nm处的OD值。
1.3.3 抗坏血酸和还原型谷胱甘肽含量测定
抗坏血酸(AsA)和还原型谷胱甘肽(GSH)含量测定参考蔡庆生等[24]的方法。取0.2 g荷花叶片,加入1.5 mL 5%的TCA 在冰上研磨成匀浆,4 ℃、15 000g条件下离心10 min,上清液即为提取液。AsA 含量测定:取0.2 mL 提取液,加入0.2 mL 150 mmol·L-1PBS、0.2 mL ddH2O,混合均匀30 s 后加入0.4 mL 10%的TCA、0.4 mL 44%的H3PO4、0.4 mL 4%的2,2-联吡啶,混匀后加入0.2 mL 3%的FeCl3,于37 ℃水浴反应1 h,反应结束后测定OD525nm值。GSH 含量测定:取0.2 mL 提取液,加入2.6 mL 150 mmol·L-1PBS 和0.15 mL 6 mmol·L-1DNTB,混匀后30 ℃水浴反应5 min,测定OD412nm值。同时用AsA 和GSH 标准样品配制不同浓度的标准溶液,构建标准曲线,计算各样品中的AsA和GSH含量。
1.3.4 Cd含量测定
Cd 含量的测定采用微波消解-电感耦合等离子体发射光谱法[25]。将荷花新鲜的根、根状茎、叶片先用自来水冲洗,再用去离子水清洗3 遍,用吸水纸擦干表面水分后杀青烘干。土样在通风避光处自然风干。植物材料和土样研磨过60 目筛网后,分别称取0.2 g 和0.1 g 放入消解管中,加入5 mL HNO3消解后,用电感耦合等离子体发射光谱仪测定各样品的Cd含量,样品测定值均在标准值范围内。以生物富集系数(BCF)和生物转运系数(TF)来表示荷花对Cd 的富集和转运能力,计算公式如下:
富集系数=植株各器官或全株Cd含量(mg·kg-1)/底泥Cd含量(mg·kg-1)
器官A-器官B 的转运系数=植株器官B 的Cd 含量(mg·kg-1)/植株器官A的Cd含量(mg·kg-1)
1.4 数据处理
统计分析及制图采用Excel 软件和GraphPad Prism8软件完成。采用SPSS 22软件进行单因素方差分析(One-way ANOVA),均值的多重比较采用邓肯(Duncan)新复极差测验法检验(α=0.05)。
2 结果与分析
2.1 PGPB对Cd胁迫下荷花生长的影响
正常条件下(对照)荷花的株高和叶面积随处理时间延长逐渐增加,未接菌Cd 处理的荷花株高和叶面积增长非常缓慢,且始终明显低于对照(图1),说明Cd胁迫抑制了荷花株高及叶片的增长。与未接菌Cd 处理相比,接种So23 或E02 均使Cd 胁迫下荷花株高和叶面积在早期快速增加,特别是接种So23 的荷花,其株高和叶面积自处理后第14 天起显著高于未接菌Cd 处理组(P<0.05),甚至略高于对照。此外,与对照相比,未接菌Cd 处理显著抑制了荷花的立叶数和开花数(图2),而接种So23 或E02 在一定程度上缓解了Cd 胁迫对荷花立叶数的抑制,但对开花数没有显著影响,接种So23 和接种E02 处理的立叶数比未接菌Cd处理分别增加了26.32%和31.57%,且与对照间差异不显著(图2A)。以上结果表明接种So23 或E02 均能够有效缓解Cd 胁迫对荷花生长的抑制,促进荷花株高和叶片的生长。

图1 不同处理下荷花株高和叶面积随时间的变化Figure 1 Variation of plant height and leaf area of lotus with time under different treatments
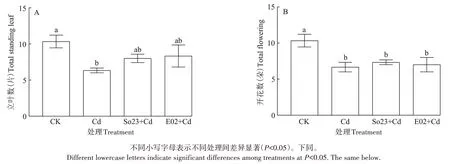
图2 不同处理对试验结束时荷花立叶数和开花数的影响Figure 2 Effects of different treatments on the number of standing leaves and flowering of lotus
2.2 PGPB对Cd胁迫下荷花MDA含量的影响
如图3 所示,对照组荷花叶片中MDA 含量为2.42 nmol·g-1,而未接菌Cd 处理下荷花叶片中MDA含量显著增加。Cd 胁迫下接种So23 或E02 后,荷花叶片中MDA 含量与未接菌Cd 处理相比分别显著下降了38.39%、31.21%,且接种So23 处理组叶片MDA含量与对照组间无显著差异。由此可见,接种So23或E02 均能显著降低荷花叶片中Cd 胁迫诱导的膜脂过氧化产物。

图3 不同处理对荷花叶片MDA含量的影响Figure 3 Effects of different treatments on MDA content in lotus leaves
2.3 PGPB对Cd胁迫下荷花AsA和GSH含量的影响
各处理下荷花叶片的AsA 和GSH 含量变化如图4 所示。与对照相比,未接菌Cd 处理下荷花叶片的AsA 和GSH 含量显著降低。Cd 胁迫下接种So23 或E02 后,荷花叶片的AsA 含量分别为957.87 mg·kg-1和845.18 mg·kg-1,比未接菌Cd 处理显著提高了54.85%和36.64%,其中接种So23 处理组的AsA 含量恢复至对照水平(图4A)。荷花叶片的GSH 含量在Cd 胁迫下接种So23 或E02 后分别上升为746.89 mg·kg-1和757.48 mg·kg-1,相比未接菌Cd 处理分别增加了29.36%和31.19%。可见,接种So23 或E02 可以有效提高荷花叶片抗氧化剂特别是AsA的含量,从而可以缓解Cd胁迫对荷花产生的毒害。
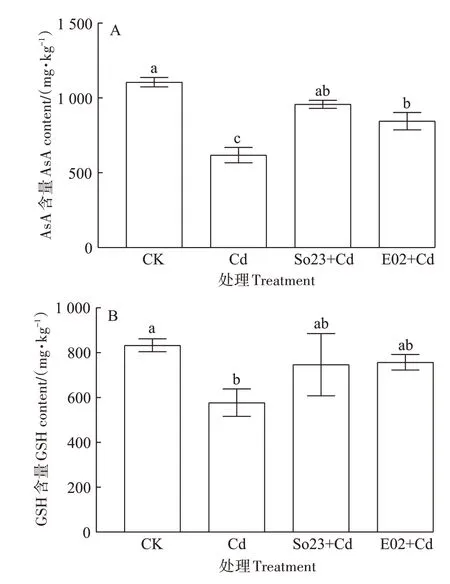
图4 不同处理下荷花叶片AsA和GSH的含量Figure 4 AsA and GSH contents in lotus leaf under different treatments
2.4 PGPB对Cd胁迫下荷花富集Cd能力的影响
对荷花的根、根状茎及叶中Cd含量进行测定(图5)发现,对照组荷花各器官中均未检测到Cd的积累,而Cd 处理下荷花各器官Cd 含量显著增加。其中,根部的Cd 含量最高,达到48.38 mg·kg-1,其次是叶和根状茎。Cd胁迫下接种So23或E02对荷花各器官中Cd的积累量有明显影响:与未接菌Cd 处理相比,接种So23 或E02 使得荷花根部的Cd 含量分别显著降低了52.77%和49.51%;叶片中Cd 含量的变化表现出与根部相似的降低趋势,其中接种E02 处理组叶片Cd 含量显著低于未接菌Cd 处理组;而接种So23 或E02 使得根状茎中的Cd 含量显著增加,与未接菌Cd 处理相比分别增加了87.69%和80.76%。

图5 不同处理对荷花各器官Cd含量的影响Figure 5 Effects of different treatments on Cd content in organs of lotus
各处理组荷花底泥中Cd 含量变化如图6 所示。对照组的底泥中未检测到Cd,而未接菌Cd 处理组底泥中Cd 含量为11.81 mg·kg-1,Cd 胁迫下接种So23 后底泥中Cd含量为5.14 mg·kg-1,显著低于未接菌Cd处理和接种E02处理组(9.94 mg·kg-1)。
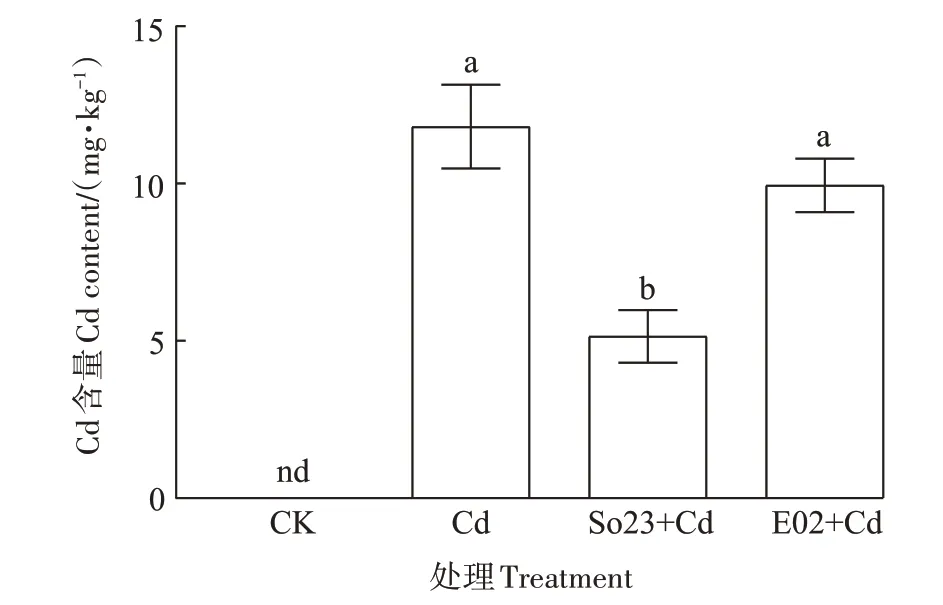
图6 不同处理对荷花底泥中Cd含量的影响Figure 6 Effects of different treatments on Cd content in sediment of lotus
2.5 转运系数与富集系数
对不同处理下荷花各器官的转运系数(表1)分析发现:未接菌Cd 处理下荷花根-根状茎和根状茎-叶的转运系数分别为0.04和1.90;接种So23或E02使得荷花根-根状茎的转运系数显著提高,分别为0.16和0.17,而根状茎-叶的转运系数显著下降,分别为0.81 和0.58。这表明接种So23 或E02 促进了荷花根部的Cd 离子向根状茎转运,同时抑制了Cd 从地下部向地上部叶片的转移。

表1 不同处理下荷花各器官对Cd的转运系数Table 1 Translocation of Cd in organs of lotus under different treatments
不同处理下荷花对Cd的富集系数如表2所示,Cd处理下无论是否接种PGPB,荷花根部的Cd富集系数均显著高于其他器官(P<0.05),表明荷花吸收的Cd主要集中于根部。与未接菌Cd 处理组相比,接种So23使得荷花的Cd富集系数有所提升,其根系、根状茎、叶及全株Cd 富集系数分别是未接菌Cd 处理组的1.12、4.22、1.88 倍和1.30 倍,且根状茎和叶对Cd 的富集能力显著高于未接菌Cd 处理组。此外,Cd 胁迫下接种E02对荷花各器官Cd富集系数的影响不显著。
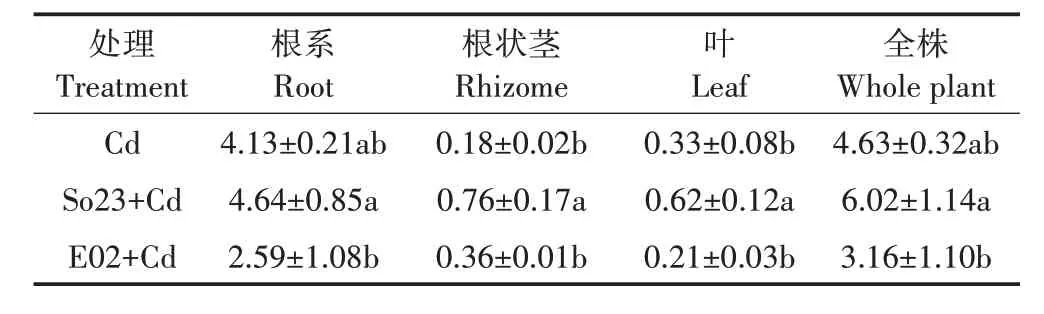
表2 不同处理下荷花各器官及全株对Cd的富集系数Table 2 Enrichment coefficient of Cd in various organs and whole plants of lotus under different treatments
3 讨论
重金属污染环境修复成为当前社会普遍关注的问题,近年来,利用植物-微生物联合修复重金属污染环境成为一种新的技术途径[4,14]。研究表明,PGPB可以通过一种或多种机制促进植物生长并增强植物抗逆性,其中产ACC 脱氨酶的PGPB 可以有效提高植物对重金属的耐受性,因此备受国内外研究者的关注[26-27]。本研究中Cd胁迫明显抑制了荷花的生长,而接种产ACC 脱氨酶菌株So23 或E02 后,荷花的株高及叶面积、立叶数均有不同程度的增加。陈粮等[28]的研究也发现接种产ACC 脱氨酶的PGPB 能够缓解Cd胁迫对拟南芥株高、地上生物量的抑制。其可能原因是,Cd胁迫下荷花等植物会产生大量胁迫乙烯[8,19-20],而PGPB 产生的ACC 脱氨酶可以将乙烯合成前体ACC 裂解为α-酮丁酸和氨,抑制植物体内乙烯的大量合成,从而降低过量乙烯对植物的抑制作用,促进植物生长发育[13,29]。此外,前人检测发现产ACC 脱氨酶菌株So23 和E02 还能分泌IAA[21]。有研究报道将产IAA 的PGPB 接种到田菁[30]、燕麦[31]等植物上可以促进植株生长。因此,本研究推测Cd 胁迫下接种So23和E02能够促进荷花生长可能还与这两种PGPB具有合成IAA的能力[21]有关。值得注意的是,Cd胁迫下接种So23 菌株后荷花各生长指标高于接种E02 菌株的处理,这可能与Cd 胁迫下接种So23 后植株体内的IAA产量明显高于接种E02[21]有关。不同菌株对逆境下植物生长的影响存在差异的现象在五节芒[14]、柳枝稷[21]、苜蓿[32]中也有报道,这主要是由于不同菌株产IAA、溶磷等其他促生特性的差异,导致其在与ACC 脱氨酶协同促进植物响应逆境胁迫时表现出明显区别。
植物在逆境胁迫下,体内会诱导产生大量的活性氧(ROS),造成氧化伤害。膜脂过氧化是氧化应激的生化标志之一,可通过产物MDA 的含量来衡量[33]。本研究中,接种两种产ACC 脱氨酶的PGPB 后,荷花叶片中MDA 含量均较未接菌Cd 处理显著下降,表明接菌降低了Cd 胁迫对叶片细胞膜的损伤,进而减轻了荷花叶片的膜脂过氧化反应。这一结论与赵会会等[34]研究Cd 胁迫下产ACC 脱氨酶的PGPB 对一年生黑麦草叶片中MDA 含量影响的结果一致。植物在长期进化过程中形成了一系列复杂的机制以抵御逆境胁迫造成的氧化伤害,其中抗坏血酸-谷胱甘肽循环是植物抗氧化系统中清除ROS 的重要途径,与植物抗逆性密切相关[35]。AsA 和GSH 是该循环中两种重要的抗氧化剂,可以通过淬灭ROS 来调节氧化应激并保持细胞的氧化还原平衡状态[36]。本研究中,Cd胁迫下荷花叶片的AsA 和GSH 含量显著降低,究其原因可能是逆境胁迫下植物体内大量ROS 分子积累,导致AsA 和GSH 被消耗,同时植物体内AsA 和GSH 合成受阻,造成细胞氧化还原状态失衡[37],引起Cd 毒害;而接种So23 或E02 使得荷花叶片中AsA 和GSH 含量(特别是AsA)明显升高,增加的抗氧化剂能够用来清除Cd诱导的过量ROS,维持细胞氧化还原平衡状态[38],进而缓解Cd胁迫对荷花叶片细胞膜的损伤及植株生长的抑制。重金属胁迫下接种PGPB通过增加植物体内AsA和GSH含量,进而使植物最大限度地减少氧化应激诱导损伤的现象在玉米响应Zn胁迫[39]、芥菜响应Cr胁迫[40]中也有类似发现。
接种产ACC 脱氨酶的PGPB 不仅能促进植物生长,还对Cd 的吸收和转运有一定的调控作用[21]。本研究中,Cd 胁迫下无论是否接菌,荷花都表现为根部的Cd 含量明显高于其他器官。前人的研究同样发现,对Cd 胁迫下的一年生黑麦草[34]、白车轴草[41]接种或不接种PGPB,各处理均表现为植株根部Cd含量最高。与未接菌Cd 处理相比,接种So23 或E02 均能显著抑制Cd 向荷花地上部叶片的转移,使荷花叶片Cd含量减少,从而减轻重金属对荷花叶片的毒害。有研究发现PGPB 定殖后可以通过调节大量金属转运蛋白及其编码基因表达等来调控Cd 在植物体内的转运,缓解Cd 胁迫对植物的毒害[42-43]。本研究显示,接种So23 使得荷花对底泥中Cd 的富集系数明显提升,这可能与So23 能够产生有机酸[21]相关。大量研究证实土壤pH 的降低有利于增加土壤中酸可提取态Cd含量,使Cd 更容易被植物吸收。有研究指出,接种PGPB 能够通过产生有机酸来降低土壤微环境pH,从而促进拟南芥、积雪草等植物对土壤中Cd 的富集[27,44]。此外,PGPB 还可以向胞外分泌聚合物,因聚合物带有的负电荷官能团能够与Cd 离子发生络合、离子交换等作用,从而实现Cd 离子被细菌表面吸附[45]。本研究涉及到的两种PGPB菌株均被证明能吸收Cd,且So23 细胞对Cd 的吸附量较E02 更高[21]。因此,推测接种So23 一方面通过分泌有机酸降低土壤pH,进而促进荷花对Cd 的吸收,另一方面通过菌种本身对Cd 的吸附作用[21],导致底泥中更多的Cd 被吸收,改善了底泥环境。
4 结论
(1)Cd 胁迫明显抑制了荷花的生长发育;接种产ACC 脱氨酶的植物促生菌(So23 和E02)可以增加荷花叶片中抗氧化剂特别是抗坏血酸的含量,降低丙二醛的含量,有效缓解了Cd胁迫对荷花的毒害,促进了荷花生长。
(2)接种So23 和E02 促进了Cd 在荷花体内的转运,能够通过限制Cd 从地下部向地上部叶片的转移来抵抗Cd 胁迫。此外,接种So23 还增加了荷花对底泥中Cd的富集,改善了底泥环境。