三级模拟人工湿地对镉钨复合污染废水净化研究
伍德,张威宇,刘玉玲,姚俊帆,张朴心,彭鸥,铁柏清*
(1.湖南农业大学环境与生态学院,长沙 410128;2.湖南省灌溉水源水质污染净化工程技术研究中心,长沙 410128;3.农业农村部南方产地污染防控重点实验室,长沙 410128)
随着工业和采矿业的不断发展,我国重金属污染问题日渐严重。据2014 年《全国土壤污染状况调查公报》显示,我国重金属总超标率为16.1%,其中镉(Cd)超标率最高,达到7%[1],我国南方稻米Cd含量超标问题十分严重。有研究表明,我国南方地区稻田土壤Cd 污染最主要来源是Cd 超标灌溉水[2],长期污水灌溉的农田土壤Cd 污染指数最高,土壤重金属综合潜在环境风险为强级[3]。工艺生产产生的废水中少部分重金属会沉降在迁移路径上,大部分的重金属会以有效态的形式进入生态圈循环,危害人体健康[4]。
钨(W)作为VIB 族的一种过渡元素,广泛应用于冶金、军事等行业[5]。近些年,随着W 的采冶及其应用,W 暴露途径增加,W 对人体健康的潜在危害日渐凸显[6-9]。有研究[10]发现,湖南典型钨矿采冶区土壤W含量最高可达环境背景值的数千倍。农田土壤重金属的重要输入来源之一是灌溉水,自然水体W 浓度通常在10.3 ng·L1~2.05 µg·L1之间,而停产钨矿非采冶区流域水体W 浓度能达到0.11~0.34 mg·L1[11],有研究表明,在钨矿区附近农田土壤中,重金属复合污染是主要污染特征[12]。钨矿区附近农田土壤潜在生态危害指数评价表明耕作层土壤重金属生态危害风险极高,而Cd 是土壤重金属潜在生态风险主要的贡献因子[13]。长期食用钨矿区附近农田土壤生产的水稻等作物,其风险不容忽视。因此,从灌溉水净化方面治理钨矿区农田土壤Cd、W 污染,对降低稻米重金属超标风险,实现粮食生产安全化具有重要意义。
目前国内外研究净化水体重金属的技术方法包括离子交换、物理吸附、化学沉淀、膜过滤及电化学技术法等[14],这些技术方法用于浓度较低、处理量大的灌溉水都有明显的局限性。人工湿地是一种20 世纪70 年代发展起来的新兴污水处理系统,净化技术原理包括物理法、化学法和生物法,因其造价低、易维护、连续处理能力强等优点得到广泛应用[15]。有学者[16]种植宽叶香蒲构建人工湿地系统,净化含高浓度重 金 属Pb(11.5 mg·L-1)、Zn(14.5 mg·L-1)、Cd(0.05 mg·L-1)的铅锌矿选矿废水,该系统对3种重金属的净化效率分别达到99.0%、97.3%和94.9%,历经10 a 的持续监测,净化效果优良且稳定。目前国内外利用模拟人工湿地净化灌溉水重金属的研究较多,但对Cd、W 复合污染的净化以及净化系统的输入输出通量的计算、植物吸收转移Cd 的量以及水培沉积物的机理研究较少。本研究选取了再力花、旱伞草、铜钱草3种常见水生植物构建纯水培条件下的三级模拟人工湿地,配制Cd、W 模拟复合废水,研究水培三级模拟人工湿地对模拟废水中Cd、W 的去除效率及水培过程中产生的沉积物去除重金属的机理,以期为钨矿区污染灌溉水中Cd、W 的净化以及钨矿区稻米安全生产提供技术支撑。
1 材料与方法
1.1 试验装置的搭建
本试验设置于湖南农业大学环科楼前的实验棚内,试验采用长0.8 m、宽0.4 m、高0.45 m 的塑料水箱,由3 个单级模拟湿地串联成一个三级模拟湿地为一个处理,分3 个处理共9 个水箱。将称取的CdCl2·2.5H2O和Na2WO4固体混合溶于水后在每次向蓄水桶中补水时加入,确保每次配制出的废水浓度相同,通过蠕动泵将1 000 L 蓄水桶中配制的含Cd、W 模拟废水压送进试验装置(图1)。从静态实验的结果中选出效果最优的3 种植物,3 个三级模拟人工湿地处理分别设置为单种植物种植串联(T1)、两两搭配种植串联(T2)以及3种植物搭配种植串联(T3);各处理的各单级湿地单元编号以及出水取样编号均统一使用,具体见表1。箱底不铺设底泥及基质,采用霍格兰营养液[17]水培的方式。为规避短流现象,使水流均匀流动,进出水方式设置为下进上出。进水口距箱底约0.1 m,出水口距箱底约0.3 m,各个单级模拟湿地之间使用内径为3.17 mm 的蠕动泵专用软管连接,控制系统液面高约0.30 m,通过蠕动泵控制进水流量(图1)。

表1 动态实验植物的处理Table 1 Treatment of dynamic experimental plants
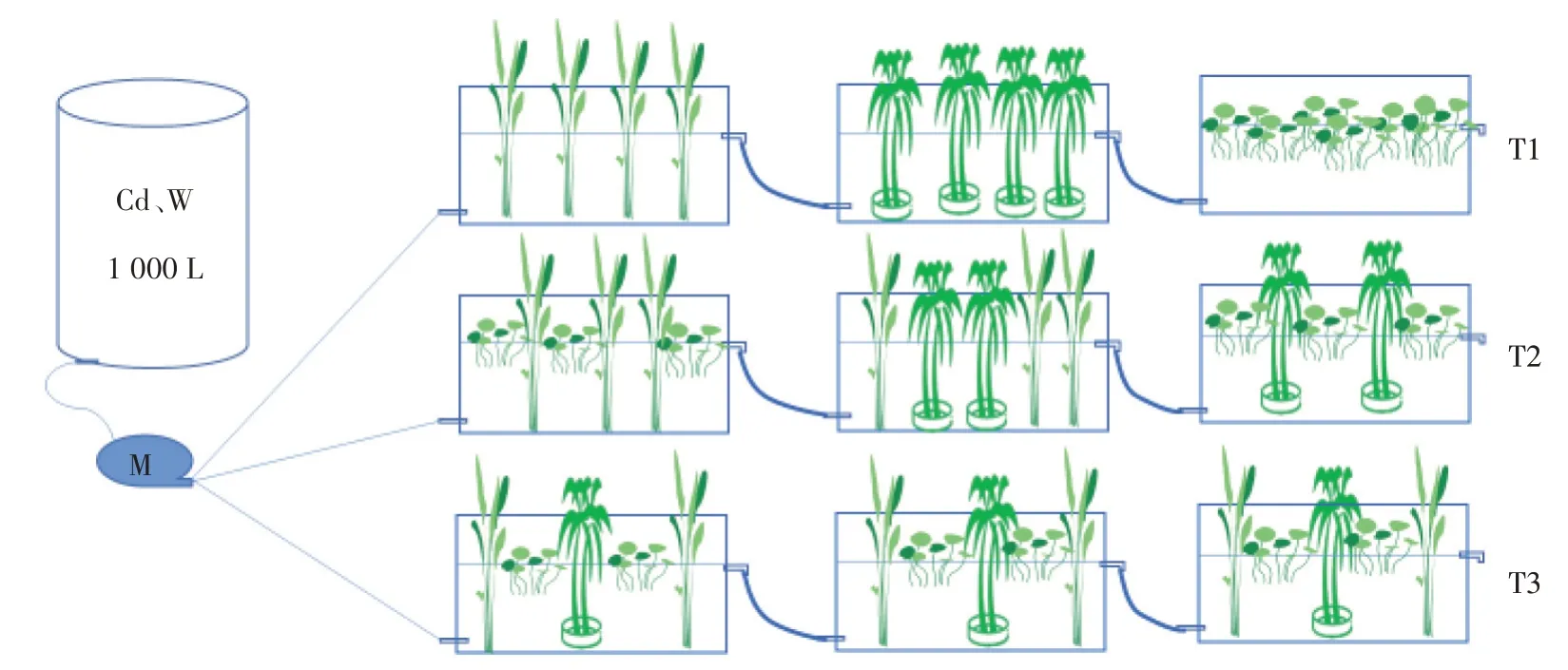
图1 三级模拟湿地处理示意图Figure 1 Schematic diagram of three-stage simulated wetland treatment
1.2 试验设计
试验所选水生植物是根据静态吸附预试验结果所选出的3 种常见水生植物:再力花、旱伞草、铜钱草,均购买于湖南省长沙市花卉市场,再力花选择株高1.2 m 左右,旱伞草选择株高0.8 m 左右,叶片嫩绿健康植株,铜钱草选择长势均匀,挺拔嫩绿植株。试验处理称取各植物鲜质量见表1。3 个处理箱底不铺设土壤和基质,用鹅卵石固定挺水植物根部,在水箱四壁加装弹力带辅助其保持挺立,采用霍格兰营养液水培方式,根据笔者在野外灌溉水净化监测点实验结果,水体中Cd平均浓度约为10µg·L-1,W 平均浓度约为70 µg·L-1,野外试点湿地的水力停留时间(HRT)12~36 h,故设计水力停留时间为24 h,进水Cd浓度为25µg·L-1、W 浓度为75µg·L-1,利用蠕动泵设置流速控制系统总水力停留时间。试验前10 d 每日采集一次水样,运行稳定后每周采集一次水样。试验时间为2021年8月至2022年1月。
1.3 样品采集与处理
1.3.1 水样采集
分别在模拟人工湿地进水口、一级湿地出水口、二级湿地出水口、三级湿地出水口各设置一个采样点,每次各点位采集100 mL水样,每次取样重复3次。
1.3.2 植物样采集
试验结束后采集各单元湿地内所有的试验植物。
1.3.3 沉积物样品采集
预计在试验结束后,各级湿地箱底会有沉积物产生,用200 目过滤筛小心采集湿地系统各湿地单元底部水培沉积物。
1.4 样品测定
1.4.1 水样测定
水样加硝酸酸化后经过0.45µm 微孔滤膜抽滤,然后直接测定其中水溶态Cd、W 含量;采用原子吸收分光光度计-石墨炉(GTA120,Varian,美国)测定Cd含量;采用ICP-OES(PE8300,美国)测定W含量。
1.4.2 植物样品的测定
采集的植物带回实验室后洗净,整株采集的植物分为茎叶部与根部,铜钱草不做处理,于(105±2)℃杀青1 h,65 ℃烘干后测干质量,粉碎装袋备用。植物样品在电热消解仪中采用混合酸(HNO3∶HClO4=4∶1,V/V)湿法进行消解。用ICP-OES(PE8300,美国)测定植物样品Cd、W的含量。
1.4.3 沉积物样品测定
为从机理上分析沉积物对水体中两种重金属的吸附,初步对沉积物表面形貌与化学官能团结构测定,采集水培产生的沉积物干燥处理后,分别使用场发射扫描电镜(SEM,Thermo Scientific Apreo 2C)、傅里叶红外吸收光谱仪(FTIR,Thermo Fisher Nicolet IS10)进行分析。
1.5 数据处理
所测数据采用Excel软件以及SPSS22.0软件完成数据处理和差异性显著分析,差异显著水平为0.05。
动态试验湿地各处理单元i对水中Cd的去除率
式中:P为模拟湿地各处理单元对湿地系统去除水体中Cd、W 的去除率;P0为湿地工艺系统对水体中Cd、W 的总去除率;Ni为第i个采样点的水体Cd、W浓度。
2 结果与分析
2.1 三级模拟人工湿地对水体中Cd的动态去除效果
由图2 可知,在试验开始的前15 d 左右,所有三级湿地处于运行适应期,出水Cd浓度小于10µg·L-1,符合《农田灌溉水质标准》(GB 5084—2018),但出水Cd 浓度大于5 µg·L-1。3 个湿地的出水Cd 浓度呈现下降趋势,进入九月后,所有三级模拟湿地进入运行稳定期,出水Cd的浓度均小于5µg·L-1,符合《农田灌溉水质标准》(GB 5084—1992)。T1、T2、T3 的平均出水Cd浓度分别为3.30、3.20、2.75µg·L-1,其中T3的平均去除率最高,达到了89.18%,T1、T2 的平均去除率分别为87.01%、87.41%。
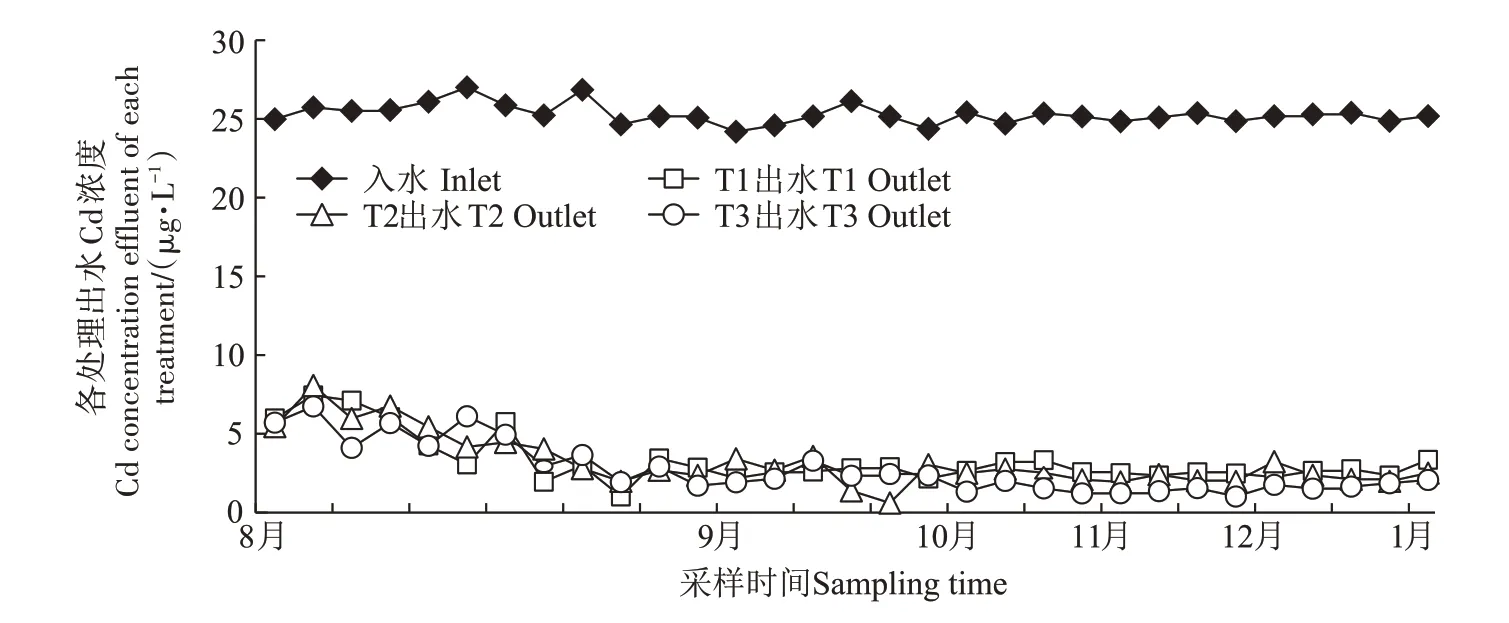
图2 动态模拟湿地实验进出水Cd浓度Figure 2 Dynamic simulation of Cd concentration in inlet and outlet water of wetland experiment
3 种处理湿地的进水口与各级出水口的Cd 浓度和去除率如图3、图4 所示,可以看出3 个处理的各个单级湿地出水口Cd 浓度呈现逐渐下降的趋势。T1的3 个单级湿地对水体Cd 的去除率分别为47.11%、13.42%、26.84%;T2的3个单级湿地对水体Cd的去除率分别为28.61%、21.53%、37.27%;T3 的3 个单级湿地对水体Cd 的去除率分别为24.24%、46.09%、18.85%,T1、T2、T3 三个处理各级单元之间去除率有显著差异,但总平均去除率差异不显著;3 个三级模拟湿地处理后的模拟废水中Cd的浓度均能达到灌溉水水质标准。
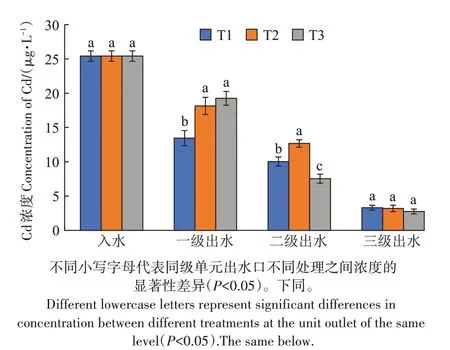
图3 三种处理各单元进出水Cd浓度Figure 3 Cd concentration of water in and out of each unit of the three treatments
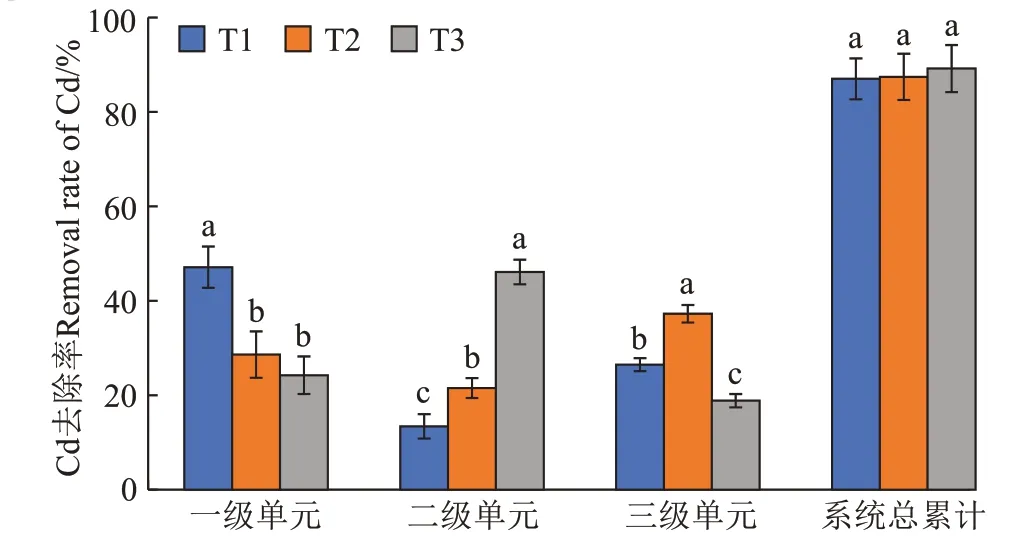
图4 三种处理各级单元及总累计Cd去除率Figure 4 Removal rate of Cd in three treatment levels of units and total cumulative
2.2 三级模拟人工湿地对水体中W的动态去除效果
由图5 可知,3 个三级湿地出水口的W 浓度明显降低。试验伊始,3 个三级湿地对水体中W 的去除效果存在一定的波动,而随着采样日期的推移,3 个湿地出水口水体W 浓度呈现出下降的趋势。由于尚未制定国家灌溉水安全标准中W 的标准,故从去除率和出水浓度来分析净化效果。T1、T2、T3 的平均出水W 浓度分别为24.02、20.14、26.75 µg·L-1,其中T2 的平均去除率最高,达到了73.36%,T1、T3 的平均去除率分别为68.24%、64.62%。
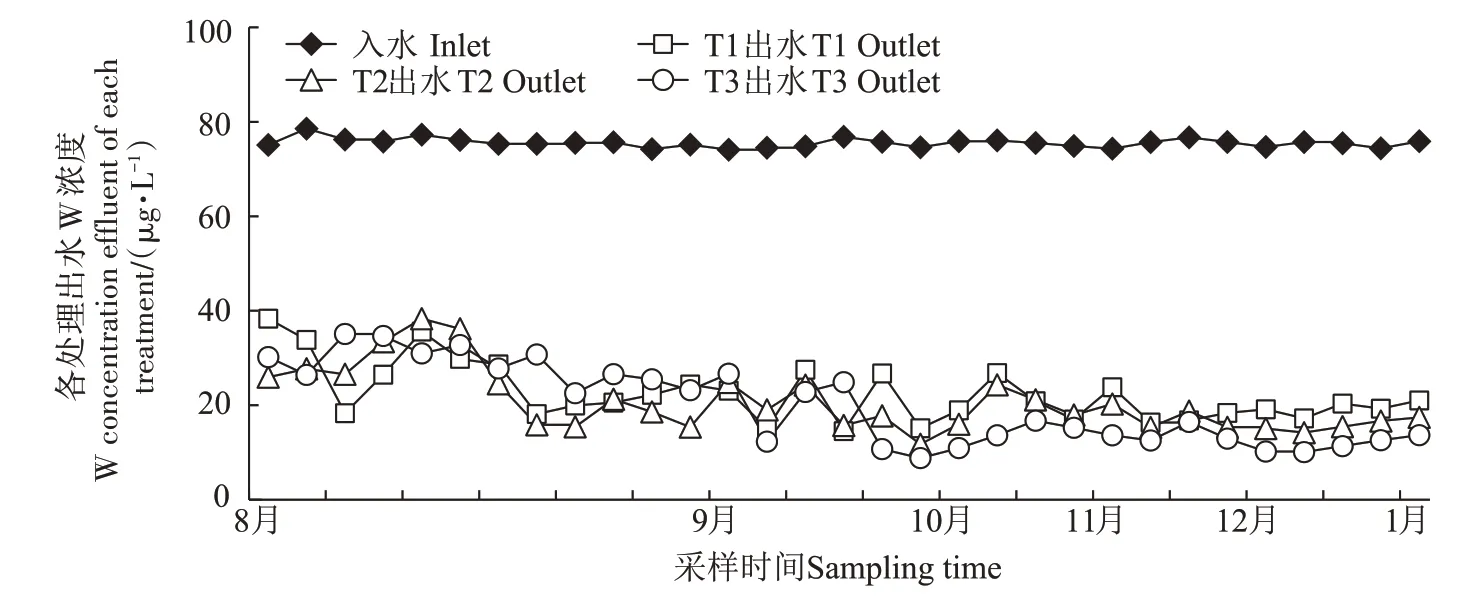
图5 动态模拟湿地实验进出水W浓度Figure 5 Dynamic simulation of W concentration in inlet and outlet water of wetland experiment
3 个处理湿地的进水口与各级出水口的W 浓度和去除率如图6、图7 所示,可以看出3 个处理的各级湿地出水口W 浓度呈现逐渐下降的趋势。T1 的3 个单级湿地对水体W 的去除率分别为27.56%、25.61%、15.07%;T2 的3 个单级湿地对水体W 的去除率分别为36.84%、15.45%、21.07%;T3 的3 个单级湿地对水体W 的去除率分别为23.72%、26.32%、14.58%,T1、T2、T3 三个处理各级单元之间去除率有显著差异,总平均去除率T2、T3 差异显著;模拟废水经过3 个三级模拟湿地处理后水体W 浓度显著降低,去除效果良好。
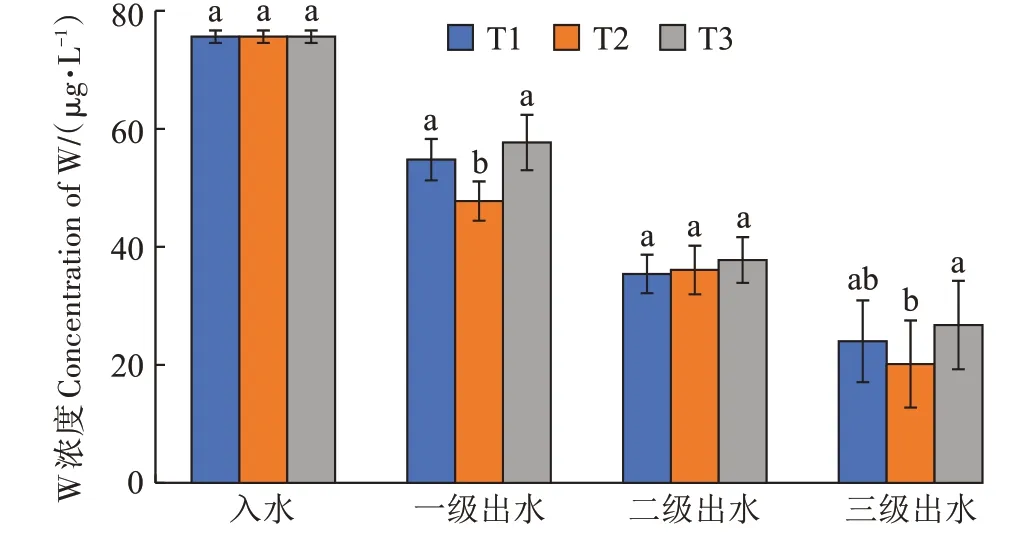
图6 三种处理各单元进出水W浓度Figure 6 W concentration of water in and out of each unit of the three treatments
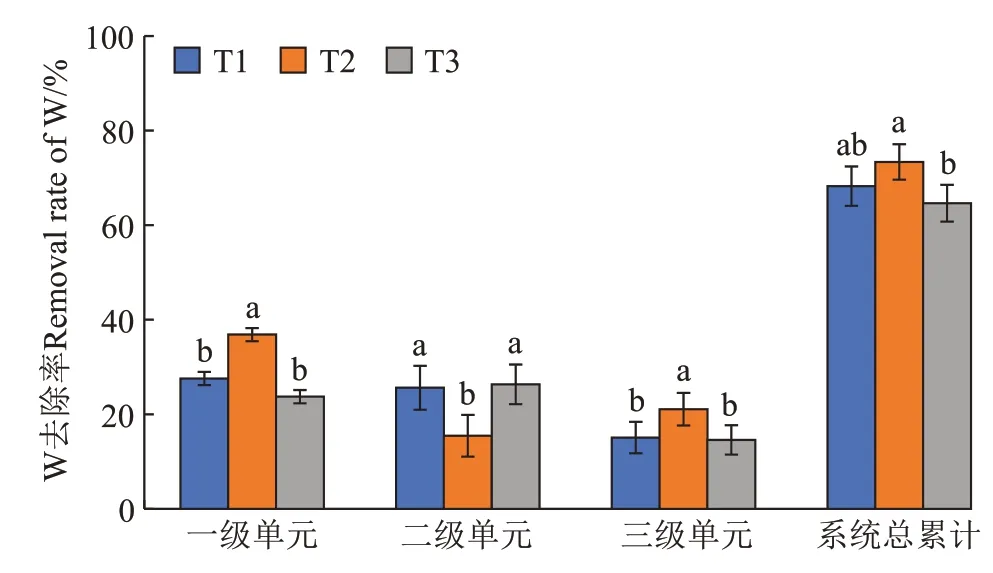
图7 三种处理各级单元及总W累计去除率Figure 7 Three treatment levels of units and total cumulative removal rate of W
2.3 湿地植物对Cd的富集
在试验期间,T1 处理系统Cd 输入总量约为375 mg;T1 处理平均出水Cd 浓度为3.30 µg·L-1,系统Cd截留总量为325.50 mg。由表2 可知,T1 处理植物总干质量为2 994.27 g,植物积累Cd总量为67.20 mg,植物截留部分的去除率为17.92%。T1 处理3 个单级湿地T1-1、T1-2、T1-3 植物总干质量分别为671.04、2 115.58、207.65 g,分 别 积 累 的Cd 总 量 为21.13、35.57、10.51 mg,T1 处理各级单元植物截留量分别占总去除量6.49%、10.93%、3.23%。
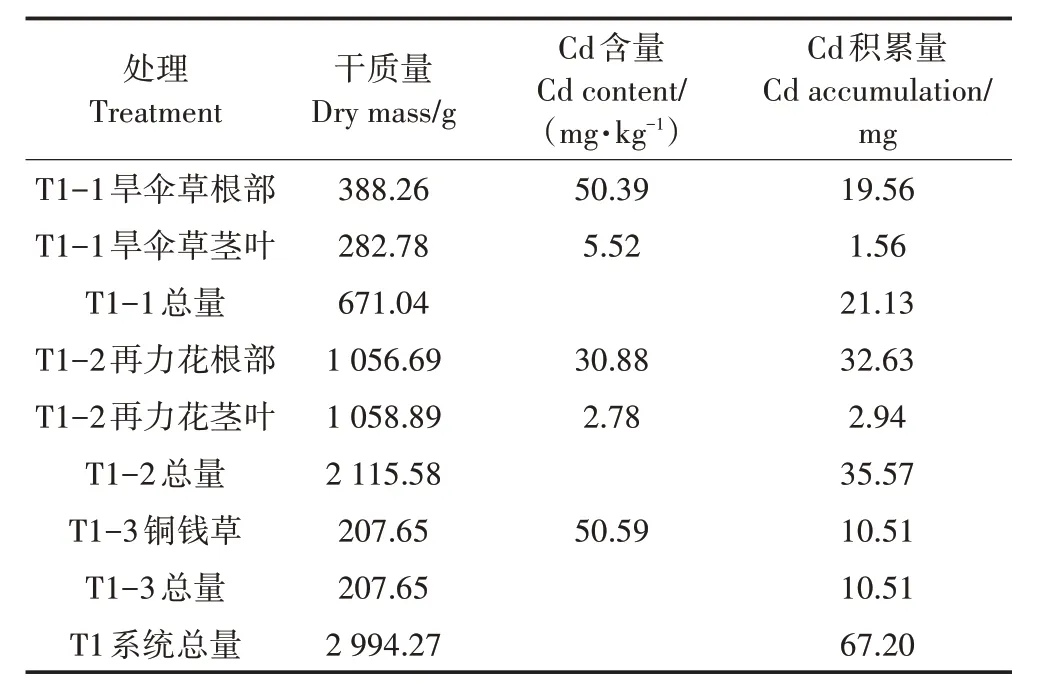
表2 T1处理植物的干质量、Cd含量以及积累量Table 2 Dry weight,Cd content and accumulation of T1 treated plants
T2 处理系统Cd 输入总量约为375 mg;T2 处理平均出水Cd 浓度为3.20 µg·L-1,系统Cd 截留总量为327.00 mg,由表3 可知,T2 处理植物总干质量为3 163.82 g,植物积累Cd 总量为86.68 mg,植物截留部分的去除率为26.51%。T2 处理三个单级湿地T2-1、T2-2、T2-3 植物总干质量分别为1 143.38、1 433.36、587.08 g,分别积累的Cd 总量为39.26、30.28、17.13 mg,T2 处理各级单元植物截留量分别占总去除量的12.01%、9.26%、5.24%。
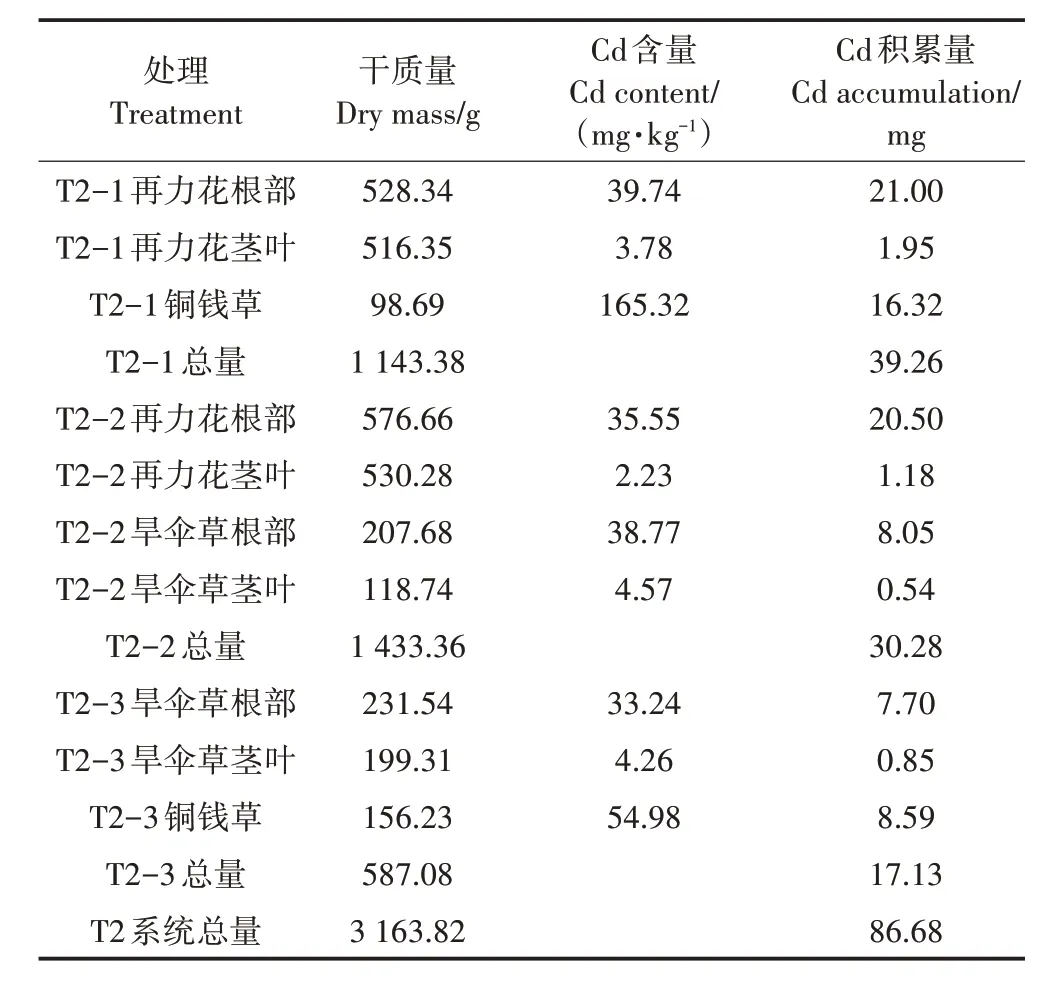
表3 T2处理植物的干质量、Cd含量以及积累量Table 3 Dry weight,Cd content and accumulation of T2 treated plants
T3 处理系统Cd 输入总量约为375 mg;T3 处理平均出水Cd 浓度为2.75 µg·L-1,系统Cd 截留总量为333.75 mg。由表4 可知,T3 处理植物总干质量为3 094.78 g,植物积累Cd 总量为102.66 mg,植物截留部分的去除率为27.38%。T3 处理3 个单级湿地T3-1、T3-2、T3-3 植物总干质量分别为977.02、979.34、1 138.42 g,分别积累的Cd 总量为40.81、34.73、27.13 mg,各单级湿地的去除率分别为10.88%、9.26%、7.23%。
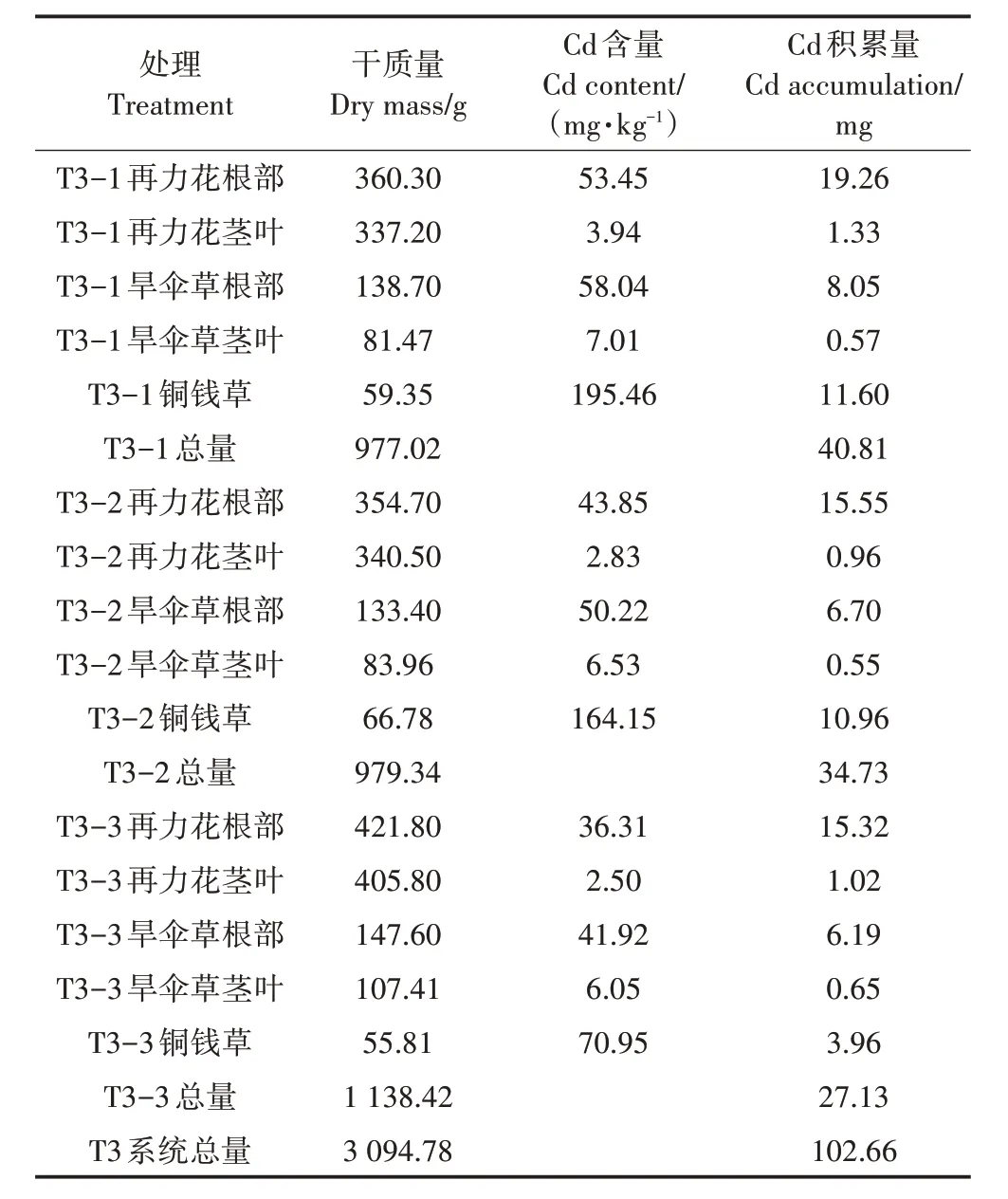
表4 T3处理植物的干质量、Cd含量以及积累量Table 4 Dry weight,Cd content and accumulation of T3 treated plants
2.4 湿地植物对W的富集
在试验期间,T1 处理系统W 输入总量约为1 125 mg;T1 处理平均出水W 浓度为24.02 µg·L-1,系统W截留总量为764.70 mg。由表5 可知,T1 处理植物总干质量为2 994.27 g,植物积累Cd 总量为281.46 mg,植物截留部分的去除率为25.02%。T1 处理3 个单级湿地T1-1、T1-2、T1-3 植物总干质量分别为671.04、2 115.58、207.65 g,分别积累的Cd 总 量 为148.20、69.17、64.09 mg,T1 处理各级单元植物截留量分别占总去除量的19.38%、9.05%、5.70%。
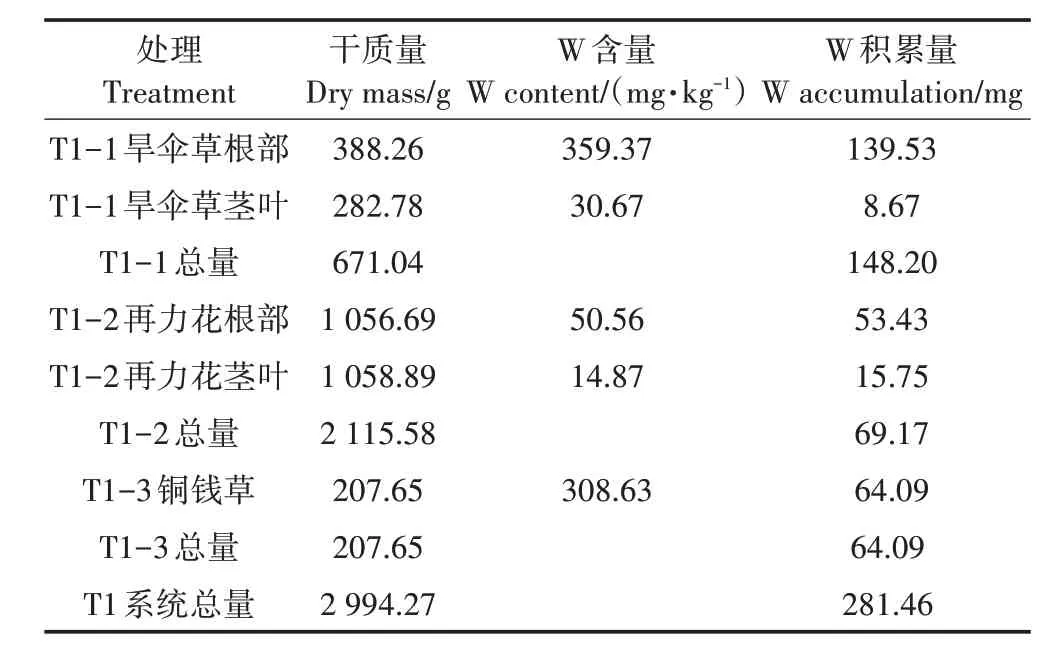
表5 T1处理植物的干质量、W含量以及积累量Table 5 Dry weight,W content and accumulation of T1 treated plants
T2处理系统W输入总量约为1 125 mg;T2处理平均出水W浓度为20.14µg·L-1,系统W截留总量为822.90 mg。由表6 可知,T2 处理植物总干质量为3 163.82 g,植物积累W 总量为317.67 mg,植物截留部分的去除率为28.24%。T2 处理三个单级湿地T2-1、T2-2、T2-3 植物总干质量分别为1 143.38、1 433.36、587.08 g,分别积累的W 的量为129.58、94.93、93.16 mg,T2处理各级单元植物截留量分别占总去除量的15.75%、11.54%、11.32%。
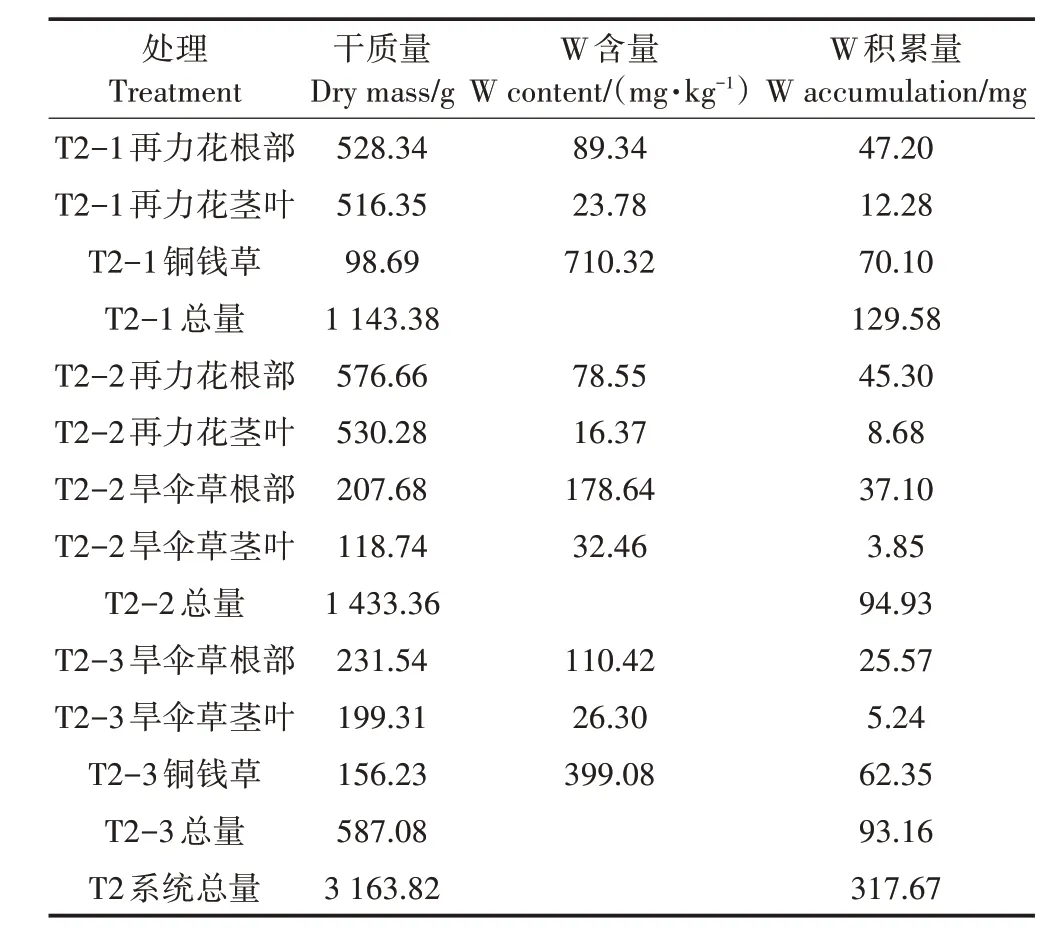
表6 T2处理植物的干质量、W含量以及积累量Table 6 Dry weight,W content and accumulation of T2 treated plants
在试验期间,T3 处理系统W 输入总量约为1 125 mg;T3 处理平均出水W 浓度为26.75 µg·L-1,系统W截留总量为723.75 mg。由表7 可知,T3 处理植物总干质量为3 094.78 g,植物积累W 总量为375.02 mg,植物截留部分的去除率为33.34%。T3 处理3 个单级湿地T3-1、T3-2、T3-3 分别积累W 总量为176.44、111.95、86.63 mg,T3 处理各级单元植物截留量分别占总去除量24.38%、15.49%、11.97%。
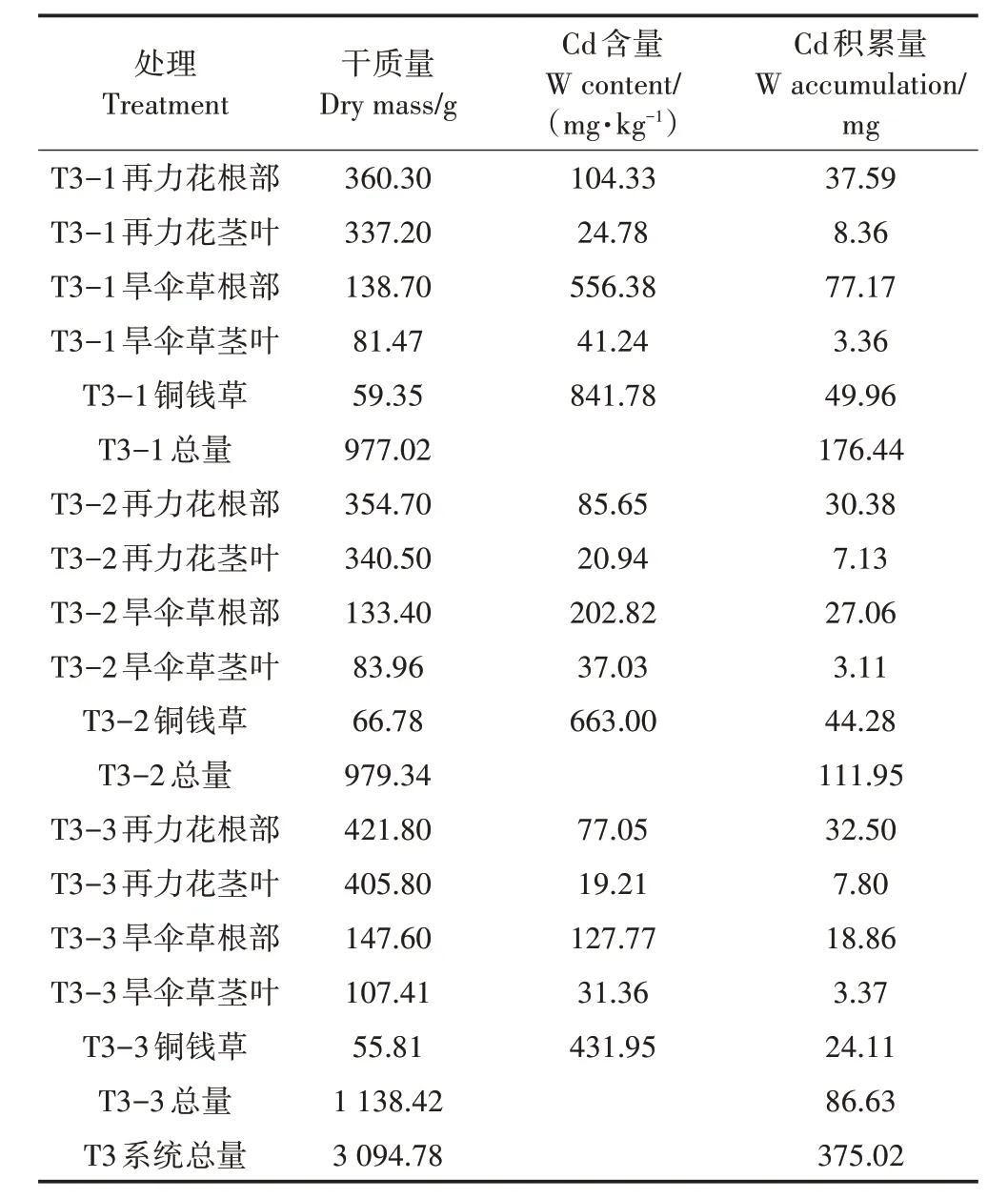
表7 T3处理植物的干质量、W含量以及积累量Table 7 Dry weight,W content and accumulation of T3 treated plants
2.5 湿地系统对Cd截留通量
三级模拟人工湿地的Cd 截留通量见表8。经计算,T1、T2、T3 系统外源输入Cd 总量约375 mg,经过模拟人工湿地系统净化后向外界的Cd输出量分别为49.50、48.00、41.25 mg,输 出 占比 分别为13.20%、12.80%、11.00%;植物截留量占比分别为17.92%、23.11%、27.38%;沉积物截留量占比分别为68.88%、64.09%、61.62%。从截留通量来看,沉积物吸附占比均在60%以上,说明该系统净化模拟废水中的Cd,沉积物吸附和生物絮凝沉淀起主要作用。
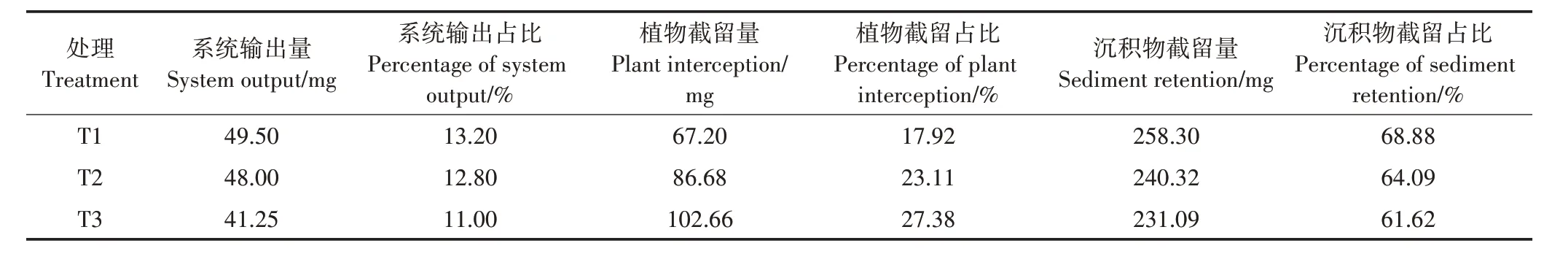
表8 湿地系统对Cd截留通量Table 8 Wetland system intercepts Cd fluxes
2.6 湿地系统对W截留通量
三级模拟人工湿地的W 截留通量见表9。经计算,T1、T2、T3 系统外源输入W 总量约1 125 mg,经过模拟人工湿地系统净化后向外界的W 输出量分别为360.30、302.10、401.25 mg,占 比 分 别 为32.03%、26.85%、35.67%;植物截留量占比分别为25.02%、28.24%、33.34%;沉积物截留量占比分别为42.95%、36.10%、31.00%。从截留通量来看,沉积物吸附占比约为30%~40%,植物积累占比约为25%~35%,说明该系统净化模拟废水中的W,沉积物吸附和植物吸收积累起相当作用。
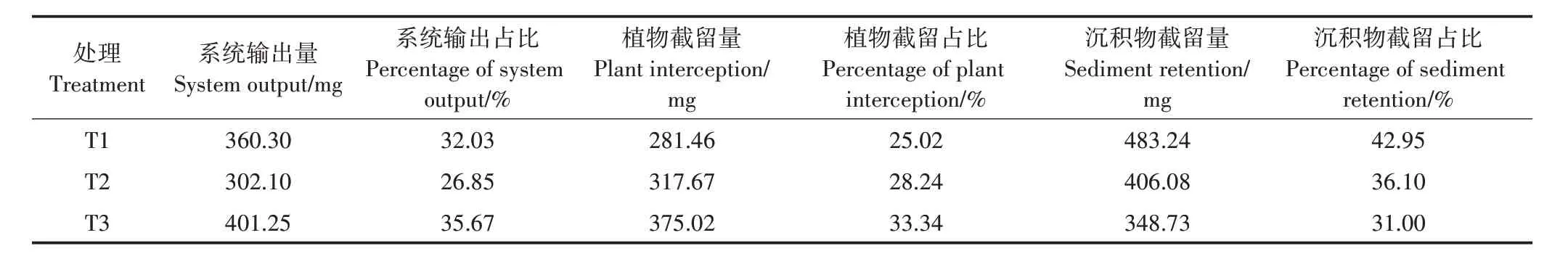
表9 湿地系统对W截留通量Table 9 Wetland system intercepts W fluxes
2.7 水培沉积物对Cd的吸附机理
实验过程中产生的沉积物吸附Cd的量超过总量的60%,吸附W 的量与植物吸收积累量相当,且在试验过程中,能观察到沉积物的量随着时间的推移明显增加,笔者认为沉积物与植物根系共同作用完成对重金属的吸附固定。因此,为初步探究沉积物对重金属的吸附机理,本研究对其进行了表征试验。图8 为SEM 表征结果图,由图8 可以看出沉积物呈现不规则小块状,上面分布有不均匀片状突出,且普遍存在。该结构较为粗糙且多褶皱,可以为吸附重金属的官能团提供大量位点,利于吸附反应的发生。

图8 沉积物扫描电镜图(×2 000倍)Figure 8 Scanning electron microscopy(SEM)of sediments(×2 000 times)
图9 为3个三级模拟人工湿地产生的沉积物的红外光谱图。由红外光谱图可以看出,9 个沉积物样品发生振动的波数相近,说明它们拥有相同的官能团。红外光谱图中几个主要的吸收峰分别在790、1 050、1 536、1 639、2 940、3 290 cm-1附近。其中,790 cm-1和2 940 cm-1附近的吸收峰是由C—H 伸缩振动引起的,说明沉积物中含有环烷烃或脂肪烃类化合物[18];1 050 cm-1附近的吸收峰是由伸缩振动引起的,说明沉积物中含有醚类化合物[19];1 536 cm-1附近的吸收峰是苯环骨架振动吸收峰,说明该沉积物中含有苯类化合物[20];1 639 cm-1和3 290 cm-1附近的吸收峰分别是—COOH和—OH[21],这两个官能团也被认为是沉积物吸附重金属最重要的两个官能团[22]。这些官能团在吸附过程中可以与Cd2+发生交互作用,最终可使Cd 与等离子产生沉淀[23]。此外,从各个处理第一级湿地到第三级湿地,官能团的吸收峰峰形发生了变化,进一步说明这些含氧官能团在吸附Cd 过程中发挥了作用,因此可以推断沉积物的有机组分在净化水体重金属的过程中发挥了重要作用。
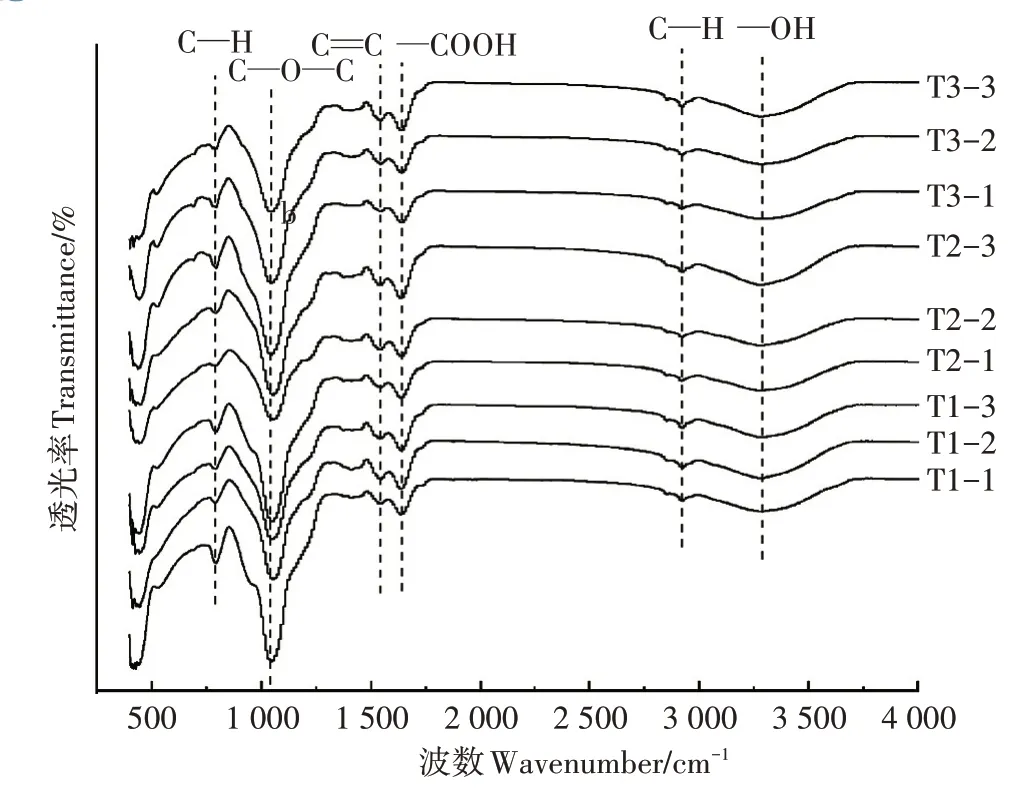
图9 水培沉积物的红外光谱图Figure 9 FTIR diagram of hydroponic sediments
3 讨论
构建人工湿地净化水体中重金属,是一种经济又高效的绿色生态治理方法,水生植物作为人工湿地不可或缺的部分,能为重金属的运输存储提供路径与场所,因此水生植物被誉为水体中重金属及营养物质的天然吸收体[24]。实验选择的3 种植物:再力花、旱伞草、铜钱草的根系都较发达,而水生植物的根系在水体重金属的净化过程中起着至关重要的作用[25]:一是可以吸收、转运、富集重金属;二是通过根系分泌物改变水环境的理化性质,影响重金属的沉淀,如有机酸、铁磷体等[26];三是可以为人工湿地系统中的微生物提供栖息繁殖的场所,丰富微生物的种类,促进吸收吸附重金属。本实验设置的是全程水培处理,没有铺设基质与底泥,有研究表明[27],植物在水培条件下,植物根系与重金属的接触更充分,发达的根系能保证植物对水体重金属的吸附与吸收效果。在试验开始初期,出水Cd的浓度并不能达到5µg·L-1以下,W的平均出水浓度约为35 µg·L-1左右,笔者认为这是因为试验初期,系统内各项理化指标处于适应稳定期,包括植物根系对环境的生长适应,根际微生物的生长繁殖,水培沉积物的产生和积累等。进入九月份后可以看出系统对模拟废水中两种重金属的净化效果逐步稳定,且去除率提高,对Cd的去除率基本保持在90%左右,对W 的去除率则保持在70%左右。植物的种植搭配可以影响湿地系统对重金属的净化效果,有学者研究表明[28],利用湿地系统净化水体中重金属的过程中,对植物进行合理的搭配种植,可显著提高湿地系统对Cd、Pb等重金属的净化效率。本研究中,T1、T2、T3 3 个湿地系统对Cd 的去除效果为T3>T2>T1,说明植物的混种搭配对系统净化效果起正作用,与他人的研究具有相似规律。但是植物的搭配对不同重金属的去除也并非一定起正面作用,如本研究中3 个系统对水中W 的净化效果为T2>T1>T3,这也许与植物搭配方式对W 不适用有关,因为植物的种植搭配是通过改变根际环境来影响修复[26,29],如根际微生物的活动、根系分泌物、pH 值和氧化还原电位,因此在人工湿地选择和种植水生植物时应先进行合理的预试验,筛选出最佳搭配使湿地系统净化效率最优化。
在试验结束后,对系统两种重金属进行了“源”与“汇”的分析。“源”是入水中添加的重金属,这是唯一途径;而“汇”有植物的吸收积累、沉积物的吸附沉淀以及出水这几个方面。从截留通量来看,植物对Cd、W 的截留量较高,分别占到了截留总量的27.38%和33.34%,有学者研究发现[30],植物在湿地净化系统中对污染物的去除量一般较低,只占到5%~10%;与之相比,本试验的植物截留量相对较高,这与何钟响等[31]的研究结果相似,其试验结果表明植物截留部分在总通量中占比为20%~25%,可能原因为其研究与本文的试验方法均是水培植物根系与污染物接触面增加,从而提高了植物对重金属的富集量。此外,沉积物对Cd、W 两种重金属的截留量占比分别为61.62%和31.00%,说明净化水体重金属的过程中,系统微环境中的生物絮凝沉淀作用很重要,尤其是对Cd 的截留,占了大部分的比例,因此,在利用人工湿地净化水体中重金属时,要重点关注底泥沉积物,为防范其解吸带来的风险,建议对所使用人工湿地定期清理底泥以及收割植物地上部分,将所富集的重金属带离系统再进行无害化处理。
试验结束后在各个单级湿地的试验箱底出现了絮凝状沉积物,而本试验采用植物水培模式进行,并未向系统添加任何有吸附效果的材料,因而箱底的沉积物是一种试验过程中自发形成的产物,其可能是由植物根系分泌物与代谢脱落物、茎叶部的自然凋落物、水中浮游生物、微生物及其代谢产物以及大气沉降颗粒等多方面因素混合形成的絮凝状产物。有学者[32]研究发现湿地充当基质的砾石表面有一层沉积物,推断其可能为水体中的悬浮颗粒物与植物凋落物的混合物,积累了较高浓度的Cd,此研究与本试验过程中产生的沉积物具有相似性。沉积物含有的化学成分包括黏土矿物、铁锰氧化物、铝水合氧化物、有机物、硫化物及碳酸盐等[22],其中有机物部分被大多学者认为是沉积物吸附重金属的关键,早期已有学者对沉积物中的活性组分进行了相关研究,廖文卓等[33]通过分离沉积物中的有机部分对Cd2+、Pb2+、Cu2+进行吸附试验,发现腐殖质可以快速高效地吸附重金属离子,对重金属的迁移转化具有显著的影响。刘亮等[34]利用选择性萃取法研究表层沉积物的主要化学组分对重金属的吸附特征时,得出其中的有机质以及铁锰氧化物是影响重金属吸附的主要成分。从本文中沉积物的红外光谱图也可以看出—COOH、—OH 是吸附重金属离子的两个重要官能团,它们的存在也可以说明沉积物有机组分是吸附重金属的“主力”,这也与以上学者的研究结果类似。虽然沉积物在净化过程中起了重要的作用,但其不稳定,沉积物在水体净化过程中既充当“汇”储存重金属,同时也有可能充当“源”释放出重金属,源与汇之间的转换主要取决于沉积物的粒径大小,其一定程度上决定了重金属的迁移、吸附、沉积等活动[35],有研究表明[36],沉积物中重金属主要集中在粒径<63 µm 部分,水体中粒径<45µm归为溶解态重金属,粒径在45~63µm之间颗粒物的重金属归为悬浮态重金属,重金属的迁移过程会受载体变化的影响。野外底泥沉积物在吸附重金属的过程中容易受到降雨、水生生物搅动以及人为生产活动等因素影响,吸附重金属的底泥被扰动从而容易使重金属解吸出来[37],此时底泥沉积物不再是“汇”,而是转变为“源”,虽然水生植物的存在可以抵消部分影响,但还是值得对底泥的解吸作用带来的风险进行考察,因此未来可从针对沉积物的解吸以及对野外人工湿地实验底泥沉积物进行长期监测等方面开展工作。
4 结论
(1)水培条件下的三级模拟人工湿地系统能有效净化水体中的Cd 和W,其中3 种植物混搭的T3 处理对Cd 的去除效率最高,达到了89.18%;植物两两混搭处理的T2 处理对W 的去除效率最高,达到了73.36%。
(2)3种水生植物均能有效富集Cd和W,对Cd和W 富集效果最好的是铜钱草,最高浓度分别为195.46、841.78 mg·kg-1。
(3)沉积物的吸附作用在净化过程中起了重要作用,对Cd 的截留通量占比60%~70%,对W 的截留通量占比30%~45%;对Cd、W 两种重金属的吸附以沉积物有机部分的作用为主,其中有效官能团包括—OH、—COOH 、、C —O—C。