集落刺激因子1 在子宫内膜癌细胞中的表达及其意义
金纬纬,林一禾,庄晓苹,赵小迎
有研究显示肿瘤干细胞(CSCs)在子宫内膜癌的发生、发展、复发和耐药性等方面具有至关重要的作用[1-4]。但是如何精确识别、追踪及靶向杀伤CSC是临床治疗子宫内膜癌的关键。集落刺激因子1(CSF1)是机体内微环境中如肿瘤微环境和骨髓微环境常见的造血生长因子,其在血液系统中参与了多种免疫反应过程,可刺激造血祖细胞生长与分化,而在肿瘤微环境中,过往的研究显示CSF1 在肿瘤细胞的侵袭迁移、免疫逃逸、脂质代谢、血管发生和炎症反应中发挥重要作用[5-8]。有研究显示,CSF1 也表达于各类实体肿瘤细胞中,尤其在CSCs 中呈现高表达[9],但CSF1 在子宫内膜癌中的相关研究报道较少。本研究探讨CSF1 在子宫内膜癌细胞中的表达情况,揭示其在子宫内膜癌发生发展中的作用,现报道如下。
1 资料与方法
1.1 主要试剂及仪器 RPMI-1640 培养基(Gibco公司);胎牛血清(Excell 公司),TRizol(Invitrogen);Annexin V-FITC/PI 细胞凋亡检测试剂盒(eBioscience 公司),SYBR Green PCR Kit(BD 公司),anti-CSF1 抗体(Abclonal 公司),anti-rabbit-IgG(Sigma公司),NC 模(上海时代生物科技有限公司),SDSPAGE 凝胶预制胶试剂盒(碧云天生物技术有限公司),Tween-20(上海生工生物工程有限公司),质粒pSPAX2、pMD2G、shRNA、人肾上皮细胞系293T细胞由温州医科大学附属第一医院内科实验室保存。超净细胞工作台和细胞培养箱(Thermo),低温高速离心机(Hettich),移液器(Eppendorf),流式细胞分析仪(FACS Calibur),数字化成像设备(GE Healthcare),荧光倒置显微镜(Nikon),BIO-RAD凝胶电泳系统(伯乐公司)。细胞株实验组:子宫内膜癌Ishikawa 细胞(腺癌);对照组:正常内膜细胞系ECT1/E6E7细胞,宫颈癌细胞株Hela细胞株(腺癌),乳腺癌细胞株MCF7、胃癌细胞株SGC-7901、结肠癌细胞系SW620。上述所有细胞株由温州医科大学附属第一医院中心实验室赠送。本研究经温州市中西医结合医院医学伦理委员会审批通过。
1.2 方法
1.2.1 CSF1 mRNA 水平表达检测 采用实时荧光定量聚合酶链式反应法(real-time PCR)检测CSF1基因表达情况。1×106Ishikawa 细胞和1 ml Trizol 混合,按Trizol 说明书抽提细胞RNA。CSF1 引物跨内含子,所有引物序列由上海生工生物工程公司合成。引物:CSF1(108 bp):上游5’- TGGCGAGCAGGAGTATCAC-3’,下游5’- AGGTCTCCATCTGACTGTCAAT-3’;ACTIN(101 bp):上游5’-AGAGCTACGAGCTGCCTGAC-3’;下游5’-AGCACTGTGTTGGCGTACAG-3’;BCL-2(108 bp):上游5’- GGTGGGGTCATGTGTGTGG-3’,下游5’- CGGTTCAGGTACTCAGTCATCC-3’;BCL-X(108 bp):上游5’- GAGCTGGTGGTTGACTTTCTC-3’,下游5’-TCCATCTCCGATTCAGTCCCT3’;BAD(108 bp):上游5’-CCCAGAGTTTGAGCCGAGTG-3’,下 游 5’-CCCATCCCTTCGTCGTCCT-3’;BAK(108 bp):上游5’-AGCAATGATCTGTTCACAACCG-3’,下 游 5’-CGCCATGTATAGCCCAGGC-3’;BAX(108 bp):上游5’- CCCGAGAGGTCTTTTTCCGAG-3’,下 游 5’-CCAGCCCATGATGGTTCTGAT-3’。反应在10l 的体系中进行,其中2×实时荧光定量PCR 混合液5l、10mol/L的上下游引物各0.2l、样本cDNA1(l50ng)、高压处理过的去离子水3.8l。热循环如下:95 ℃5 min;95℃30s,60℃30s,72℃40s,32 个循环;72℃5min。应用2- Ct法分析mRNA 相对表达水平。
1.2.2 CSF1 蛋白表达检测 采用免疫印迹法检测CSF1 蛋白在子宫内膜癌细胞中的表达情况。采用含有蛋白酶抑制剂RIPA蛋白裂解液,按照说明书提取细胞内总蛋白量。采用BIO-RAD 凝胶电泳系统,置于足量的电泳液中,根据测得的蛋白浓度上样,10%SDS-PAGE 胶电泳,恒压80 V,90 min;电泳结束,将样品转移至NC 膜,恒流220mA,持续90min。用PBS 配置5%脱脂牛奶,室温封闭1h,然后用PBS配置2%牛血清白蛋白按相应浓度稀释抗体,4 ℃轻摇孵育过夜。第2天,回收一抗,用含有0.1%Tween-20的TBST 洗NC 膜5 min,洗3 次;使用PBS 配制2%BSA,稀释二抗,NC膜室温孵育二抗1h,然后用含有0.1%Tween-20 的TBST 洗NC 膜5 min,共3 次。凝胶图像采集及分析:采用CCD 摄像头,Quantity One凝胶图像处理系统,分析得出蛋白表达水平。
1.2.3 慢病毒shCSF1 制备 1.5×106293T 细胞接种到10 cm 细胞培养皿中,加入10 ml DMEM 培养液(含10%FBS)中;24h后,将质粒pSPAX2、pMD2G和目的基因敲除shRNA 质粒(敲除组)或对照组质粒,按照3∶1∶4 比例分别加入1.5ml无菌EP管中,再加入2.5mmol/L 氯化钙50l,并用灭菌水补至500l,吹打混匀;将配置好的混合液逐滴加入500l 2×HBS,放置于室温静置30min。将上述混合液缓慢、逐滴加入至293T 细胞培养液中,4 h 后,换液,用10 ml 新鲜DMEM 培养液(含10%FBS)更换原培养液;48 h 后,收取该293T 培养液上清液即慢病毒上清液。
1.2.4 构建CSF1 敲除的子宫内膜腺癌细胞系 将1×105/ml 子宫内膜腺癌Ishikawa 细胞,接种至6 孔板,24 h后弃去孔内原先培养基,将对照组及shCSF1慢病毒上清液加入孔内,37 ℃2 000 r/min 离心感染2 h,用实时荧光定量PCR 法和免疫印迹法检测感染shRNA 后CSF1 mRNA 和蛋白表达水平,检测shCSF1 敲除效率。采用流式细胞仪,分选绿色荧光蛋白阳性细胞,并绘制细胞增殖曲线检测细胞增殖情况。
1.2.5 细胞凋亡染色 1×106子宫内膜癌细胞,1000 r/min 离心5 min,弃上清液;用1×缓冲液(100l)重悬细胞,加入2l Annexin V 和PI,室温下避光孵育30 min。1 000 r/min 离心5 min 沉淀细胞,1×缓冲液洗1 次,立即用流式细胞仪检测分析。
1.2.6 BAX特异性抑制剂BAI1 处理子宫内膜癌细胞 BAX 特异性抑制剂BAI1 用DMSO 溶解,处理子宫内膜癌细胞系Ishikawa 细胞浓度为1m,作用时间为24 h。
1.3 统计方法 采用SPSS20.0 统计软件进行数据分析,利用GraphPadPrism7 软件制作数据统计分析图,实验数据均来自3 个以上独立样本,每个样品至少独立重复3 次结果,两组比较采用独立样本t 检验,多组比较采用单因素方差分析与Tukey 多重检验。P <0.05 表示差异有统计学意义。
2 结果
2.1 CSF1 在子宫内膜癌细胞中的表达情况 子宫内膜癌细胞系Ishikawa细胞的CSF1 表达水平均高于正常内膜细胞系及其他肿瘤细胞,而在mRNA表达水平上,子宫内膜癌细胞Ishikawa 中CSF1 相对表达水平均高于正常内膜细胞ECC、MCF-7、SGC-7901、HELA 及SW620(均P <0.05),见图1 ~2。
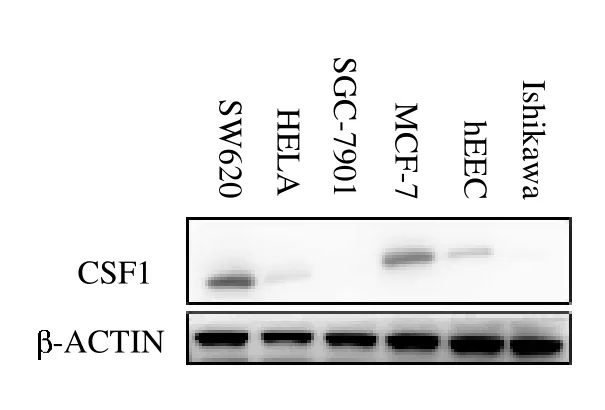
图1 CSF1 在肿瘤细胞中蛋白表达水平
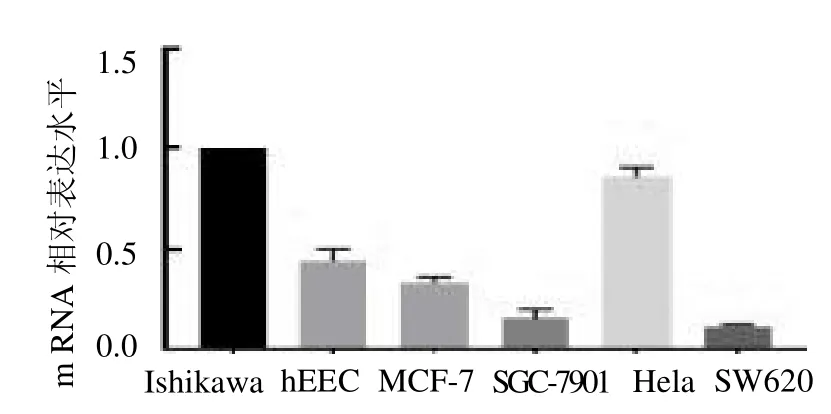
图2 CSF1 在肿瘤细胞中mRNA 表达水平
2.2 敲除CSF1 可诱导子宫内膜癌细胞增殖抑制敲除CSF1 子宫内膜癌细胞系,构建2 条shCSF1 慢病毒载体,感染子宫内膜癌细胞系Ishikawa后,发现CSF1 mRNA 及蛋白表达水平均呈现下降趋势(均P<0.05),见图3 ~4。同时获取CSF1 敲除的子宫内膜癌细胞系,并对子宫内膜癌细胞增殖速率进行监测,与对照组细胞相比,CSF1 敲除组子宫内膜腺癌细胞增殖受到抑制,见图5。

图3 靶向CSF1-特异性shRNA蛋白水平敲除效率

图4 靶向CSF1-特异性shRNA mRNA 水平敲除效率

图5 CSF1 敲除子宫内膜癌细胞增殖曲线
2.3 敲除CSF1 可诱导子宫内膜癌细胞凋亡 与对照组细胞相比,CSF1 敲低组Ishikawa细胞中细胞凋亡的水平上调,shCSF1-#1 和shCSF1-#2 组细胞凋亡率分别为45.04%和18.84%,均高于对照组Scramble组的3.32%(均P <0.05),见图6 ~7。

图6 子宫内膜癌细胞敲除CSF1 后凋亡水平染色
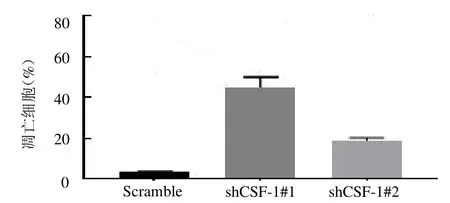
图7 子宫内膜癌细胞敲除CSF1 后凋亡水平
2.4 CSF1 通过激活凋亡促进因子BAX 诱导子宫内膜癌凋亡 结果显示凋亡促进因子BAX 在CSF1敲除子宫内膜癌细胞中表达水平升高,见图8;利用BAX 特异性抑制剂BAI1,加入CSF1 敲除组子宫内膜癌细胞培养基中,CSF1 敲除组子宫内膜癌细胞生长抑制得到缓解,见图9;流式细胞染色结果也显示在加入BAX特异性抑制剂后,CSF1 敲除组子宫内膜癌细胞凋亡水平受到抑制(P<0.05),见图10 ~11。

图8 CSF1 敲除子宫内膜癌细胞凋亡相关基因表达

图9 CSF1 敲除子宫内膜癌细胞加入BAX特异性抑制剂后细胞增殖曲线

图10 CSF1 敲除子宫内膜癌细胞加入BAX 特异性抑制剂后凋亡水平染色

图11 CSF1 敲除子宫内膜癌细胞加入BAX 特异性抑制剂后凋亡水平
3 讨论
集落刺激因子家族是一类广泛参与机体免疫反应过程的细胞生长因子。以往的研究显示CSF1 常表达于免疫相关细胞中,作为一类分泌性蛋白生长因子,参与调控多种免疫反应。其主要功能是通过识别免疫相关细胞表面特异性的受体蛋白,向免疫相关细胞内传递免疫抑制性信号,诱导免疫细胞功能及活性抑制,维持机体内免疫系统动态平衡。但是这种调控方式一方面可维持机体正常的免疫功能,而在特殊环境中,如肿瘤微环境中,可造成肿瘤细胞免疫逃逸,诱发机体肿瘤发生。有研究报道,CSF1 在肿瘤细胞中也呈现差异性表达,CSF1 对肿瘤干细胞在体内外自我更新能力的维持具有重要作用[10]。相关研究显示CSF1 也在神经系统、造血系统及各类型肿瘤组织等不同组织来源的细胞中表达[11],但其在这些细胞中,特别是在肿瘤干细胞中的作用、功能及调控机制尚未阐明[12]。
有研究显示,mir-1254 通过抑制CSF1 表达,抑制神经胶质瘤细胞增殖、侵袭、迁移及诱导肿瘤细胞凋亡[13]。而在肺癌中,也有研究者发现抑制CSF1 表达可显著抑制肺癌细胞的骨转移过程[9]。而在乳腺癌细胞中CSF1 高表达可以诱导肿瘤相关巨噬细胞,并促进乳腺癌的侵袭与迁移[14]。Aharinejad 等[15]研究显示,乳腺癌患者血清中CSF1 水平越高,患者预后越差。而现有的关于CSF1 对肿瘤细胞的作用机制研究主要集中在CSF1 家族成员参与免疫调节方面的作用[16],但其针对CSCs本身功能和调控机制的研究较少,因而进一步剖析CSF1 在CSCs 中的功能及其调控机制,对于临床治疗肿瘤具有重要意义。
本研究结果显示CSF1 在子宫内膜癌细胞中高表达;同时利用特异性shCSF1 慢病毒敲除技术靶向下调CSF1 表达,敲除组Ishikawa 细胞生长减慢,肿瘤细胞凋亡。这揭示了CSF1 诱导子宫内膜癌细胞凋亡,抑制其增殖。而在机制上,本研究发现CSF1-BAX 信号通路调控子宫内膜癌细胞凋亡过程,同时发现其它凋亡相关BCL 家族蛋白成员,在CSF1 敲除后,也发生了变化,但是具体调控机制并不清楚;而凋亡相关BCL 家族蛋白成员多数位于线粒体内,与线粒体功能密切相关。CSF1 敲除诱导的子宫内膜癌细胞凋亡是否与其细胞内线粒体功能变化相关,是否会引起线粒体相关的代谢调控变化,是否能利用BCL 家族特异性抑制剂靶向杀伤肿瘤细胞或与常规化疗药物联合用药,克服临床放化疗耐受或肿瘤细胞免疫逃逸及肿瘤复发等瓶颈,上述3 方面将是后续探究CSF1 在子宫内膜癌发生、发展中的作用及其调控机制的重要方向。另一方面,肿瘤的发生发展除了肿瘤细胞内在因素外,肿瘤微环境也是调控子宫内膜癌细胞的重要因素,目前研究主要集中在CSF1 蛋白家族成员参与免疫调节方面[16],因而进一步剖析CSF1 在肿瘤微环境中对CSCs 的调控机制,也将是后续的重要研究方向。

