黄绿卷毛菇胞外多糖发酵条件的优化及其生物活性研究
吴梦园 徐慧敏 张 鑫 朱青永 陈宇杰 陈启和 刘政捷,,*
(1浙江海洋大学食品与药学学院,浙江 舟山 316022;2浙江大学食品科学与营养系,浙江 杭州 310058)
真菌胞外多糖(extracellular polysaccharides,EPS)是一种由微生物在其生长代谢过程中分泌到细胞外的天然水溶性大分子物质[1]。EPS 具备多种生物学功能,包括抗癌、抗氧化、抗炎、免疫调节、保湿、降血糖、降血脂等,已广泛应用于食品、生物医学、化妆品和制药行业[2-4]。据报道,裂褶菌多糖有助于预防高胆固醇血症和糖尿病等多种疾病,并降低化疗的副作用,还可作为护肤品添加剂用于保湿和抗衰老[5-6]。香菇多糖、灵芝多糖等其他真菌多糖均被报道具有潜在的免疫调节、抗肿瘤和抗癌活性[7-8]。因此,开发野生珍稀食药用菌的生物资源在满足人们对活性成分的需求方面具有很大的前景。
黄绿卷毛菇(Floccularialuteovirens),又叫黄蘑菇,属于担子菌门(Basidiomycota),伞菌纲(Agaricomycetes),伞菌目(Agaricales),伞菌科(Agaricaceae),卷毛菇属(Floccularia)[9],是我国青藏高原特有的一种珍稀食药用菌,富含多糖、麦角硫因、黄酮、生物碱等多种生物活性成分[10-12],具有显著的抗炎、抗辐射、抗氧化、抗癌等生理功能[13]。作为一种传统的藏药,黄绿卷毛菇经常被用于治疗神经衰弱、头晕、失眠、头痛等症状[14]。多糖作为其中主要的生物活性成分之一,已被证实具有抗氧化和抗肿瘤作用[11]。但由于黄绿卷毛菇特殊的生长环境和生理特性,其子实体每年只能收获一次,因此从子实体中提取多糖成本较高。相比于从子实体中提取多糖,利用液体深层发酵产胞外多糖的方法不仅有利于资源的可持续发展,起到保护种子资源和环境的目的,而且具备发酵条件易于控制等优势,可获得更高的经济效益。因此,通过优化深层发酵条件来提高黄绿卷毛菇胞外多糖(Floccularialuteovirensexopolysaccharide,FLEP)产量的方法具有重要意义。
本研究在黄绿卷毛菇液体发酵过程中,采用在培养基中添加表面活性剂吐温80、微颗粒氧化铝,并利用超声辅助的方法来提高FLEP 产量。在单因素试验的基础上,采用响应面法优化FLEP 的积累,并探究FLEP的体外抗氧化活性及吸湿保湿特性,旨在为促进黄绿卷毛菇液体发酵生产胞外多糖及其在食品、药品和化妆品行业的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株 黄绿卷毛菇菌株WMY10 由浙江大学陈启和教授提供。
1.1.2 试剂 葡萄糖、磷酸氢二钾、乙醇、吐温80、硫酸、磷酸二氢钾、七水合硫酸镁、苯酚、甲醇(分析纯),国药集团(上海)化学试剂有限公司;酵母浸粉、中性氧化铝微颗粒,上海麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)、丁基羟基茴香醚(butylated hydroxyanisole,BHA)、乙二胺四乙酸二钠盐(ethylenediaminetetraacetic acid disodium salt dihydrate,EDTA-2Na),上海阿拉丁生化科技有限公司;总抗氧化能力检测试剂盒[2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸,2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonicacid),ABTS],南京建成生物工程研究所。
1.2 仪器与设备
LRH-70 恒温培养箱,成都苏净科学器材有限公司;LDZF-50KB 高压灭菌锅,爱宝来(济南)医疗科技有限公司;SW-CJ-2FD 超净工作台,上海昕仪仪器有限公司;HYC-A 全温摇床,上海玺袁科学仪器有限公司;FC 全自动酶标仪,赛默飞世尔(上海)仪器有限公司;KQ-500E 型超声波清洗机,昆山市超声仪器有限公司。
1.3 试验方法
1.3.1 黄绿卷毛菇菌株的培养 菌株的培养:将WMY10 接种于PDA 平板上,于恒温培养箱中25 ℃培养10 d。种子液的培养:用接种铲从长满菌丝体的平板上取大小约为0.5 cm2的菌丝体5块接种于液体培养基中,25 ℃、120 r·min-1条件下培养14 d (液体培养基包括[15]:葡萄糖31.26 g·L-1,磷酸氢二钾1 g·L-1,酵母提取物1.06 g·L-1,磷酸二氢钾0.5 g·L-1,七水合硫酸镁0.45 g·L-1)。液体发酵培养时,按接种量10%(v/v),取种子液10 mL 接种于90 mL 液体培养基中,于25 ℃、120 r·min-1条件下在恒温摇床中培养25 d。
1.3.2 菌丝体生物量和胞外多糖含量的测定 发酵结束后,采用抽滤的方法将菌丝体和发酵液分离。用蒸馏水将菌丝体清洗3 次以除去培养基成分,烘干至恒重后计算菌丝体生物量。发酵液于5 000 r·min-1离心20 min 后收集上清液,加入无水乙醇充分混匀,4 ℃醇沉24 h。将醇沉的液体于5 000 r·min-1离心15 min取沉淀,用适量蒸馏水溶解,采用硫酸-苯酚法[14]测定胞外多糖含量。
1.3.3 微颗粒对菌丝体生物量和胞外多糖含量的影响 选取不同粒径的氧化铝微颗粒(60~100、100~200、200~300、300~400 目),添加到液体培养基中(含有0.4 g·L-1吐温80)至质量浓度为10 g·L-1。将种子液按照10%的接种量接入液体培养基中,于25 ℃、120 r·min-1条件下在恒温摇床中培养6 d 后取出超声波处理15 min,放入摇床中继续培养19 d。取出测定菌丝体生物量和胞外多糖含量,探究加入微颗粒的最适粒径。
1.3.4 超声时间对菌丝体生物量和胞外多糖含量的影响 在接种发酵后的第6 天开始用超声波分别处理0、5、10、15、20、25 min,然后放入摇床中继续培养19 d(液体培养基中含有0.4 g·L-1吐温80,200~300目氧化铝10 g·L-1),培养结束后取出测定菌丝体生物量和胞外多糖含量,探究最适超声时间。
1.3.5 吐温80 对菌丝体生物量和胞外多糖含量的影响 将种子液接入含有不同质量浓度吐温80(0、0.2、0.4、0.6、0.8、1.0、2.0,3.0 g·L-1)的液体培养基,放入摇床中培养25 d (液体培养基含有200~300 目氧化铝10 g·L-1,超声处理15 min),测定菌丝体生物量和胞外多糖含量,探究加入吐温80的最适质量浓度。
1.3.6 响应面试验设计 基于上述单因素试验结果,以胞外多糖含量(Y)为响应值,选取吐温80 质量浓度(A)、微颗粒粒径(B)、超声时间(C)3 个因素,根据Design Expert 10.0.7 软件中Box-Behnken Design 原理对其进行响应面试验设计,因素的水平与设计见表1。
1.3.7 DPPH 自由基清除能力的测定 参照杨静等[16]的方法并稍加改动,用无水乙醇将DPPH 配制成0.2 mmol·L-1的DPPH 溶液,将干燥的FLEP 样品配制成1~5 mg·mL-1不同质量浓度的溶液,分别取不同质量浓度的FLEP 溶液4 mL 与1 mL 的DPPH 溶液混匀,使其充分反应,室温下避光静置30 min 后,在517 nm处测定混合溶液的吸光度值。以合成抗氧化剂(BHA)作为阳性对照,根据公式(1)计算DPPH 自由基清除率:
式中,A0为DPPH溶液的吸光度;A1为样品或阳性对照加DPPH溶液的吸光度;A2为样品溶液的吸光度。
1.3.8 亚铁离子螯合能力的测定 参照高凡等[17]的方法并稍加改动,将干燥的FLEP样品配制成1~5 mg·mL-1不同质量浓度的溶液,分别取1 mL 不同质量浓度的FLEP溶液与0.1 mL的氯化亚铁(2 mmol·L-1)和0.2 mL啡啰嗪-钠盐溶液(5 mmol·L-1)混合,用3.7 mL的甲醇溶液补至5 mL混合均匀,室温下静置20 min后于562 nm处测定吸光度。以EDTA-2Na为阳性对照,按照公式(2)计算亚铁离子清除率:
式中,A0为空白对照组的吸光度;A1为样品或阳性对照的吸光度;A2为含样品的空白对照组的吸光度。
1.3.9 ABTS自由基清除能力的测定 采用总抗氧化能力检测试剂盒(ABTS 法)评价ABTS 自由基清除能力。步骤参考试剂盒说明书,Trolox 作为阳性对照。以不同浓度的Trolox 溶液作标准曲线定量测定FLEP的ABTS 自由基清除能力,结果以mmol·g-1Trolox 当量值表示。
1.3.10 吸湿保湿性的测定 吸湿性测定:参考文献[18]并稍加改动。精密称取0.2 g 干燥FLEP 样品、甘油、透明质酸、壳聚糖于恒重的称量瓶中,然后分别敞口放置于温度25 ℃、相对湿度43%和81%的恒温恒湿培养箱中,于0、3、6、9、12、24、36、48 h取出称量记录Mt,按照公式(3)计算吸湿率:
式中,Mt为吸湿t时间的样品质量;M0为干燥样品质量。
保湿性测定:参照文献[19]并稍加改动。精密称取0.2 g 干燥FLEP 样品、甘油、透明质酸、壳聚糖于恒重的称量瓶中,加入5 g 蒸馏水将样品均匀润湿,然后分别放入温度25 ℃、相对湿度43%和干燥的硅胶环境中使其脱水,于0、3、6、9、12、24、36,48 h 取出称量,按照公式(4)计算保湿率:
式中,H0为样品放置前的水分质量;Hn为样品放置后的水分质量。
1.4 数据处理
采用SPSS 21.0 和Origin 2021 软件进行数据处理与分析,采用单因素方差分析显著性(Duncan’s multiple range test),显著性水平为0.05;利用Origin 2021 软件制图;响应面试验设计分析采用Design Expert 10.0.7软件,所有试验设置3组平行。
2 结果与分析
2.1 微颗粒对菌丝体生物量和胞外多糖含量的影响
丝状真菌在液体培养过程中大多以球状、团簇状及游离状存在。在培养基中添加微颗粒可以通过阻碍菌丝体的聚集来改变菌丝体形态,从而促进发酵产物的增加[20-21]。不同粒径的微颗粒对黄绿卷毛菇液体发酵产胞外多糖及菌丝体生物量的影响如图1 所示。随着微颗粒粒径变小,胞外多糖(FLEP)含量呈现出先升高后降低的趋势。即:60~100、100~200、200~300 目的微颗粒可以促进FLEP 的产生,其中100~200目促进效果最好,为1.91 g·L-1,是对照组(1.40 g·L-1)的1.36 倍;添加300~400 目的微颗粒则抑制了FLEP 的产生。由图1 还可知,微颗粒对菌丝体的生长起到了促进作用,粒径越细促进效果越好,在300~400 目微颗粒的作用下,菌丝体生物量达到最大,为1.68 g·L-1,是对照组(1.21 g·L-1)的1.39倍。综上所述,微颗粒粒径越小,对菌丝体生物量和胞外多糖含量的促进效果越好。

图1 微颗粒粒径对菌丝体生物量和胞外多糖含量的影响Fig.1 Effects of particle size on mycelial biomass and exopolysaccharide content
2.2 超声时间对菌丝体生物量和胞外多糖含量的影响
研究发现,低频率的超声(20~50 kHz)可以有效促进微生物细胞的生长及次级代谢产物的合成[22-23]。由图2 可知,随着超声时间的延长,FLEP 含量表现为先上升后下降,在超声时间5~20 min 范围内,FLEP 含量不断上升,并在超声时间为20 min 时达到最高值(2.15 g·L-1),是对照组(1.63 g·L-1)的1.32倍。随着超声时间的延长,菌丝体的生物量呈现先上升后下降再趋于平稳的趋势,在超声时间为5 min时,菌丝体的生物量达到1.65 g·L-1,为对照组(1.15 g·L-1)的1.43倍,超声时间5和10 min时的菌丝体生物量无显著差异,继续延长超声时间,菌丝体的生物量均低于超声时间5 min。综上所述,超声时间20 min 是促进FLEP 产量的最佳时间,而在超声时间5 min时,菌丝体生物量达到最大。
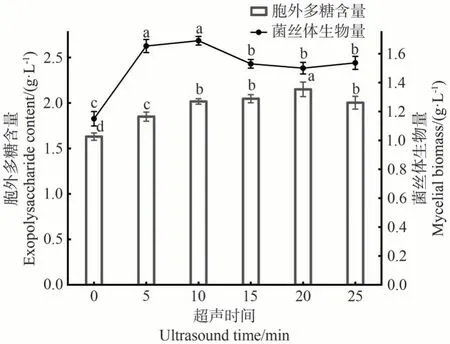
图2 不同超声时间对菌丝体生物量和胞外多糖含量的影响Fig.2 Effects of different ultrasonic time on mycelial biomass and exopolysaccharide content
2.3 吐温80对菌丝体生物量和胞外多糖含量的影响
吐温80 作为一种表面活性剂,具备良好的乳化性、溶解性以及降低表面张力的能力,已被证明可以促进大多数微生物菌丝体的生长及胞外多糖的产生[8,24]。由图3 可知,随着吐温80 质量浓度的不断增加,FLEP含量和菌丝体生物量均呈现先上升后下降的趋势。在吐温80质量浓度范围为0.2~0.6 g·L-1时,对FLEP 含量表现出促进作用,并在0.4 g·L-1时达到最大值(2.30 g·L-1),为对照组(1.85 g·L-1)的1.24倍,而在质量浓度为0.8~3 g·L-1时表现为抑制作用。菌丝体生物量在吐温80 质量浓度为0.2~0.6 g·L-1时呈增加趋势,并在0.4 g·L-1时达到最大值(2.06 g·L-1),为对照组(0.95 g·L-1)的2.17 倍。综上所述,选择0.4 g·L-1作为促进FLEP 产量与菌丝体生长的最佳吐温80质量浓度。
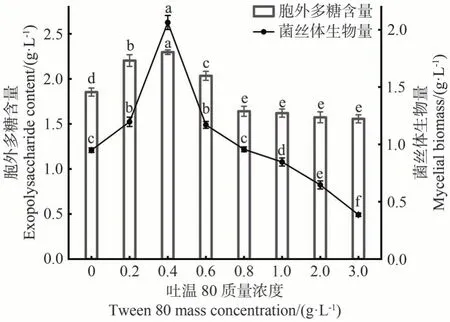
图3 吐温80质量浓度对菌丝体生物量和胞外多糖含量的影响Fig.3 Effect of Tween 80 mass concentration on mycelial biomass and exopolysaccharide content
2.4 响应面试验结果与分析
2.4.1 响应面试验结果与方差分析 综合单因素试验结果,以胞外多糖含量(Y)为响应值,对吐温80质量浓度(A)、微颗粒粒径(B)、超声时间(C)三因素进行响应面试验优化设计,试验设计与结果见表2,对回归方程进行方差分析,得到的结果见表3。

表2 响应面试验设计及结果Table 2 Response surface experimental design and results

表3 回归方程的方差分析表Table 3 Analysis of variance table of regression equation
利用Design-Expert 10.0.7 软件对试验数据进行多元回归拟合,得到FLEP 的回归方程:Y=2.42+0.08A+0.13B+0.16C-0.04AB+0.05AC+0.03BC-0.15A2-0.23B2-0.20C2。对回归方程进行方差分析,结果见表3。响应面的回归模型F=71.62,P值为<0.000 1,说明响应面模型显著,失拟项P=0.094 2>0.05,模型失拟不显著;模型相关系数R2=0.989 3,表明该模型的拟合程度较好,实际试验中约98.93%的结果可以通过拟合模型进行解释;校正系数RAdj2=0.975 4 与R2值接近,说明该模型有充分的准确性和通用性,因此可以用此模型对黄绿卷毛菇发酵产胞外多糖进行分析和预测。在该模型中一次项A、B、C和二次项A2、B2、C2对FLEP 含量影响极显著,交互项AC对FLEP 含量影响显著,其他项因素影响不显著。从表中可得影响FLEP含量的因素大小顺序为超声时间>微颗粒粒径>吐温80质量浓度。
2.4.2 不同因素间交互作用分析 通过响应曲面图和等高线可以直观地反映各因素及其交互作用对胞外多糖含量的影响,响应曲面图越陡,说明因变量对响应值的影响越大,等高线越接近椭圆,说明二者交互作用显著,反之越弱[25-26]。如图4-a、b、e、f 所示,响应曲面图较陡,说明3 个因素对FLEP 含量的影响较大。等高线接近圆形,说明因素间的交互作用对FLEP 含量影响不显著。由图4-c、d 可知,超声时间和吐温80 质量浓度对FLEP 含量影响的曲线较陡,且等高线呈现椭圆形,表明二者之间的交互作用对FLEP 含量的影响较显著。这与上文方差分析的结果一致。
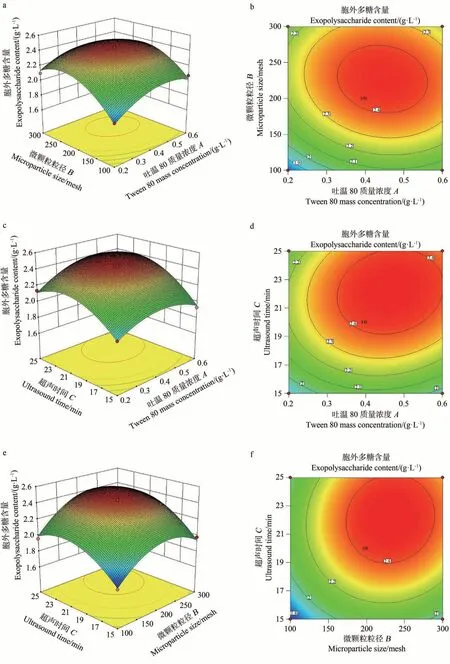
图4 各因素间交互作用对胞外多糖含量影响的响应面图和等高线图Fig.4 Response surface and contour map of the interaction between factors on the content of exopolysaccharide
2.4.3 模型验证试验 通过Design Expert软件分析得到最佳的产糖条件为:吐温80 质量浓度0.454 g·L-1,微颗粒粒径207.466 目,超声时间20.953 min,此时FLEP 的理论产量为2.47 g·L-1。因试验实际需要,将试验条件调整为吐温80 质量浓度0.4 g·L-1、微颗粒粒径100~200 目、超声时间20 min,在此条件下进行3 组验证性试验,FLEP 的平均产量为2.44 g·L-1,与预测值接近,说明使用该回归模型优化黄绿卷毛菇液体发酵产胞外多糖的条件是可行的。
2.5 FLEP对DPPH自由基的清除能力
DPPH 自由基通常用于评价新型抗氧化剂的自由基清除活性[27]。由图5可知,在1~5 mg·mL-1的质量浓度范围内,FLEP 对DPPH 自由基的清除率呈现浓度依赖性的升高,但当FLEP质量浓度高于1 mg·mL-1后,清除率的增加逐渐趋于平缓。FLEP 的清除能力仅次于同质量浓度的BHA。当质量浓度为5 mg·mL-1时,FLEP的清除率为71.0%,接近于对照组BHA的76.4%。
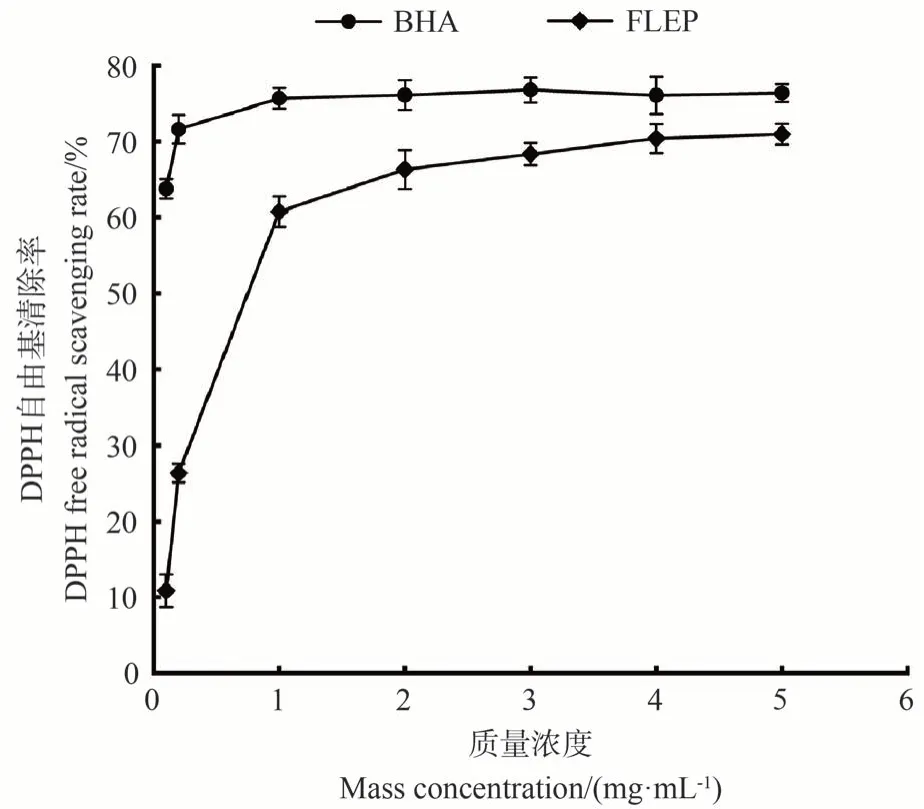
图5 FLEP对DPPH自由基清除率Fig.5 The scavenging rate of FLEP to DPPH free radicals
2.6 FLEP对亚铁离子的螯合能力
亚铁离子被认为是大多数氧化反应催化剂的活性中心,因此抑制亚铁离子与催化剂的基体结合可起到一定的抗氧化作用[28]。不同质量浓度的FLEP 对亚铁离子的螯合能力如图6所示。结果表明,在1~5 mg·mL-1的质量浓度范围内,FLEP对亚铁离子的螯合能力呈现浓度依赖性的增长,在5 mg·mL-1下达到最高的清除率(58.2%),虽然低于对照组EDTA-2Na 在5 mg·mL-1的清除率(94.4%),但仍然可以有效地结合亚铁离子,表现出较好的抗氧化活性。
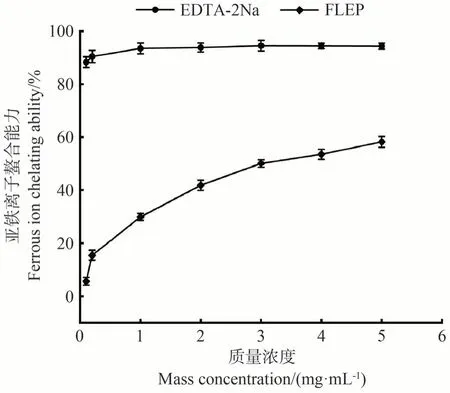
图6 FLEP对亚铁离子的螯合能力Fig.6 The chelating ability of FLEP for ferrous ions
2.7 FLEP对ABTS自由基的清除能力
ABTS 自由基清除能力被广泛用于评估化合物的总抗氧化能力[29]。以不同浓度的Trolox溶液作标准曲线,y为Trolox溶液标准浓度(mmoL·L-1),x为测量的光密度(optical density,OD)值,得到拟合标准曲线回归方程y=-0.749 1x+1.008 5(R2=0.990 4)。计算得出FLEP的ABTS 自由基清除能力为0.044±0.001 mmol·g-1Trolox,表明FLEP具有一定的清除ABTS自由基能力。
2.8 FLEP的吸湿性和保湿性
多糖通常具有强亲水性,有利于吸湿和保湿,这是用来对抗衰老的重要因素[30]。在温度25 ℃、相对湿度43%和81%的环境下,4 种样品的吸湿性结果如图7 所示。结果表明,吸湿率大小均为甘油>透明质酸>FLEP>壳聚糖。在0~3 h内,所有样品吸湿率增长速度都较快,3 h 后增长速度逐渐趋于平稳。在相对湿度43%的环境下(图7-A),甘油的吸湿率显著高于透明质酸、FLEP和壳聚糖,48 h时,FLEP的吸湿率为8.9%,优于壳聚糖(8.8%),次于透明质酸(12.2%)。在相对湿度81%条件下(图7-B),48 h 时,FLEP 的吸湿率为15.8%,高于壳聚糖(13.4%),次于甘油和透明质酸。虽然甘油的吸湿效果优于另外3 种样品,但甘油使用过多会给皮肤造成黏腻感,而且不宜在干燥的环境中使用。

图7 不同湿度环境下的4种物质的吸湿率Fig.7 Moisture absorption rate of four substances in different humidity environments
在温度为25 ℃、相对湿度为43%和干燥环境中,4 种样品的保湿性结果如图8 所示。在相对湿度43%的环境下(图8-A),保湿率大小表现为甘油>FLEP>透明质酸>壳聚糖。48 h时,FLEP 的保湿率为89.5%,显著高于透明质酸的89.2%,仅次于甘油的89.8%。在干燥环境中(图8-B),FLEP 的保湿率大于其他3 种样品,48 h 时,FLEP 的保湿率为55.4%,显著高于甘油(53.4%)、透明质酸(51.2%)、壳聚糖(50.9%)的保湿率。

图8 不同湿度环境下的4种物质的保湿率Fig.8 Moisture retention rate of four substances in different humidity environments
3 讨论
EPS 因具备多种生物活性、生产条件简便、易分离纯化等优点而引起国内外许多学者的关注。提高EPS的产量是深入研究EPS 的前提,目前大多数研究主要集中在发酵培养基的组成(碳源、氮源的种类及浓度),发酵条件(温度、pH 值、转速、接种量)及发酵时间等方面[31-33]。
研究表明,在发酵培养基中添加微颗粒有利于EPS的合成和积累[34]。本研究发现添加氧化铝微颗粒可以有效促进FLEP 的产生。可能是震荡培养过程中微颗粒与菌丝体之间发生碰撞产生剪切力,阻碍了菌丝体之间的直接相互作用,改变了菌丝体形态,从而有利于传热和传质[20]。也可能是微颗粒影响了与多糖合成相关酶的活性。如,Tao 等[21]研究发现,微颗粒提高了灰树花(Grifolafrondosa)多糖合成相关酶的活性,将一部分单糖转化,通过影响单糖组成促进了EPS 的产生。此外,陈潇筱等[34]发现添加氧化铝也有助于提高灰树花EPS 产量,这与本研究结果一致。对于菌丝体来说,300~400 目的微颗粒使生物量达到最大,说明粒径较细的微颗粒可以更好地促进菌丝体的生长,但对FLEP 表现出抑制作用,可能与菌丝体浓度过高时会抑制其他分泌物的产生有关[29]。
有研究报道,超声波可有效促进微生物代谢产物的合成[23,35-36]。如Zhang 等[23]发现超声波刺激可显著提高桑黄(Phellinusigniarius)多糖产量。而本研究发现,超声波刺激在5~25 min 范围内显著提高了FLEP含量,并在20 min时达到最高。究其原因,一是超声波的空化作用降低了微生物细胞膜中饱和脂肪酸和不饱和脂肪酸的比例,改变了细胞膜的渗透性,进而促进了营养物质与代谢产物的交换[35]。其次,超声波通过激活Ca2+通道,促进细胞内核酸和蛋白质的释放,从而提高传质效率[22,35]。而对菌丝体来说,生物量在超声时间5 min时达到最大值,之后均无显著增长。推测是由于过长的超声处理导致菌丝体部分破裂,从而使得菌丝体生物量减少[23],这与Lu等[35]的研究结果一致。
本研究还发现,培养基中添加吐温80 可有效提高FLEP的含量和菌丝体生物量。这可能是因为吐温80可以增大菌丝体颗粒的比表面积并提高多糖合成相关基因的转录水平[8]。磷酸葡糖变位酶(phosphoglucomutase,PGM)和尿苷二磷酸葡萄糖焦磷酸化酶(uridine diphosphate glucose pyrophosphorylase,UGP)是合成多糖的关键酶,Yang 等[37]在研究灵芝液体发酵过程时发现,吐温80 的加入显著提高了PGM 与UGP 的转录水平。同时,吐温80 可提高细胞的ATP 水平,促进细胞对葡萄糖的摄取,从而有利于EPS 的生产[8,37]。本研究中,吐温80 的最优浓度为0.4 g·L-1,继续提高吐温80 浓度会对FLEP 产量和菌丝体生物量产生不利影响,这可能与高浓度的吐温80 产生过多泡沫,不利于传质和传热有关[38]。而Meng等[8]则发现,深层发酵裂褶菌时,吐温80 最适浓度为1 g·L-1,这可能是由于吐温80对不同物种作用效果不同。
在抗氧化水平测试中,FLEP表现出较强的抗氧化活性,对DPPH 的清除能力优于香菇多糖[39],对亚铁离子螯合能力略低于灵芝多糖[40],而ABTS 的清除能力优于猴头菇多糖[41]。一方面可能是由于超声处理破坏了多糖的天然氢键,使其可以提供更大的表面积与自由基反应[23,42];另一方面可能与不同食用菌多糖的单糖组成、分子量及构象不同有关[4]。
在实际应用方面,本研究发现FLEP 的吸湿性优于壳聚糖,而在干燥环境中,FLEP 的保湿效果高于其他3 种样品。前人研究表明,多糖中的羟基、羧基及其他极性基团可与水分子形成氢键,结合大量的水,FLEP的吸湿性取决于其所含的亲水基团[43-44]。冬虫夏草多糖Cs-HK1 在24 h、相对湿度81%条件下的吸湿性为14.0%[45],而FLEP在48 h、相对湿度81%条件下的吸湿率为15.8%,效果优于前者,说明FLEP具有更多的亲水基团。而多糖的保湿效果往往取决于多糖链之间相互交织形成的网状结构[46]。如在48 h、干燥环境中,FLEP的保湿率为55.4%,优于Shao 等[44]报道的Sargassum horneri多糖的保湿率(49.1%)。说明FLEP 具有比后者更密集的网状结构,可结合并保持更多的水分子。综合吸湿保湿能力的结果,本研究认为FLEP 具有作为天然护肤品添加剂的潜力。
4 结论
本研究发现,微颗粒、超声波和表面活性剂对FLEP 的产量有显著影响。通过单因素试验和响应面优化得到黄绿卷毛菇产胞外多糖的最佳条件为吐温80质量浓度0.4 g·L-1、微颗粒粒径100~200目、超声时间20 min,在此条件下得到FLEP 产量为2.44 g·L-1,是对照组的1.5 倍。此外,FLEP 具有较好的体外抗氧化活性和吸湿保湿性能,在天然保健品和化妆品行业的应用中具有广阔的开发前景和使用价值。

