新风胶囊对类风湿关节炎患者疾病活动度及骨代谢的影响
李舒,万磊,刘健,黄传兵,胡赛赛,陈莹莹,程静,李方泽,朱子衡,马熙檬(.安徽中医药大学,安徽 合肥 3003;.安徽中医药大学第一附属医院风湿科,安徽 合肥 3003)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性进行性炎症性疾病,表现为大小关节的对称性多关节炎,可能导致关节和关节周围结构损伤以及全身炎症[1]。RA 炎症反应可加剧关节和滑囊破坏而致关节畸形和功能丧失[2]。RA 常见的并发症是骨代谢异常,包括骨量减少和骨质疏松症(osteoporosis,OP)[3]。RA 合并骨代谢异常与RA 疾病发展的多种特异性因素有密切关联,如疾病活动度、炎症因子、使用糖皮质激素等[4-6]。促炎细胞因子可诱导破骨细胞(osteocalcin,OC)分化,增强OC 的活性,抑制成骨细胞(osteoblast,OB)成熟,加速OB 凋亡,破坏了骨动态平衡,造成了骨丢失[7]。RA 患者常规治疗口服的非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)导致的消化功能不良[8],使得强化骨骼的微量元素如钙、镁、锌等吸收减少,最终也会加重RA 患者的骨丢失。本课题组[9]研究发现RA 的中医学病机呈现“脾虚湿盛”特点,脾胃虚弱则化源不振、骨骼不养。本研究观察益气健脾通络中药复方新风胶囊(XinfengCapsule,XFC)对RA 临床疗效、中医证候、疾病活动度、炎症免疫及骨代谢的影响,探讨XFC 改善RA 骨破坏的可能机制。
1 资料与方法
1.1 一般资料本研究经安徽中医药大学第一附属医院伦理委员会批准后实施(批号:2019AH-12)。纳入60 例RA 患者来源于2021 年1 月至2021 年12 月安徽中医药大学第一附属医院风湿病科门诊及住院部,利用随机数字表法将病例分为观察组和对照组各30 例,两组基线资料比较见表1。两组年龄、病程、性别、体质量指数(body mass index,BMI)、28 处关节疾病活动度评估(28-joint disease activity score,DAS28)比较,差异均无统计学意义(P>0.05),具有可比性。
表1 两组类风湿关节炎患者基线资料比较[±s/M(P25,P75)]Table 1 Comparison of basic data between patients in the two groups[±s/M(P25,P75)]
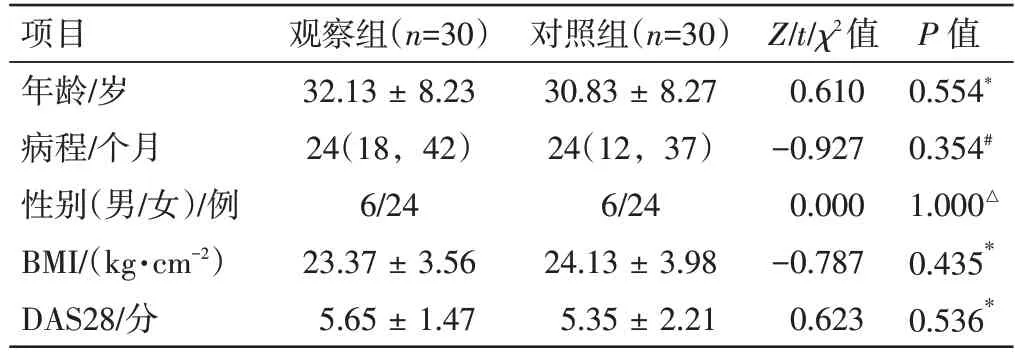
表1 两组类风湿关节炎患者基线资料比较[±s/M(P25,P75)]Table 1 Comparison of basic data between patients in the two groups[±s/M(P25,P75)]
注:*为t 检验;△为χ2检验;#为秩和检检
P 值0.554*0.354#1.000△0.435*0.536*项目年龄/岁病程/个月性别(男/女)/例BMI/(kg·cm-2)DAS28/分观察组(n=30)32.13 ±8.23 24(18,42)6/24 23.37±3.56 5.65±1.47对照组(n=30)30.83 ±8.27 24(12,37)6/24 24.13±3.98 5.35±2.21 Z/t/χ2值0.610-0.927 0.000-0.787 0.623
1.2 诊断标准
1.2.1西医诊断标准 类风湿关节炎诊断参考2010 年美国风湿病学会(american college of rheumatology,ACR)提出的最新分类标准和评分系统[10]。
1.2.2中医诊断标准 参照《类风湿关节炎病证结合诊疗指南》[11],中医证型为脾虚湿盛证。主症:肢体关节疼痛肿胀,四肢乏力麻木,形体消瘦,面色晦暗,肌肉萎缩。次症:食欲减退,食少纳呆,大便稀溏。舌脉:舌淡红,苔白腻,脉沉细。
1.2.3纳入标准 ①符合以上分类标准者;②年龄在18~55 岁;③患者签署知情同意书;④疾病活动期患者,2.6<DAS28<8;⑤依从性好的患者。
1.2.4排除标准 ①合并有心、脑、肺、肝、肾或造血系统等严重疾病;②合并其他代谢性疾病;③孕妇或哺乳期女性;④关节严重畸形。
1.3 治疗方法
1.3.1药物 新风胶囊为安徽中医药大学第一附属医院院内制剂(皖药制字:Z20050062),药物组成:薏苡仁、黄芪、蜈蚣、雷公藤,每粒胶囊0.4 g;甲氨蝶呤(规格:2.5 mg,上海上药信谊药厂有限公司,批准文号:国药准字H31020644);美洛昔康(规格:7.5 mg,扬子江药业集团有限公司,国药准字:H20010207)。
1.3.2用法用量与疗程 对照组予甲氨蝶呤,每次10 mg,每周1 次;美洛昔康,每次7.5 mg,每2 d 1 次,餐后口服。观察组在对照组基础上加用新风胶囊,每次1.2 g,每天3 次,餐后口服。除美洛昔康疗程4 周外,两组疗程均为12 周。
1.4 观察指标与安全性评价方法
1.4.1临床疗效 采用美国风湿病学会类风湿关节炎20%、50%、70%改善率标准(ACR20/50/70)评价临床疗效[12]。患者改善率大于等于ACR20 即为有效,反之为无效。
1.4.2关节及全身症状体征积分量化标准 参照《中药新药临床研究指导原则(试行)》[13],关节症状包括关节疼痛、关节肿胀、关节压痛、晨僵。脾虚证候为食欲减退、少气懒言、食后腹胀、大便稀溏。按无、轻、中、重程度分级,关节症状分别计0、3、6、9 分,脾虚证候分别计0、2、4、6 分。
1.4.3疾病活动指标 治疗前后计算两组患者疼痛视觉模拟评分(VAS)、DAS28、临床疾病活动指数(clinical disease activity index,CDAI)、简化疾病活动指数(simplified disease activity index,SDAI),分值越高代表疾病活动性越高[14]。
1.4.4炎症免疫指标 包括血沉(erythrocyte sedimentation rate,ESR)、C 反应蛋白(c-reactive protein,CRP)、抗环瓜氨酸肽抗体(anti-cyclic citrullinated peptide antibody,Anti-CCP-Ab)、类风湿因子(rheumatoid factor,RF)、白细胞介素1β(interleukin-1β,IL-1β)、IL-17A。采用魏氏法检测ESR,免疫比浊法检测CRP、RF,化学发光法检测抗CCP 抗体,酶联免疫吸附法(ELISA)检测IL-1β,IL-17A。
1.4.5骨代谢指标 包括血清碱性磷酸酶(alkaline phosphatase,ALP)、I 型原胶原N 端前肽(type I procollagen N-terminal propeptide,PINP)、骨钙素(bone gla protein,BGP)、I 型胶原羟基端肽β 降解产物(β-C-terminal terminal peptide of type I collagen,β-CTX)、抗酒石酸酸性磷酸酶5b(tartrate resistant acid phosphatase 5b,TRACP-5b)。ALP 采用免疫比浊法检测,PINP、BGP、β-CTX、TRACP-5b 均采用ELISA 法检测。
1.4.6安全性指标 患者治疗期间每4 周进行1 次安全性检查,包括血常规、肝肾功能、心电图等检查,每次就诊都需要详细记录所有不良事件。
1.5 统计学处理方法采用SPSS 24.0 统计软件分析数据。满足正态性的计量资料用均数±标准差(±s)描述,采用t检验。不符合正态性的计量资料采用中位数(median,M)和四分位间距(interquartile range,IQR)描述,采用Wilcoxon 秩和检验。计数资料以频数(构成比)描述,采用卡方检验或非参数检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组类风湿关节炎患者临床疗效比较见表2。治疗12 周后,观察组ACR70 改善率(66.7%)显著高于对照组(26.7%),差异有统计学意义(P<0.01);观察组总有效率(96.7%)与对照组(93.3%)比较,差异无统计学意义(P>0.05)。
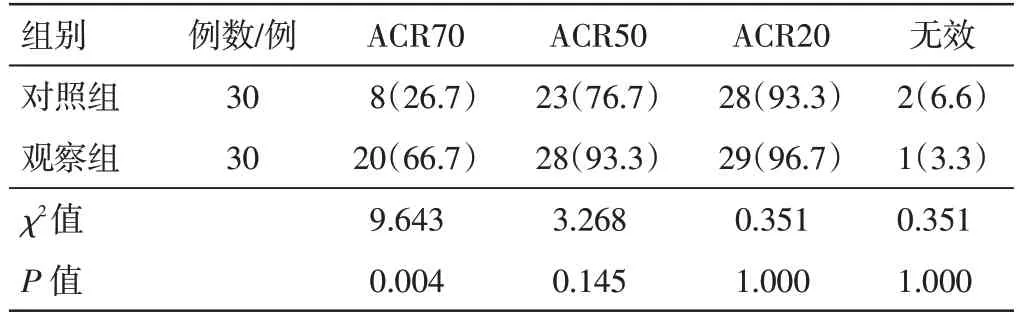
表2 两组类风湿关节炎患者20%、50%、70%改善率(ACR20/50/70)的比较[例(%)]Table 2 Comparison of ACR20/50/70 between two groups of patients [cases(%)]
2.2 两组类风湿关节炎患者中医证候积分比较见表3。治疗12 周后,与治疗前相比,观察组关节疼痛、关节肿胀、关节压痛、晨僵、食欲减退、少气懒言、食后腹胀、大便稀溏评分均显著降低(P<0.01)。对照组患者关节疼痛、关节肿胀、关节压痛、晨僵评分显著降低(P<0.01);食欲减退、少气懒言、食后腹胀、大便稀溏评分无明显变化(P>0.05)。观察组在降低患者各中医证候评分方面均优于对照组(P<0.01)。
表3 两组类风湿关节炎患者中医证候积分比较(±s,分)Table 3 Comparison of traditional Chinese medicine symptom scores between two groups of patients(±s,scores)
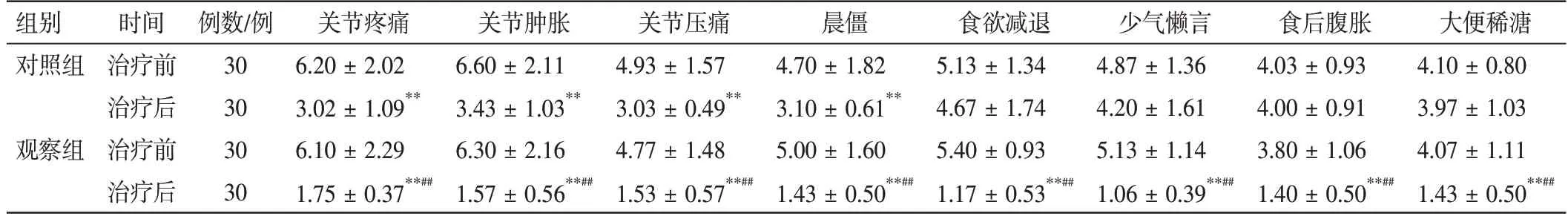
表3 两组类风湿关节炎患者中医证候积分比较(±s,分)Table 3 Comparison of traditional Chinese medicine symptom scores between two groups of patients(±s,scores)
注:与本组治疗前相比,**P<0.01;与对照组同期相比,##P<0.01
大便稀溏4.10 ±0.80 3.97±1.03 4.07±1.11 1.43±0.50**##组别对照组观察组时间治疗前治疗后治疗前治疗后例数/例30 30 30 30关节疼痛6.20 ±2.02 3.02 ±1.09**6.10 ±2.29 1.75 ±0.37**##关节肿胀6.60 ±2.11 3.43 ±1.03**6.30 ±2.16 1.57 ±0.56**##关节压痛4.93 ±1.57 3.03 ±0.49**4.77 ±1.48 1.53 ±0.57**##晨僵4.70 ±1.82 3.10±0.61**5.00±1.60 1.43±0.50**##食欲减退5.13 ±1.34 4.67±1.74 5.40±0.93 1.17±0.53**##少气懒言4.87 ±1.36 4.20±1.61 5.13±1.14 1.06±0.39**##食后腹胀4.03 ±0.93 4.00±0.91 3.80±1.06 1.40±0.50**##
2.3 两组类风湿关节炎患者疾病活动度指标比较见表4。治疗12 周后,与治疗前比较,两组患者VAS、DAS28、CDAI、SDAI 评分均显著降低(P<0.01)。且观察组VAS、DAS28、CDAI、SDAI 评分均显著低于对照组(P<0.01)。
表4 两组类风湿关节炎患者疾病活动度比较(±s,分)Table 4 Comparison of disease activity indexes between two groups of patients(±s,scores)
注:与治疗前相比,**P<0.01;与对照组同期相比,##P<0.01
SDAI 18.19 ±9.11 13.31 ±2.57**19.64 ±9.29 3.00 ±0.43**##组别对照组观察组时间治疗前治疗后治疗前治疗后例数/例30 30 30 30 VAS 7.07 ±1.08 3.07 ±1.05**6.83 ±0.70 2.01 ±0.51**##DAS28 5.65±1.47 3.47±0.80**5.35±2.21 2.05±0.79**##CDAI 18.10 ±7.28 11.89 ±1.57**18.37 ±9.10 2.66 ±0.39**##
2.4 两组类风湿关节炎患者炎症免疫指标比较见表5。治疗12 周后,与治疗前相比,两组类风湿关节炎患者ESR、CRP、抗CCP抗体、RF、IL-1β、IL-17A水平均显著降低(P<0.01);且观察组在降低患者ESR、CRP、抗CCP 抗体、RF、IL-1β、IL-17A 水平方面均显著优于对照组(P<0.01)。
表5 两组类风湿关节炎患者炎症免疫指标的比较(±s)Table 5 Comparison of inflammatory and immune indexes between the two groups of patients(±s)

表5 两组类风湿关节炎患者炎症免疫指标的比较(±s)Table 5 Comparison of inflammatory and immune indexes between the two groups of patients(±s)
注:与本组治疗前相比,**P<0.01;与对照组同期相比,##P<0.01
IL-17A/(pg·mL-1)20.40±2.24 15.92±2.00**20.05±2.26 9.66±1.71**##组别对照组观察组时间治疗前治疗后治疗前治疗后例数/例30 30 30 30 ESR/(mm·h-1)37.51±11.66 27.69±7.99**38.05±9.80 18.74±4.90**##CRP/(mg·L-1)30.35±9.89 20.41±3.35**30.13±9.11 12.63±5.14**##抗CCP 抗体/(U·mL-1)48.68±15.21 29.51±11.66**48.86±15.70 21.96±8.60**##RF/(U·mL-1)43.35±17.09 30.48±5.98**42.52±20.32 20.06±2.46**##IL-1β/(pg·mL-1)76.53±27.56 43.90±17.88**80.57±20.07 32.53±9.86**##
2.5 两组类风湿关节炎患者骨代谢指标比较见表6。12 周治疗后,与治疗前比较,观察组ALP、β-CTX、TRACP-5b 水平显著降低(P<0.01),BGP 水平升高(P<0.01),PINP 水平无明显变化(P>0.05);对照组ALP、TRACP-5b 水平降低(P<0.05,P<0.01),BGP 水平升高(P<0.05),β-CTX、PINP 水平无明显变化(P>0.05);且观察组在降低ALP、β-CTX、TRACP-5b 水平方面显著优于对照组(P<0.01),升高BGP 水平方面显著优于对照组(P<0.01),PINP水平无明显变化(P>0.05)。
表6 两组类风湿关节炎患者骨代谢指标比较(±s)Table 6 Comparison of bone metabolic indexes between the two groups of patients(±s)

表6 两组类风湿关节炎患者骨代谢指标比较(±s)Table 6 Comparison of bone metabolic indexes between the two groups of patients(±s)
注:与本组治疗前相比,*P<0.05,**P<0.01;与对照组同期相比,##P<0.01
TRACP-5b/(U·L-1)4.02±0.51 3.69±0.54*4.00±0.43 3.02±0.20**##组别对照组观察组时间治疗前治疗后治疗前治疗后例数/例30 30 30 30 ALP/(U·L-1)91.21±7.87 79.95±11.19**89.43±7.86 70.24±5.06**##PINP/(ng·mL-1)79.38±14.58 77.69±16.66 77.08±14.70 81.57±17.14 BGP/(ng·mL-1)25.46±4.79 28.68±4.85*23.58±5.56 40.12±4.92**##β-CTX/(ng·mL-1)0.85±0.14 0.80±0.18 0.86±0.08 0.72±0.02**##
2.6 安全性评价两组治疗过程中及治疗后未发现不良反应。
3 讨论
类风湿关节炎(RA)的骨代谢异常在祖国医学中相关病名为“骨痿”“骨枯”。中医认为,脾对骨骼濡养的功能至关重要。《素问·太阴阳明论》云:“今脾病不能为胃行其津液,……,筋骨肌肉,皆无气以生,故不用焉”。中医治疗RA 应健脾益胃,调补后天[15]。新风胶囊由黄芪、薏苡仁、雷公藤、蜈蚣组成。君药为黄芪,益气健脾、养血固表、化湿除痹,以后天养先天,达到强筋健骨的效果。有研究[16]表明,黄芪多糖对去卵巢大鼠骨密度和骨量具有保护作用,可能与激活BMP-2/Smads 信号通路有关。黄芪甲苷及黄芪制剂大多通过促进成骨细胞及抑制破骨细胞以调节骨代谢,亦通过促进类骨素的分泌、调节激素水平以调控骨代谢[17]。薏苡仁具有益气健脾、利水渗湿、舒筋除痹的功效。雷公藤祛风除湿、活血通络,蜈蚣通络止痛、息风镇痉。4 药共奏健脾化湿、祛风通络之功。本研究结果显示,观察组ACR70 改善率显著高于对照组,观察组在降低患者关节疼痛、关节肿胀、关节压痛、晨僵、食欲减退、少气懒言、食后腹胀、大便稀溏评分方面均优于对照组。
RA 最典型的病理特征为骨破坏,且患者骨质的侵蚀在疾病发生早期就已存在[18]。随着RA 疾病进展,炎症的反复可造成不可逆转的软骨、骨和其他邻近组织的破坏[19]。骨转换标志物(bone turnover marker,BTM)包括骨形成标志物(ALP、BGP、PINP)和骨吸收标志物(β-CTX、TRACP-5b)在RA 骨破坏的发生中有重要意义。BTM 能更加敏感地反映类风湿关节炎早期的骨质破坏,预测发生骨质疏松和骨折的风险[20],且RA 疾病的活动度与骨破坏的发生密切相关[21]。本研究结果显示,观察组在降低VAS、DAS28、CDAI、SDAI 方面显著优于对照组;在骨代谢方面,观察组在降低ALP、β-CTX、TRACP-5b 及升高BGP 水平显著优于对照组。
免疫系统参与了骨破坏的发生发展[22],RA 的骨破坏主要归因于破骨细胞的异常激活[23]。IL-1β 是最强大的促炎细胞因子之一,通过上调RANKL 刺激破骨细胞形成,是骨吸收的强刺激剂。其刺激破骨细胞的发生[24]。IL-17A 是一种主要由Th17 细胞产生的炎症细胞因子,它是炎症介导的骨破坏的关键因素[25]。与抗CCP 抗体阴性者相比,抗CCP 抗体阳性患者易发展为更严重的关节骨质破坏[26],且抗CCP抗体水平与患者的疾病活动度相关[27],还能反映RA患者骨侵蚀的程度[28]。本课题组前期研究[29-30]显示,新风胶囊能显著改善佐剂性关节炎大鼠的足跖肿胀度,能降低大鼠血清IL-1、IL-6、IL-17 水平,维持细胞因子的稳态。本研究结果显示,观察组在改善炎症免疫方面,其降低患者ESR、CRP、Anti-CCPAb、RF、IL-1β、IL-17A 的作用显著优于对照组,说明新风胶囊有利于促进RA 炎症消退及破坏骨质的修复。
综上,新风胶囊可能通过调节炎症免疫、降低疾病活动度、改善骨代谢以控制关节骨破坏,缓解RA进展,从而提高临床疗效。

