添加无机氮对山西太岳山油松林土壤微生物氮利用效率的影响1)
杨金婕 王勇强 周志勇 沈颖
(北京林业大学,北京,100083) (山西灵空山国家级自然保护区管理局) (北京林业大学)
随着大气氮沉降的加剧,输入到森林生态系统中的氮素逐渐增多[1]。过多的氮素输入,一方面缓解了森林植被生长的养分限制[2];另一方面,却从森林物种组成[3]、凋落物的分解[4]、土壤微生物性状[5]、土壤环境[6]以及养分循环[7]等方面,改变了森林生态系统的原有属性。
外源氮素的输入,首先会影响森林生态系统的氮循环[8],尤其是明显改变了土壤中的氮素含量。土壤中的氮以有机氮和无机氮两种形态存在。无机氮主要包括硝态氮和铵态氮,可以被植物直接吸收利用,但其含量在全氮中较少[9]。有机氮只有通过矿化作用转化为无机氮后,才能被植物吸收利用[10]。可溶性有机氮(DON)是土壤中最活跃的氮素组成成分[11-12],其含量越高,土壤氮素的可利用性越高[13-14]。氮素的添加,还会影响到土壤的生物物理学性状,如可降低土壤酸碱度、改变微生物生长的养分限制及其群落结构等[15-16],从而影响土壤氮素转化速率,造成土壤NOx排放量及氮淋溶损失增加[17]。然而,随着外源无机氮素输入的增加,土壤中的氮素组分呈现何种变化趋势,以及这种变化如何调控土壤微生物的养分利用策略,还需进一步研究。
微生物对土壤中氮素含量的变化具有较强的指示作用和有效的应对策略。在受氮限制的生态系统中,微生物生物量会随着添加氮量的增加而提高[18];而在氮富集的区域,微生物生物量及其酶活性则会随着添加氮量的增加而降低[19-20]。土壤微生物,还会通过调节自身的养分利用策略,应对环境中氮素的变化对自身生长带来的影响。氮利用效率是用来衡量微生物对所吸收的氮素在体内进行转化的效率,并受到微生物体内元素组成及其生长环境中养分相对含量的制约[21],微生物氮利用效率决定了氮素合成代谢和分解代谢过程的平衡,控制了土壤有机氮和无机氮循环交叉点的通量[22]。在土壤氮循环中,限制微生物分解有机质速率的关键步骤,是胞外蛋白酶将蛋白质解聚成寡肽和氨基酸的过程,而不是随后的氨化过程[23-25],解聚过程的产物可以作为能量和营养源被微生物快速地利用[26-27]。然而,目前对土壤氮循环的研究,较多集中在氮矿化方面,对有机氮在微生物吸收和铵态氮释放之间的分配规律研究较少[21]。尽管微生物氮利用效率在调控土壤氮循环过程方面的重要性已被人们所认知,但随着供氮水平的变化,其会呈现何种变化趋势以及驱动该变化的生态因子,还存在着较大的不确定性[22]。
为此,本研究在山西太岳山森林生态系统国家定位观测研究站的研究区域,选取立地条件基本一致的天然油松(Pinustabuliformis)林为研究样地,建立试验样地20块;采用随机区组设计,试验样地内设置1个对照处理和4个梯度添加氮处理,添加的氮源为硝酸铵,在每年的6月份对各样地进行施氮处理;2019年8月份,在每块样地内随机选取3个取样点,采集0~10 cm土层的土壤样品,测定土壤微生物生物量碳、土壤微生物生物量氮、土壤微生物生物量磷、土壤酶活性、土壤理化性质;采用单因素方差分析法、最小显著差异法(LSD)分析不同氮处理间土壤基本理化性质的差异,采用回归分析法分析土壤微生物氮利用效率与各形态氮素的相关性,采用结构方程模型通径分析微生物氮利用效率的驱动因素间相关性;旨在为合理评估森林生态系统氮循环的动态平衡提供参考。
1 研究区概况
本研究区位于山西太岳山森林生态系统国家定位观测研究站区域(111°45′~112°33′E、36°18′~37°5′N),站址位于山西省沁源县韩洪乡。研究区,海拔1 100~2 300 m,气候类型为暖温带大陆性季风气候,年平均降水量650 mm,降雨集中在7、8月份,年平均气温8.6 ℃;研究区内,典型土壤类型为棕壤与褐土,主要森林类型为辽东栎(Quercuswutaishanica)林、华北落叶松(Larixgmeliniivar.principis-rupprechtii)林、油松(Pinustabuliformis)林、油松辽东栎混交林,除此之外还有少量山杨(Populusdavidiana)林,优势乔木为油松、辽东栎、山杨、白桦(Betulaplatyphylla)等,灌木主要有黄刺玫(Rosaxanthina)、毛榛(Corylusmandshurica)、沙棘(Hiphophaerhamnoides)等,草本主要有龙常草(Diarrhenamanshurica)、莎草(Cyperusrotundus)等。
2 研究方法
在研究区内选取立地条件基本一致的天然油松林作为研究样地,林龄80 a左右,面积约为1 hm2。于2015年5月份建立试验样地20块,每块样地为15 m×15 m;采用随机区组设计,试验样地内设置1个对照处理、4个梯度添加氮处理(0(对照)、5、10、20、40 g·m-2·a-1),每个梯度设置4个重复,添加的氮源为硝酸铵;随后,在每年的6月份对各样地进行施氮处理。
2019年8月份,在每块样地内随机选取3个点进行采样,去除表层凋落物和腐殖质后,用内径5 cm的土钻采集0~10 cm土层土壤样品;将土样装在无菌自封袋中,放置于保温箱内(-4 ℃)运回实验室。土样过2 mm筛去除可见凋落物、小石块等杂质,过筛土样,一部分于-4 ℃保存,用于测定土壤微生物生物量碳、土壤微生物生物量氮、土壤微生物生物量磷、土壤酶活性;另一部分自然风干,用于测定土壤理化性质。
按质量比m(土壤)∶m(去离子水)为1.0∶2.5,用去离子水稀释土壤样品,用pH计测定其pH;土壤有机碳,采用重铬酸钾外加热测定;全氮,采用硒粉-硫酸铜-硫酸消化凯氏定氮法测定;全磷,采用HClO4-H2SO4钼锑抗比色法测定;可溶性有机氮,采用K2SO4浸提法测定;硝态氮、铵态氮,采用KCl浸提,用连续流动分析仪(AutoAnalyzer 3,德国)测定。以上方法测定步骤,均参考《土壤农业化学分析方法》[28]。土壤无机氮质量分数,为土壤硝态氮质量分数+铵态氮质量分数;土壤有机氮质量分数,为土壤全氮质量分数-无机氮质量分数。
土壤微生物生物量碳(MBC)、土壤微生物生物量氮(MBN)、土壤微生物生物量磷(MBP),采用氯仿熏蒸-K2SO4浸提法测定,具体步骤参考《土壤农业化学分析方法》[28]。土壤酶活性,采用微孔板荧光法,具体参照Saiya-Cork et al.[29]的方法,共测定4种水解酶,包括β-1,4-葡萄糖苷酶(BG)、酸性磷酸酶(AP)、亮氨酸氨肽酶(LAP)、β-N-乙酰氨基葡萄糖苷酶(NAG)。
依据生态化学计量学理论、微生物代谢理论,引入微生物氮利用效率计算公式[30]。
R[AEE(w(N)∶w(C))]=(ZNAG+ZLAP)/ZBG;
AE={1-R[AEE(w(N)∶w(C))]}(Rw(BN,BC)/Rw(N,C));
ENU=ENU,max[AE/(AE+0.5)];
T(Rw(C,N))=Rw(C,N)×R[AEE(w(C)∶w(N))]。
式中:R[AEE(w(N)∶w(C))]为土壤氮碳比(w(N)∶w(C))对应获取酶相关酶活性的比值;ZNAG为β-N-乙酰氨基葡萄糖苷酶(NAG)的活性;ZLAP为亮氨酸氨肽酶(LAP)的活性;ZBG为β-1,4-葡萄糖苷酶(BG)的活性;AE为土壤微生物通过产生胞外酶以协调自身养分元素组成与环境中养分元素组成之间差异的能力;Rw(BN,BC)为土壤微生物生物量氮质量分数(w(NMB))和微生物生物量碳质量分数(w(CMB))的比值;Rw(N,C)为土壤中氮质量分数(w(N))与碳质量分数(w(C))的比值;ENU为氮利用效率(NUE);ENU,max为氮利用效率最大值;Rw(C,N)为土壤中碳质量分数(w(C))与氮质量分数(w(N))的比值;R[AEE(w(C)∶w(N))]为土壤碳氮比(w(C)∶w(N))对应获取酶相关酶活性的比值;T(Rw(C,N))为土壤中碳质量分数(w(C))与氮质量分数(w(N))比值的阈值,是揭示微生物养分限制的关键指标,如果土壤中w(C)∶w(N)高于T(Rw(C,N)),则说明微生物受到N限制,反之则受C限制[31-33]。
本研究主要采用SPSS 26.0单因素方差分析法、最小显著差异法(LSD)分析不同氮处理间土壤基本理化性质的差异;采用回归分析法分析土壤微生物氮利用效率与各形态氮素的相关性;采用结构方程模型(SEM)对微生物氮利用效率的驱动因素进行通径分析。
3 结果与分析
3.1 添加氮对油松林土壤理化性质的影响
由表1可见:土壤pH随施氮量的增加逐渐减小,在施氮量为40 g·m-2·a-1时达到最小值(5.27),显著低于对照(不添加氮)19.1%(P<0.05);有机碳、全氮、全磷的质量分数,虽然也随着施氮量的增加呈现逐渐降低的趋势,但是不同的施氮梯度间的差异并没有达到显著性水平。外源添加氮,显著影响了土壤的碳氮比(碳质量分数w(C)∶氮质量分数w(N))、微生物生物量碳氮比(生物量碳质量分数w(CMB)∶生物量氮质量分数w(NMB));土壤w(C)∶w(N)在施氮量为40 g·m-2·a-1时最低(12.39)、在施氮量为20 g·m-2·a-1时最高(15.79),二者间差异显著;微生物w(CMB)∶w(NMB)在施氮量为10 g·m-2·a-1时最大(8.52)、在施氮量为40 g·m-2·a-1时最小(5.13),且施氮量为40 g·m-2·a-1时的微生物w(CMB)∶w(NMB)比对照(不施氮)时的微生物w(CMB)∶w(NMB)低35.2%。
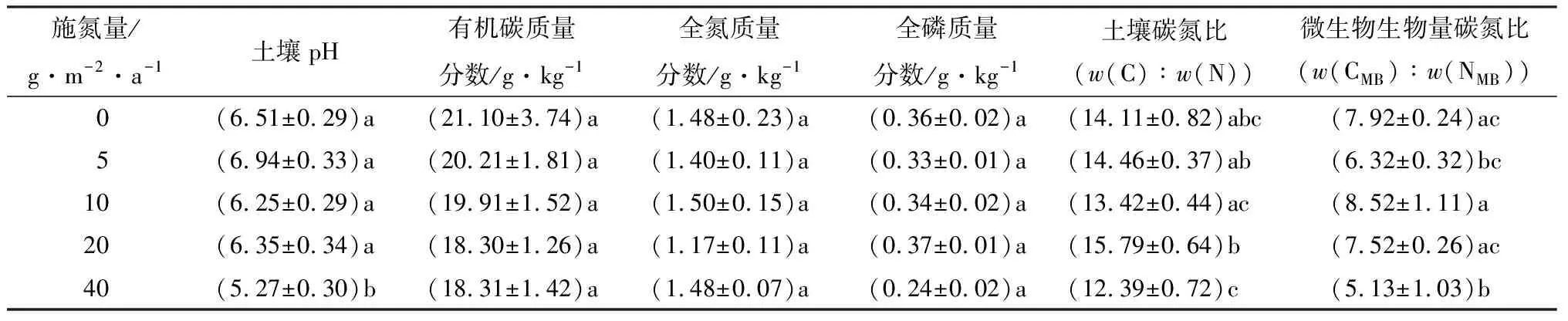
表1 不同施氮量时的土壤理化性状
由表2可见:土壤有机氮的质量分数随施氮量的增加逐渐降低,但各处理间差异不显著;添加氮增加了可溶性有机氮的质量分数,其在施氮量5、40 g·m-2·a-1时出现较大值,分别为12.12、12.97 mg·kg-1,是对照(施氮量0)的1.2、1.4倍;不同施氮量时微生物生物量氮的质量分数,由小到大依次为施氮量20 g·m-2·a-1时、施氮量40 g·m-2·a-1时、施氮量10 g·m-2·a-1时、施氮量0时、施氮量5 g·m-2·a-1时,施氮量为5 g·m-2·a-1时的微生物生物量氮的质量分数比对照(施氮量0)增加了6.77 mg·kg-1,但差异不显著;施氮量对铵态氮、硝态氮的影响规律一致,均呈现上升趋势,在施氮量为40 g·m-2·a-1时铵态氮、硝态氮质量分数最大;土壤中无机氮质量分数,从对照(施氮量0)时的4.89 mg·kg-1,增加到施氮量40 g·m-2·a-1时的177.63 mg·kg-1。
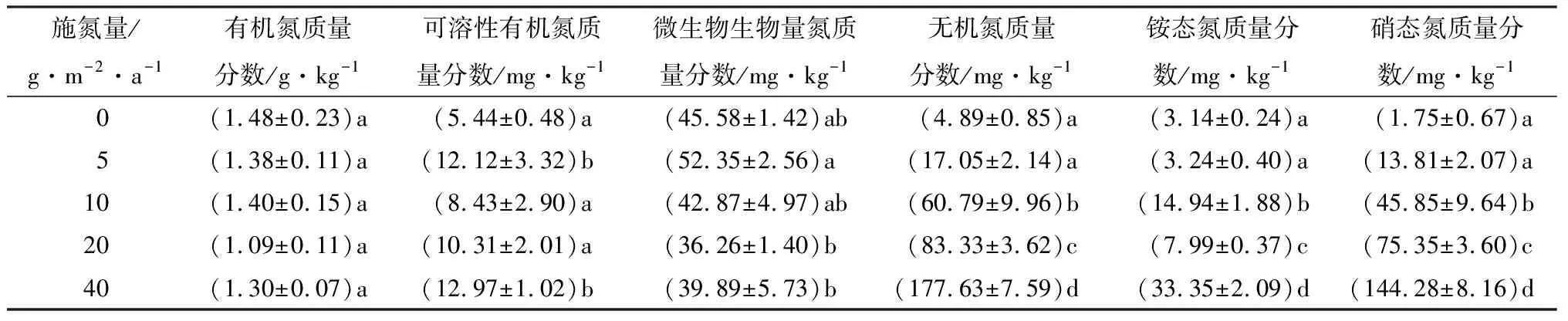
表2 不同施氮量时土壤氮组分的变化特征
添加外源氮对土壤中各形态氮素的影响不同,本研究中添加硝酸铵对土壤全氮质量分数、有机氮质量分数无显著影响;这是由于土壤微生物固氮作用、植物对氮的吸收以及氮的淋溶,从而使得外源氮的添加后,土壤中全氮质量分数仍能维持在相对稳定的水平。本研究表明土壤可溶性有机氮的质量分数随添加氮量的增加而增大;这是由于添加氮后,生物、非生物的固氮过程将更多的无机氮保存在土壤有机质中,诱导产生更多的可溶性有机氮,从而降低土壤的碳氮比(w(C)∶w(N))[34]。添加低氮可提高土壤中微生物生物量氮的质量分数,而添加中氮量、高氮量对微生物生物量氮有显著的抑制作用,说明适度的添加氮有利于微生物生物量的提高,而添加量过高反而有抑制作用。添加硝酸铵对土壤无机氮质量分数有极显著的促进作用。
3.2 添加无机氮对土壤微生物胞外酶活性及其计量比的影响
由表3可见:无机氮的添加,提高了土壤中与碳、氮、磷获取酶相关酶的活性(β-1,4-葡萄糖苷酶活性、β-N-乙酰氨基葡萄糖苷酶活性+亮氨酸氨肽酶活性、酸性磷酸酶活性)。β-1,4-葡萄糖苷酶的活性,由对照(施氮量0)时的46.78 nmol·g-1·h-1增大到施氮量40 g·m-2·a-1时的73.13 nmol·g-1·h-1,提高了56.3%(P<0.05);与氮获取酶相关酶的活性(β-N-乙酰氨基葡萄糖苷酶活性+亮氨酸氨肽酶活性),由小到大依次为施氮量40 g·m-2·a-1时的、对照(施氮量0)时的、施氮量20 g·m-2·a-1时的、施氮量10 g·m-2·a-1时的、施氮量5 g·m-2·a-1时的,其在施氮量40 g·m-2·a-1时达到最小值(33.25 nmol·g-1·h-1),低于对照(施氮量0)时的27.9%;酸性磷酸酶的活性,由对照(施氮量0)时的88.50 nmol·g-1·h-1增加到施氮量40 g·m-2·a-1时的111.59 nmol·g-1·h-1,增加了26.1%。

表3 不同施氮量时土壤酶活性及其计量特征
土壤氮碳比(w(N)∶w(C))对应获取酶相关酶活性的比值(R[AEE(w(N)∶w(C))])、土壤氮磷比(w(N)∶w(P))对应获取酶相关酶活性的比值(R[AEE(w(N)∶w(P))]),在最高施氮量(40 g·m-2·a-1)时显著降低,分别为0.53、0.30,比对照(施氮量0)降低了45.9%、42.3%(P<0.05);氮获取酶相关酶活性在总碳、氮、磷获取酶相关酶活性中的占比((ZNAG+ZLAP)/(ZBG+ZNAG+ZLAP+ZAP)),在施氮量为40 g·m-2·a-1时达到0.16,低于对照(施氮量0)36.0%。表明较高的氮输入量提高了碳获取酶、磷获取酶的活性,而抑制了氮获取酶的活性。
3.3 添加无机氮对微生物氮利用效率的影响
添加无机氮显著提高了微生物氮利用效率(见表4),由对照(施氮量0)时的0.18增大到施氮量40 g·m-2·a-1时的0.60,提高了2.3倍(P<0.05)。由图1可见:添加无机氮降低了氮素对微生物生长的限制作用,相对提高了能量(即碳源)的限制强度,施氮量为40 g·m-2·a-1时,土壤碳氮比(Rw(C,N))显著低于土壤中碳质量分数(w(C))与氮质量分数(w(N))比值的阈值(T(Rw(C,N))),说明与其他施氮量相比,微生物受到更强烈的碳限制。Rw(C,N)/T(Rw(C,N))能够反映土壤养分限制的情况,其值大于1则说明微生物受氮限制,小于1则说明微生物受碳限制[21],随氮素输入量的增大,Rw(C,N)/T(Rw(C,N))越来越小于1,土壤碳限制状况不断加剧,氮限制得到缓解,同时微生物氮利用效率不断增大,表明微生物将更多的氮资源用于自身的生长。
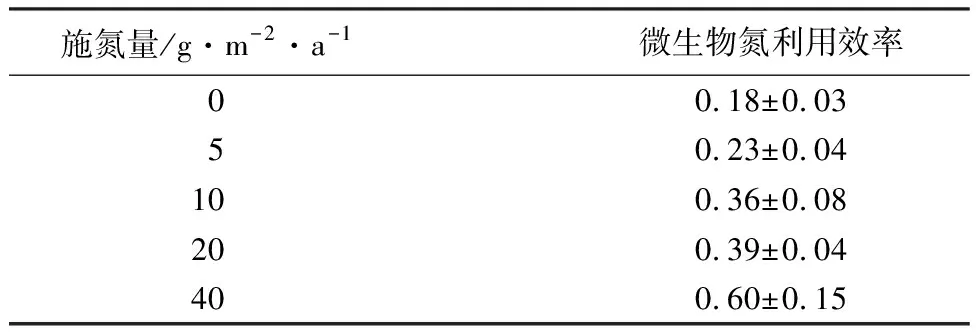
表4 不同施氮量时土壤微生物氮利用效率
回归分析表明(见图2):微生物氮利用效率,与氮获取酶相关酶活性占比[氮获取酶在总碳、氮、磷获取酶相关酶活性中的占比((ZNAG+ZLAP)/(ZBG+ZNAG+ZLAP+ZAP))]、无机氮质量分数之间存在极显著的线性正相关(P<0.01),其拟合方程相关系数分别为0.62、0.46;pH与微生物氮利用效率之间存在极显著线性正相关(P<0.01),拟合方程相关系数为0.28;微生物氮利用效率,与Rw(BC,BN)(土壤微生物生物量碳质量分数(w(CMB))和微生物生物量氮质量分数(w(NMB))的比值)、可溶性有机氮质量分数(w(DON))之间均存在显著的对数关系(P<0.05),其中,与Rw(BC,BN)为负相关、与w(DON)为正相关。
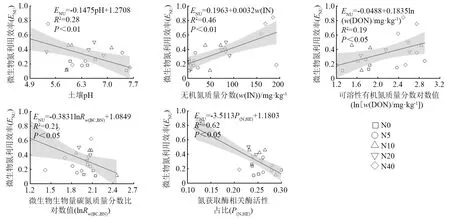
N0、N5、N10、N20、N40,分别为施氮量0(对照)、5、10、20、40 g·m-2·a-1。Rw(BC,BN)为土壤微生物生物量碳质量分数(w(CMB))与微生物生物量氮质量分数(w(NMB))的比值(w(CMB)∶w(NMB));P(N,HE)为(ZNAG+ZLAP)/(ZBG+ZNAG+ZLAP+ZAP),ZNAG为β-N-乙酰氨基葡萄糖苷酶(NAG)的活性、ZLAP为亮氨酸氨肽酶(LAP)的活性、ZBG为β-1,4-葡萄糖苷酶(BG)的活性、ZAP为酸性磷酸酶(AP)的活性。
添加氮通过影响土壤pH、碳氮比(w(C)∶w(N)),从而调控了微生物氮利用效率(见图3)。添加氮对pH有极显著的抑制作用,pH不仅直接决定了氮获取酶占比,还可以通过影响微生物生物量调控氮获取酶占比(P<0.01),进而抑制微生物氮利用效率(P<0.01);pH通过直接促进土壤微生物生物量氮(P<0.01),从而抑制微生物氮利用效率。添加氮降低了土壤碳氮比(w(C)∶w(N)),碳氮比(w(C)∶w(N))对微生物氮利用效率有直接的促进作用。
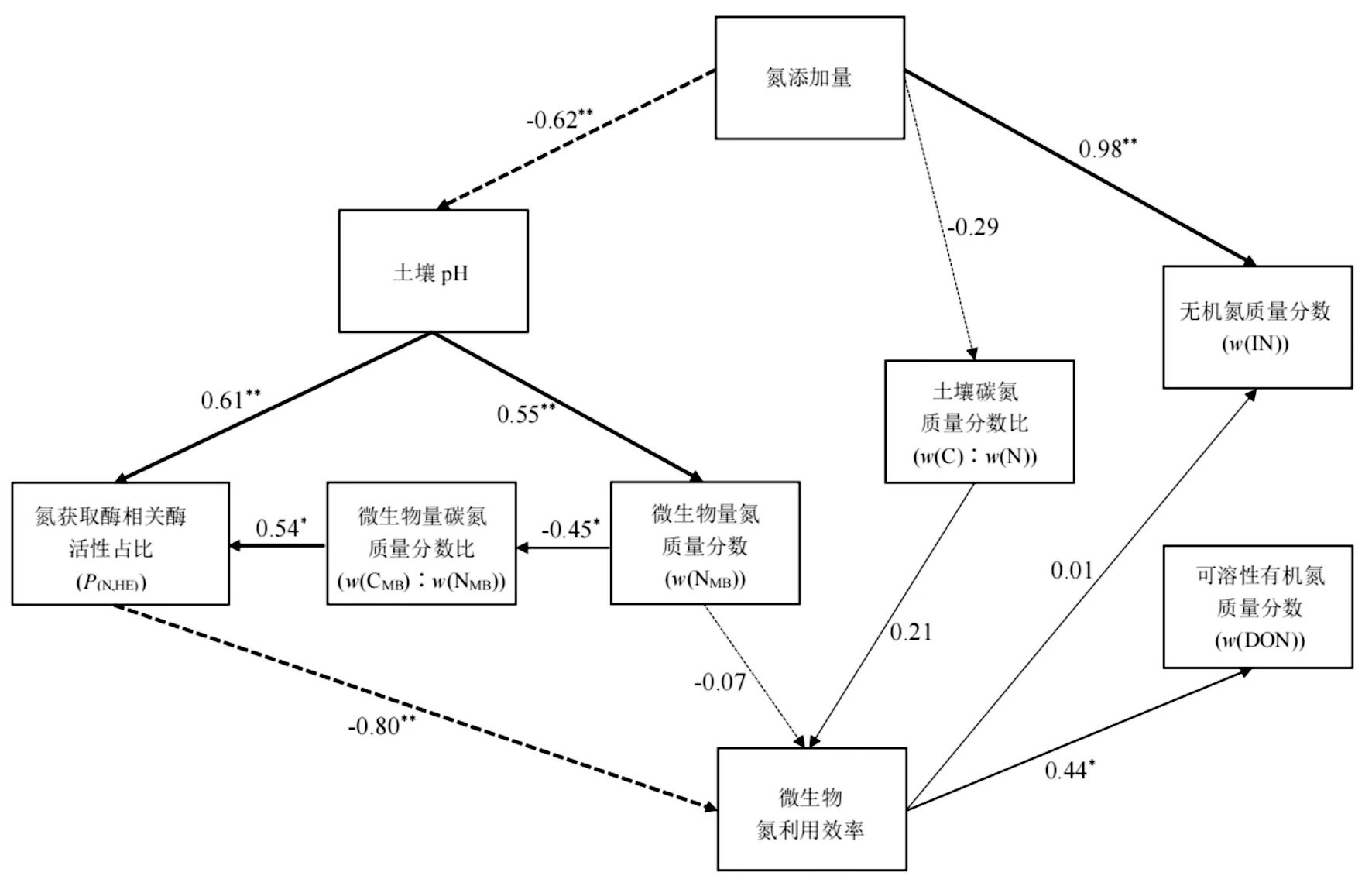
P(N,HE)为(ZNAG+ZLAP)/(ZBG+ZNAG+ZLAP+ZAP),ZNAG为β-N-乙酰氨基葡萄糖苷酶(NAG)的活性、ZLAP为亮氨酸氨肽酶(LAP)的活性、ZBG为β-1,4-葡萄糖苷酶(BG)的活性、ZAP为酸性磷酸酶(AP)的活性;实线表示正相关、虚线表示负相关,连线上的数据为标准化路径系数,*表示显著影响(P<0.05),** 表示极显著影响(P<0.01)。
由通径分析结果(见图3)可见:微生物氮利用效率,在受到环境因子调控作用的同时,对土壤中无机氮质量分数(w(IN))、可溶性有机氮质量分数(w(DON))有一定影响。微生物氮利用效率对土壤中无机氮质量分数有促进作用但并不显著;这是由于添加无机氮对土壤中无机氮质量分数有极显著的促进作用,从而降低了微生物氮利用效率对于土壤中无机氮质量分数变异的贡献度。微生物氮利用效率,对可溶性有机氮质量分数有显著的促进作用(P<0.05)。
添加氮对微生物氮利用效率有显著的促进作用。高水平的微生物氮利用效率表明,微生物对土壤有机质中氮的固存起到重要作用,强调了微生物生物量作为土壤中氮汇的作用[35]。通过微生物生长和消亡过程,氮的持续周转也是生态系统中氮保存的重要机制[21]。本研究结果表明,添加氮主要通过影响土壤pH、碳氮比(w(C)∶w(N)),间接影响微生物氮利用效率,pH主要通过调控微生物生物量和氮获取酶活性影响微生物氮利用效率。已有研究表明,土壤pH与酶活性密切相关[36-37],其是土壤胞外酶活性的主要影响因子[38],添加氮显著降低了土壤pH。本研究中,添加高氮量(40 g·m-2·a-1)显著抑制与氮获取酶相关酶的活性(β-N-乙酰氨基葡萄糖苷酶活性+亮氨酸氨肽酶活性)。而氮获取酶与微生物氮利用效率之间有极显著的负相关关系;原因是添加氮降低了土壤pH,土壤微生物减少氮获取酶的产量[39],而添加氮提高了微生物对土壤中氮的固存,促进了微生物氮利用效率,因此导致了二者之间的负相关关系。
已有研究表明,微生物氮利用效率受到土壤元素化学计量的调控作用[21]。本研究中,添加氮时微生物氮利用效率主要受土壤碳氮比(w(C)∶w(N))、土壤微生物生物量碳氮比(w(CMB)∶w(NMB))的影响;其中,微生物氮利用效率,与w(CMB)∶w(NMB)之间存在极显著的负相关,与w(C)∶w(N)存在弱的正相关。随添加氮量的增大,w(C)∶w(N)显著低于w(C)∶w(N)的阈值(T(Rw(C,N))),氮素输入缓解了土壤中的氮限制,加剧了碳限制,微生物生长由营养(氮)限制转变为能量(碳)限制,从而导致了微生物养分利用策略的变化。Mooshammer et al.[21]认为,在土壤w(C)∶w(N)较高时,微生物通过土壤呼吸释放多余的碳,从而降低w(C)∶w(N),而当w(C)∶w(N)低于w(C)∶w(N)的阈值时,微生物的生长限制从氮限制切换到碳限制,多余的氮通过氮矿化释放。本研究中当,w(C)∶w(N)越高,接近于w(C)∶w(N)的阈值时,微生物氮利用效率越低,与Mooshammer et al.[21]的研究有差异;这是由于本研究添加氮时各梯度间有机氮的质量分数并无显著变化,微生物氮素来源并未有效提高,微生物通过将更多的氮固定为微生物生物量,以确保自身的生长。
添加氮,土壤微生物群落结构及功能会发生变化,该变化会直接或间接影响土壤的养分循环[40]。微生物氮利用效率反映了分配给生物合成的有机氮相对于获得有机氮的比例,微生物氮利用效率越高,则说明微生物将更多获得的有机氮用于微生物生物量的合成,而越低则表明获得的有机氮更多以无机氮(主要为铵态氮)的形式释放进入环境中[22]。因此,微生物氮利用效率与土壤中微生物生物量氮和无机氮质量分数密切相关,其决定着有机氮在土壤中的循环速率[25]。本研究表明,w(CMB)∶w(NMB)与微生物氮利用效率之间存在间接的负相关,即微生物氮利用效率与土壤微生物生物量氮(MBN)之间为正相关,这一结果符合微生物氮利用效率的基本理论。根据通径分析结果,微生物氮利用效率对土壤无机氮质量分数无显著的调节作用,其原因是无机氮的添加对于土壤无机氮质量分数影响较大,从而弱化了微生物氮利用效率对土壤无机氮的调控作用。添加无机氮提高了微生物氮利用效率,促进了氮素在土壤微生物中的固存,提高了土壤中氮素的稳定性。
4 结论
向油松林添加硝酸铵改变了土壤中不同形态氮的质量分数,土壤可溶性有机氮的质量分数显著升高,土壤全氮质量分数、有机氮质量分数无显著变化,高氮处理中土壤微生物生物量氮质量分数显著降低。添加氮,提高了与碳获取酶相关酶、与磷获取酶相关酶的活性,即提高了β-1,4-葡萄糖苷酶(BG)活性、酸性磷酸酶(AP)活性;而抑制了与氮获取酶相关酶的活性,即抑制了β-N-乙酰氨基葡萄糖苷酶(NAG)活性、亮氨酸氨肽酶(LAP)活性。添加氮,对微生物氮利用效率有显著的促进作用,其主要受pH、w(C)∶w(N)、w(CMB)∶w(NMB)、(ZNAG+ZLAP)/(ZBG+ZNAG+ZLAP+ZAP)的显著影响;添加氮,使油松林土壤微生物由营养(氮)限制转化为能量(碳)限制,微生物氮利用效率增大,微生物对氮的固存增加,提高了土壤氮素的稳定性。

