硒诱导的黄瓜耐镉转录本鉴定分析及表达载体构建
王小云 孙红艳 史梦 于佳

摘要:以黄瓜乙烯响应因子CsERF7转录本为研究对象,通过外源硒缓解黄瓜镉胁迫试验分析其表达及黄瓜生长状况,并克隆CsERF7基因,构建过表达载体转化拟南芥,同时分析CsERF7的理化性质和功能。结果表明,外源硒显著升高了镉胁迫引起的黄瓜生长指标的降低,CsERF7在镉处理下的表达丰度是对照的56%,而镉+硒比单独镉处理上调表达4.53倍,与RNA-seq结果相符,此基因可能在硒调控黄瓜镉胁迫响应中起作用。同时,成功构建超表达载体pEGOEP35S-H-ERF7-GFP,转化拟南芥获得转基因株系。生物信息学分析表明,黄瓜CsERF7基因属于AP2/ERF家族的AP2亚家族,开放阅读框ORF长度588 bp,编码196个氨基酸,有1个AP2结构域;该蛋白属于非跨膜亲水性蛋白,亚细胞定位预测定位在线粒体中,存在22个氨基酸磷酸化位点;其二级结构主要由α-螺旋和延伸链构成,与三级结构预测结果高度一致,所得蛋白序列与黄瓜、甜瓜同源性最高。
关键词:黄瓜;ERF;基因克隆;过表达载体构建;生物信息分析
中图分类号:S642.201文献标志码:A文章编号:1002-1302(2023)11-0046-07
黄瓜(Cucumis sativus)是世界范围内普遍种植的蔬菜,是我国设施蔬菜主要栽培种之一,在蔬菜产业中的地位十分重要;同时兼具清热利水、健脑安神、润肤美容等多种功效。我国城市食用黄瓜产地多位于城市近郊,这里同时也聚集较多的城市废弃物,以及含重金属的农药、化肥的大量使用,使得我国蔬菜质量问题依然堪忧,其中包括镉在内的重金属污染十分突出。重金属镉具有较高的可转移性,能够被植物的根部吸收,继而转运至地上部分可食器官并在植物中积累[1];并通过食物链富集于人体引发多种疾病,严重威胁人类健康[2]。因此,治理土壤镉污染,深入探讨黄瓜镉毒害及耐性的生理与分子机制,发掘耐镉关键基因,培育耐镉新品种已经成为当前农业科学的研究热点。
乙烯响应因子ERF(ethylene-responsive factor)是植物界的一类转录因子,属于植物AP2/ERF转录因子家族,在植物抗病、干旱、低温、高盐等逆境胁迫中具有重要作用,该基因在不同植株中的超表达能够提高其抗性[3]。根据其结构域的数量及其相互间的序列相似性分为AP2、RAV和ERF 3个主要亚家族[4],其中AP2蛋白在调节植物生长发育过程中起着重要作用[5];RAV家族蛋白在生物和非生物胁迫响应过程中发挥重要作用[6];ERF亚家族成员对植物的生长发育以及逆境胁迫应答反应有着重要的调控作用,主要包括植物生长、果实发育、低温和干旱胁迫等环境胁迫[7-8]。
在黄瓜转录因子ERF研究中,张慧敏等报道CsERF(登录号:Csa7M448110)是黄瓜叶片中调控苦味形成的关键转录因子[9];CsERFs和CsHDAs基因表达水平与黄瓜果实冷害有一定的关系[10];潘健等报道部分ERF基因家族成员参与雌花分化初期的基因表达调控[11]。至今,ERF转录因子与镉胁迫相关的研究鲜见报道,因此本研究拟以前期通过转录组学方法筛选获得应答镉胁迫的转录因子CsERF7为研究对象,验证其与硒和镉的调节作用关系,通过对目的基因的扩增,构建CsERF7过表达载体,并对其进行生物信息学分析,最后利用农杆菌花序法转化拟南芥获得转基因植株,为CsERF7功能的深入研究提供依据,为硒介导的黄瓜耐镉机理研究奠定基础。
1材料与方法
1.1试验材料
以黄瓜津研四号为研究材料,其种子购自太原市种子公司;哥伦比亚野生型拟南芥种子、大肠杆菌DH5α感受态细胞、农杆菌GV3101感受态细胞均由武汉艾迪晶生物科技有限公司提供。所用化学试剂均采用普通分析纯,均购自生工生物工程(上海)股份有限公司。
黄瓜幼苗培养及生理指标测定和RNA测序试验于2021年10—12月进行,实时荧光定量qPCR验证、过表达载体及重组质粒轉化农杆菌、拟南芥遗传转化试验于2022年3—5月进行,所有试验均在太原科技大学生物工程实验室开展(RNA测序除外),具体试验处理和方法如下。
1.2黄瓜幼苗的培养及处理
1.2.1黄瓜种子的处理先用2%的H2O2将黄瓜种子消毒20 min,再用蒸馏水冲洗干净,并浸种2 h后置于22 ℃/18 ℃生长室内砂床发芽。
1.2.2黄瓜幼苗水培试验设计及分析测定项目黄瓜幼苗长至2叶1心期,选生长均匀一致的黄瓜植株移苗至水培溶液中放置在温室内培养。水培容器为3 L水桶,每桶盛培养液2.5 L,每桶6穴,每穴2株,海绵固定。营养液pH值调至5.8±0.1,基本培养液预培养7 d后进行镉、硒处理:对照(CK,基本培养液)、3 μmol/L Se、50 μmol/L Cd、50 μmol/L Cd+3 μmol/L Se,并分别记作CK、Se、Cd、Cd+Se,各处理随机排列,重复3次;24 h保持通气,每隔5 d更换培养液。处理10 d后各处理间有了显著差异,收集叶片,清洗表面灰尘,并在液氮中迅速冷冻后置于-80 ℃超低温冰箱中备用;并分析测定黄瓜株高、根长、SPAD值和生物量[12-13]。
1.3RNA-seq高通量测序
采用Illumina HiSeqTM高通量测序平台在北京诺禾致源科技股份有限公司进行黄瓜叶片RNA-seq测序,原始序列过滤后得到clean reads。选取HISAT软件将过滤后的测序序列进行基因组定位分析;经过组装、比较,新转录本预测;最后,采用HTSeq软件union模型对各样品进行基因表达水平分析,采用DEGSeq软件对构建的基因作差异分析,差异基因筛选的阈值设置为q值<0.005,然后筛选硒和镉处理黄瓜幼苗中差异表达的转录本。结合差异表达转录本的q值及在叶片中的基因表达丰度值,最终选取CsERF7作为本研究对象。
1.4实时荧光定量qPCR验证
根据GenBank中β-actin基因(登录号:XM_011659465)和测序后转录本CsERF7的序列(登录号:Csa7G432080),利用Primer BLAST在线设计特异性荧光定量PCR所用引物。引物序列分别为β-actin,F:5′-GAATCCAGCACGATACCA-3′,R:5′-TCAACCCAAAGGCTAACA-3′,预计扩增长度为136 bp;CsERF7,F:5′-CCGAGCTACCTCGCATACAG-3′,R:5′-TCCGAGGTCTAGCAGCTCTT-3′,预计扩增长度为228 bp。引物均由南京金斯瑞生物科技有限公司合成。
总RNA的提取采用上述各處理的冷冻叶片,用液氮研磨后采用Trizol法提取,琼脂糖凝胶电泳结合超微量紫外可见分光光度计检测浓度、纯度及完整性。cDNA的合成严格按照反转录试剂盒说明书执行。PCR反应体系为25 μL,单管含有12.5 μL 2×SYBR green,各0.2 μL上游和下游引物,11.1 μL ddH2O和1 μL cDNA模板。荧光定量PCR在CFX 实时荧光PCR检测系统(BioRAD)里进行,反应程序:95 ℃预变性5 min;95 ℃变性10 s,60 ℃ 退火30 s,72 ℃延伸45 s,循环40次。每个样品设置3次重复。cDNA产物用Actin引物作参照用于定量RT-PCR,对照(CK)的表达设为1。
1.5过表达载体pEGOEP35S-H-ERF7-GFP的构建
CsERF7基因引物设计方法和合成公司同上,并在上下游两端分别加上保护碱基和EcoRⅠ、HindⅢ 限制性内切酶酶切位点(下划线处序列)。引物序列为F:5′-ACTAGGGTCTCGCACC ATGGCTCGTCCACAACAACG-3′,R:5′-ACTAGGGTCTCTGCC TGTAATAATTTCGAATGATCCGAGGT-3′,预计扩增片段长度为588 bp。
采用上述引物和cDNA模板进行目的片段扩增并回收,与改造后的载体pEGOEP35S-H 连接,转化大肠杆菌、菌检、提取质粒测序,测序结果序列与目的片段序列比对一致,即为该过表达载体构建成功。
1.6重组质粒转化农杆菌
取100 μL冰冻的农杆菌感受态细胞GV3101,加5 μL上述质粒DNA;迅速转入37 ℃解冻;在 37 ℃ 温浴5 min(无振荡);加入1 mL LB液体培养基,并转移至10 mL离心管中,28 ℃、260 r/min振荡,预表达2~4 h;取适当体积均匀涂布于含有抗生素的LB平板;28 ℃ 培养2~4 d,即可观察到转化子。
挑取单菌落克隆到5 mL LB培养基中28 ℃培养24~40 h,作PCR验证,挑取阳性PCR的克隆1个,将此菌液取100 μL加入100 μL 30%甘油(提前灭菌)。充分涡旋混匀,室温放置数小时,每30 min到1 h混匀1次。最后储藏于-80 ℃待用。
1.7农杆菌介导的拟南芥遗传转化
首先,将哥伦比亚野生型拟南芥播种之后用保鲜膜覆盖达到保温保湿的效果。待拟南芥长出2张真叶时移栽,移栽后的苗用保鲜膜保湿3~4 d即可揭去保鲜膜,1个月左右莲座叶可以覆盖塑料杯,此时幼苗的浇水量要适中。当生长至第1次抽茎产生第1轮花蕾时,摘去该花蕾,在短日照的情况下让拟南芥营养生长,在侵染1周左右可将其置于长日照下,当其旁支的第2花蕾的枝条长2~10 cm时进行浸染。取出上述-80 ℃保存的含有重组质粒的农杆菌室温解冻后浸染花序,第1次侵染前要去除已长出的角果,第1次侵染之后隔1周侵染1次,侵染2~3次,侵染之后植株不能缺水;每次浸染后用塑料薄膜套袋24 h,取掉薄膜后用去离子水洗去残余菌液,大约3周后等拟南芥角果泛黄干燥后收种子。
将T0种子用75%乙醇洗30 s左右,之后用无菌水清洗2次,再用30%次氯酸钠浸泡10 min左右,用无菌水洗2~3次,用无菌水浸泡1 h后,用01%的琼脂水溶液悬浮后,转移至含潮霉素的MS筛选培养基。待拟南芥长出2张真叶且长势较好时移栽,移栽后的苗用保鲜膜保湿3~4 d即可揭去保鲜膜,适量浇水,1个月左右莲座叶可以覆盖塑料杯。约1个月后,待拟南芥长到一定大小之后用CTAB法提取DNA,进行PCR检测。
1.8生物信息学分析
使用BLAST对黄瓜CsERF7基因编码氨基酸序列进行同源性比对;使用Prot-Param分析CsERF7基因基本理化性质;利用在线工具NCBI-CDS里的SMART软件预测蛋白保守结构域;利用在线软件NetPhos 3.1分析ERF7蛋白的潜在磷酸化位点;利用PSORT Ⅱ预测ERF7蛋白的亚细胞定位;通过SignalP 4.1 Server在线工具进行信号肽预测分析,在线软件TMHMM 2.0预测跨膜螺旋区,SOPMA预测二级结构,使用SWISS-MODEL进行三级结构预测,使用ProtScale分析蛋白质的亲疏水性。利用MEGA 11软件,采用NJ邻接法构建系统进化树;采用BioAider V1.423软件进行序列相似性分析。
2结果与分析
2.1RNA-seq转录组测序结果
由表1可知,RNA-seq-CsERF7在镉处理组和镉+硒复合处理组中的表达丰度非常高,其中镉处理表达丰度为对照的2.104倍,镉+硒处理表达丰度为单独镉处理的5.600倍,推测其可能在外源硒介导的黄瓜耐镉胁迫中扮演着重要的角色。因此,选择CsERF7作为后续研究对象。
2.2外源硒对镉胁迫下黄瓜幼苗生长的影响
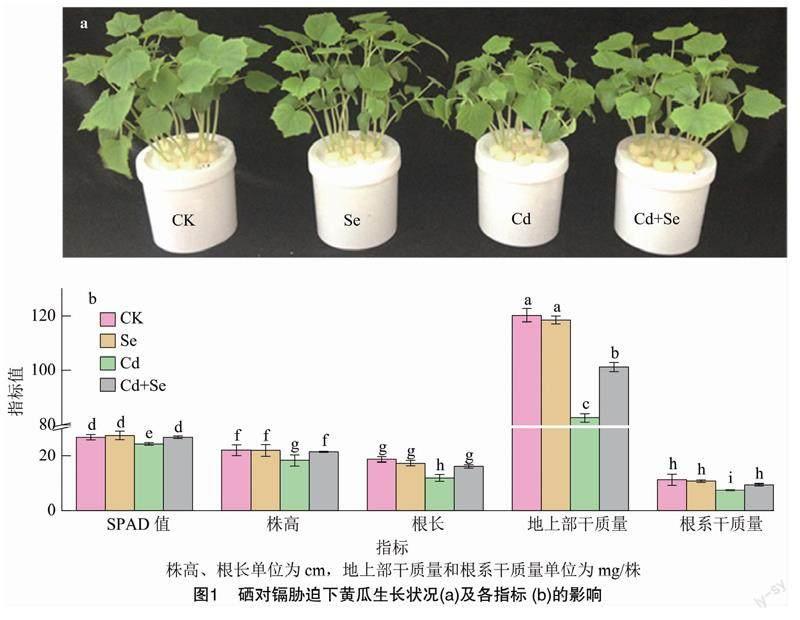
黄瓜幼苗在50 μmol/L Cd处理5 d后受到了显著的抑制,主要表现为植株矮化,叶片发黄(图1-a);根长比对照显著下降36.64%,地上部和根系干质量分别比对照下降了31.32%和33.57%,其中根长受到的影响尤为严重。3 μmol/L外源硒(Cd+Se处理)显著缓解了50 μmol/L Cd引起的黄瓜幼苗毒害症状,SPAD值较单一镉处理上升9.61%,同时增加黄瓜生物量积累,对根长和根系干质量的缓解效果最为明显;在无镉条件下添加硒对黄瓜幼苗的生长没有显著效应(图1-b)。进一步表明,外源亚硒酸钠能显著缓解镉胁迫下黄瓜受到的毒害现象。
2.3CsERF7 qPCR鉴定结果
为验证RNA-seq测序结果的准确性,对CsERF7进行qPCR鉴定。由图2-a可知,镉处理CsERF7表达丰度是对照的56%;而镉+硒复合处理与单独镉处理相比表达丰度显著升高,比单独镉处理上调表达4.53倍。此表达结果与RNA-seq测序结果完全相符。
2.4黄瓜CsERF7基因扩增
提取黄瓜幼苗镉+硒处理的叶片总RNA反转录成cDNA,PCR扩增后电泳检测出约588 bp的条带,说明已成功扩增出黄瓜CsERF7基因编码区序列(图2-b)。
2.5黄瓜过表达载体pEGOEP35S-H-ERF7-GFP的构建
将上述目标基因片段转化感受态细胞DH5α,提取质粒并使用EcoRⅠ和HindⅢ 对表达载体进行双酶切鉴定(图2-c);电泳检测后观察到预期目的片段793 bp的条带。经测序比对,序列结果与已知的CsERF7基因序列完全匹配。
2.6拟南芥遗传转化研究
利用冻融法将载体pEGOEP35S-H-ERF7-GFP转入农杆菌GV3101,以花序浸染法进行拟南芥遗传转化,依次经过质粒农杆菌转化子,拟南芥培养、浸染、筛选培养、潮霉素抗性基因的PCR检测后获得T1代拟南芥转基因种子(图3)。
2.7CsERF7生物信息学分析
2.7.1CsERF7基因编码氨基酸序列分析序列分析结果表明,CsERF7基因可编码196个氨基酸(图4-a),相对分子量为22 393.94 u;在线ProtParam软件预测CsERF7蛋白理论等电点为6.35,原子总数为3 080,分子式为C980H1 503N287O302S8,相对分子量为22 393.94 u,带负电荷残基总数(Asp+Glu)21个,带正电荷残基总数(Arg+Lys)18个,脂肪指数67.81,总平均亲水性预测为-0.753,属于亲水蛋白,不稳定指数为53.24,属于不稳定蛋白。
2.7.2黄瓜ERF7蛋白保守结构域预测与分析对黄瓜ERF7蛋白保守结构域预测分析表明,该蛋白属于AP2/ERF家族、 AP2亚家族, 在多肽链的N端第7~70位氨基酸之间存在AP2结构域,代表DNA结合结构域,无其他特征(图4-a)。
2.7.3黄瓜ERF7蛋白质信号肽、跨膜结构预测分析对黄瓜ERF7蛋白进行信号肽分析, 发现该蛋
白质无信号肽,属于非分泌型蛋白。利用软件TMHMM 2.0对黄瓜ERF7蛋白的跨膜螺旋区进行预测,结果未发现跨膜螺旋区,表明该蛋白属非跨膜蛋白。
2.7.4黄瓜ERF7磷酸化位点、亚细胞定位分析在黄瓜转录因子ERF7蛋白中,共有22个磷酸化位点,其中16个丝氨酸(S)磷酸化位点、4个酪氨酸(Y)磷酸化位点、2个苏氨酸(T)磷酸化位点。黄瓜ERF7蛋白的亚细胞定位预测显示,黄瓜ERF7蛋白65.2%的概率分布在线粒体中,其次分布在细胞核内,在细胞质和内质网中也有分布(表2);推测黄瓜ERF7转录因子定位于线粒体中。
2.7.5黄瓜ERF7空间结构与亲疏水性分析黄瓜ERF7蛋白二级结构分析结果显示,此蛋白包括103个无规卷曲,占52.55%;71个α-螺旋,占3622%;15个延伸链,占7.65%;7个β-转角,占357%(图4-a、表3)。
采用SWISS-MODEL進行同源建模,在11个相关蛋白模板的基础上构建出的三级结构模型见图4-b,其中螺旋部位代表α-螺旋,其余部位代表延伸链,结果与二级结构高度一致。从图4-b可以看出,此模型的全球性模型质量估测结果(GMQE值)为0.18,序列相似性为53.03%,模型结果可信。
采用ProtScale分析蛋白质亲疏水性,结果发现,CsERF7蛋白质的疏水性最大值1.556在84位点,最小值 -3.256 在158和159位点,平均亲水性(GRAVY)为-0.788(图5)。根据GRAVY数值为负可推测黄瓜ERF7蛋白为亲水性蛋白,与理化性质分析结果一致。
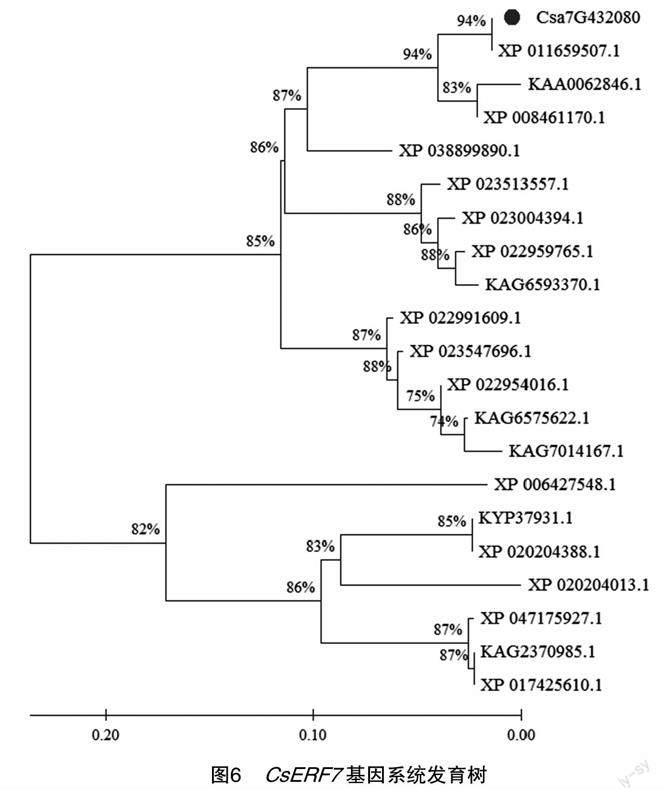
2.7.6CsERF7基因同源性对比分析及系统发育树构建将黄瓜CsERF7基因的编码区(CDS)序列同源性相近的20个物种(表4)进行系统进化树构建,结果(图6)显示,CsERF7基因编码区序列与黄瓜XP_011659507.1在系统进化关系上最亲密,其次是甜瓜KAA0062846.1和XP_008461170.1,在同一分支下的还有南瓜、西葫芦、冬瓜,说明它们之间的亲缘关系较近;其余的赤豆、木豆等亲缘关系较远。
3讨论与结论
本研究利用前期转录组试验数据库,通过克隆成功获得了CsERF7基因的开放阅读框(ORF)全长,序列分析结果表明,CsERF7含有1个AP2保守结构域,ORF全长588 bp,编码196个氨基酸,属于AP2/ERF家族的AP2亚家族;黄瓜ERF7有1个丝氨酸(S)磷酸化位点,推测其在ERF7蛋白功能中发挥作用;该基因与黄瓜XP_011659507.1亲缘关系最近,其次是甜瓜KAA0062846.1和 XP_008461170.1。通过转基因技术,将CsERF7基因转入拟南芥中,获得了转基因植株。在外源硒对镉胁迫下黄瓜幼苗生长状态的研究中发现,外源硒显著缓解了黄瓜镉胁迫现象;预测黄瓜CsERF7可能与解毒、耐镉等生物学功能相关。
目前,有关ERFs在黄瓜上的研究有AP2/ERF家族转录因子调控黄瓜苦味基因Bi的表达[9],也有ERFs参与调控黄瓜果实贮藏冷害机制[10],调控黄瓜果实贮藏冷害及其与膜脂代谢关系的研究[14];另外, 蒙林平通过转录组学研究发现, ERFs在油菜素内酯诱导黄瓜幼苗疫病的抗性方面发挥作用[15],随后有报道称ERFs在外源油菜素内酯介导的黄瓜耐盐性方面起调控作用[16], ERFⅦ在调控黄瓜耐涝性的分子机制方面发挥重要作用[17],但ERFs在调控黄瓜耐镉性上鲜见报道。
本研究已完成了CsERF7基因序列和蛋白分析,CsERF7基因属于AP2/ERF家族的AP2亚家族,ORF长度588 bp,编码196个氨基酸,有1个AP2结构域。该蛋白属于非跨膜亲水性蛋白,亚细胞定位预测定位于线粒体中,存在22个氨基酸磷酸化位点。其二级结构主要由α-螺旋和延伸链构成,二级结构与三级结构预测结果高度一致,同源基因进化树分析表明该基因与黄瓜XP_011659507.1亲缘关系最近,其次是甜瓜XP_008461170.1,同时成功构建了植物超表达载体pEGOEP35S-H-ERF7-GFP。本研究克隆得到了黄瓜CsERF7基因,成功构建过表达载体pEGOEP35S-H-ERF7-GFP,利用农杆菌花序法转化拟南芥,经PCR检测,获得拟南芥转基因植株,该研究结果为该基因功能的深入研究提供了理论依据和基础。
参考文献:
[1]Chang C Y,Yin R S,Zhang H,et al. Bioaccumulation and health risk assessment of heavy metals in the soil-rice system in a typical seleniferous area in central China[J]. Environmental Toxicology and Chemistry,2019,38(7):1577-1584.
[2]Clemens S,Aarts M G M,Thomine S,et al. Plant science:the key to preventing slow cadmium poisoning[J]. Trends in Plant Science,2013,18(2):92-99.
[3]Gu C,Guo Z H,Hao P P,et al. Multiple regulatory roles of AP2/ERF transcription factor in angiosperm[J]. Botanical Studies,2017,58(1):6.
[4]Nakano T,Suzuki K,Fujimura T,et al. Genome-wide analysis of the ERF gene family in Arabidopsis and rice[J]. Plant Physiology,2006,140(2):411-432.
[5]Aya K,Hobo T,Sato-Izawa K,et al. A novel AP2-type transcription factor,SMALL ORGAN SIZE1,controls organ size downstream of an auxin signaling pathway[J]. Plant and Cell Physiology,2014,55(5):897-912.
[6]Licausi F,Ohme-Takagi M,Perata P. APETALA2/Ethylene Responsive Factor (AP2/ERF) transcription factors:mediators of stress responses and developmental programs[J]. New Phytologist,2013,199(3):639-649.
[7]Hu L F,Liu S Q. Genome-wide identification and phylogenetic analysis of the ERF gene family in cucumbers[J]. Genetics and Molecular Biology,2011,34(4):624-633.
[8]Wang C H,Xin M,Zhou X Y,et al. The novel ethylene-responsive factor CsERF025 affects the development of fruit bending in cucumber[J]. Plant Molecular Biology,2017,95(4):519-531.
[9]張慧敏,张雷,马永硕,等. 调控黄瓜苦味基因Bi的AP2/ERF家族转录因子[J]. 园艺学报,2014,41(4):672-680.
[10]王晓晨. ERFs参与调控黄瓜果实贮藏冷害机制研究[D]. 广
州:华南农业大学,2016:47-48.
[11]潘健,温海帆,何欢乐,等. 黄瓜ERF基因家族鉴定及其在雌花芽分化中的表达分析[J]. 中国农业科学,2020,53(1):133-147.
[12]Sun H Y,Dai H X,Wang X Y,et al. Physiological and proteomic analysis of selenium-mediated tolerance to Cd stress in cucumber (Cucumis sativus L.)[J]. Ecotoxicology and Environmental Safety,2016,133:114-126.
[13]Sun H Y,Wang X Y,Wang Y N,et al. Alleviation of cadmium toxicity in cucumber (Cucumis sativus) seedlings by the application of selenium[J]. Spanish Journal of Agricultural Research,2016,14(4):e1105.
[14]赵普莹. ERFs调控黄瓜果实贮藏冷害及其与膜脂代谢关系研究[D]. 广州:华南农业大学,2018:1-3.
[15]蒙林平. 油菜素内酯诱导黄瓜幼苗疫病抗性的转录组学研究[D]. 广州:华南农业大学,2018:1-2.
[16]李巧丽. 外源油菜素内酯对黄瓜耐盐性的调控[D]. 兰州:西北师范大学,2020:1-2.
[17]王凯旋. ERFⅦ调控黄瓜耐涝性的分子机制解析[D]. 扬州:扬州大学,2021:64-66.

