致马属动物流产沙门氏菌通用型间接ELISA抗体检测方法的建立与应用
郭奎,张泽楠,李帅杰,初晓雨,王垚鑫,郭巍,胡哲,王晓钧
致马属动物流产沙门氏菌通用型间接ELISA抗体检测方法的建立与应用
郭奎,张泽楠,李帅杰,初晓雨,王垚鑫,郭巍,胡哲,王晓钧
中国农业科学院哈尔滨兽医研究所/动物疫病防控全国重点实验室,哈尔滨 150069
【目的】通过筛选引起马流产的4种沙门氏菌()共同的优势抗原,建立一种敏感高、特异强的通用型间接ELISA(iELISA)抗体检测方法,实现对马群中沙门氏菌抗体的快速高通量检测。【方法】首先利用马流产沙门氏菌阳性血清、阴性血清分别与马流产沙门氏菌全菌抗原进行免疫共沉淀(pull down)试验,筛选出马流产沙门氏菌优势抗原;根据质谱分析结果找到优势抗原基因,将优势抗原基因与其他3种致马流产沙门氏菌病的鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌进行序列比对验证其保守性;其次根据抗原性分析对优势抗原编码基因进行分段表达,设计3对引物,利用聚合酶链式反应(polymerase chain reaction,PCR)扩增沙门氏菌优势抗原基因并将其分别克隆至原核表达载体pET28a;测序分析后将构建正确的重组质粒分别转化入大肠杆菌()Rosetta(DE3)中并加入0.6 mmol·L-1异丙基-β-D-硫代半乳糖甘(Isopropy-β-D-thiogalactoside,IPTG)进行诱导表达,观察蛋白的表达形式;蛋白纯化后通过Western blot验证蛋白的反应原性和广谱性;然后利用纯化后蛋白作为包被抗原,通过对包被抗原量、血清和第二抗体浓度等条件进行优化建立马流产沙门氏菌病间接ELISA抗体诊断方法,并对该方法的特异性、敏感性进行评估。最后将该方法应用于试验感染马血清及临床样本的检测,并将检测结果同凝集试验结果比较。【结果】筛选出的马流产沙门氏菌优势抗原是ompA(Outer Membrane Protein, OMP),通过序列比对,该蛋白氨基酸序列与同属鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌同源性99.4%—100%,具有很好的保守性;PCR扩增后成功获得3条与预期符合的目的基因;成功构建了pET28a-、pET28a-、pET28a-3个重组质粒。SDS-PAGE结果表明,在24 ℃、0.6 mmol·L-1IPTG诱导5 h下,含有pET28a-、pET28a-、pET28a-的重组菌均表达了相应蛋白,其中重组ompA1和ompA2蛋白以包涵体形式表达,重组ompA3蛋白以可溶性形式表达;Western blot显示,重组蛋白ompA3可与马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌阳性血清发生特异性反应,证明重组ompA3蛋白具有良好的反应原性,可以作为沙门氏菌属抗血清检测用抗原;以ompA3蛋白作为包被抗原建立了间接ELISA方法,在最大P/N比确定的最佳反应条件如下:最佳包被抗原浓度为1 μg·mL-1,待检血清(1﹕200)37 ℃作用1 h,酶标抗马二抗(1﹕10 000稀释),TMB在37 ℃孵育10 min,待检血清OD450>0.143判定为阳性,特异性试验结果显示,该包被抗原与常见马传染病阳性血清无交叉反应。通过对沙门氏菌静脉注射感染马的血清样品进行抗体检测,iELISA可以持续监测抗体阳性到116 d,相比微量凝集(69 d)多监测了47 d,因此iELISA具有更好的敏感性。利用建立的iELISA方法对8个不同牧场180份血清进行抗体检测,其抗体平均阳性检出率为63.3%,比微量凝集阳性检出率高53.9%。【结论】成功筛选到了马流产沙门氏菌病4种病原的共同优势抗原ompA,实现了对该蛋白的可溶性表达,建立了马流产沙门氏菌病通用型iELISA抗体诊断方法,该方法可以实现对临床样本马流产沙门氏菌抗体的检测,该方法具有特异性强、敏感性高,可以作为马流产沙门菌病抗体检测的一种有效工具。
马流产沙门氏菌病;ompA;通用型;iELISA;诊断
0 引言
【研究意义】通过免疫共沉淀法(pull down)试验筛选到了马流产沙门氏菌的优势抗原,建立了一种马流产沙门氏菌病通用性的ELISA抗体检测方法,为马流产沙门氏菌病的诊断和防控奠定基础。【前人研究进展】沙门氏菌病是一种重要的细菌性疾病,给养猪业、禽业、鸽业、马、驴等产业带来巨大的经济损失[1-4]。马流产沙门氏菌病(equine abortus salmonellosis),又称为马副伤寒(equi paratyphoid),是由马流产沙门氏菌(Abortusequi,Abortusequi)、鼠伤寒沙门氏菌(Typhimurium)、都柏林沙门氏菌(Dublin)、肠炎沙门氏菌(Enteritidis)等引起的以孕马流产为主要特征的马属动物传染病[5-6]。其中马流产沙门氏菌是最主要的病原,先前也有鼠伤寒沙门氏菌单独或与马流产沙门氏菌混合感染导致驴流产及驴驹腹泻[7]的报道,而都柏林沙门氏菌、肠炎沙门氏菌引起的马驴发病并不多见,鲜有报道。早在18世纪末19世纪初,欧美地区发生过大批马流产的现象,20世纪70年代末,我国华北、西北、东北等养马地区也陆续暴发马流产沙门氏菌病,并给当时的马业带来了严重的经济损失。尽管该病在欧洲国家及美国等得到严格控制[8],但仍有一些国家零散发生疫情,2016年克罗地亚[9]报道发生了2起由马流产沙门氏菌导致的马匹流产,流产率分别为11%(2/18)和44%(18/38);在阿根廷和日本等国家也有报道[10-11];我国在20世纪80年代多次报道该病[12-15],但在之后的30多年中鲜有该病的报道,因此也一直没有引起行业内对该病的关注。关于马流产沙门氏菌病,国内外的相关研究并不深入,是一种常被忽视的传染病。自2014年我国内蒙古东部最先出现大批马流产,流产率高达66.7%(80/120),此后的几年里,我国频繁报道该病的发生[4, 16-19],流产率为20%—100%,该病的发生直接影响了我国马匹的存栏量并对马业造成了严重的经济损失。随着集约化饲养模式的发展,驴群感染马流产沙门氏菌病的现象也不断出现,给我国养驴业带了灾难性打击[16-18, 20]。该病目前仍呈蔓延的趋势,对我国马、驴业的持续发展产生了潜在的威胁和巨大的影响,将会严重阻碍我国马、驴业的发展。关于马流产沙门氏菌病诊断血清学方法,主要有试管凝集试验、微量凝集试验、ELISA等;本团队前期建立了马流产沙门氏菌微量凝集试验[19],并利用微量凝集检测方法对151份马血清样品进行了检测,流产暴发区马流产沙门氏菌抗体阳性率27.3%—42.9%,相比试管凝集敏感性提高,但阳性检出率与临床流产率差距仍很大;国外研究人员利用脂多糖(LPS)建立iELISA抗体检测方法用于马流产沙门氏菌抗体检测,具有较好敏感性,但特异性仍需要进一步评估[21]。【本研究切入点】目前没有关于马流产沙门氏菌病通用型的ELISA血清学诊断方法,传统的试管凝集和微量凝集都存在敏感性低的缺点,急需建立一种敏感性高、特异性好且可同时检测马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌抗体的通用型的ELISA方法。获得体外表达的候选蛋白是建立间接ELISA检测血清抗体的先决条件,本研究首先利用Pull-down试验筛选出马流产沙门氏菌的优势抗原ompA,而是编码沙门氏菌的外膜蛋白(outer membrane protein, OMP),编码的蛋白也是其主要表面抗原成分,在致病机制中起到重要作用[22],该蛋白具有良好的免疫原性能刺激宿主产生较好的细胞免疫和体液免疫[23];外膜蛋白基因分布广泛,序列高度保守,属内同源性达95%以上,与其他属同源性在68%以下,具有良好的种属特异性,适合用作沙门氏菌早期感染的诊断特异蛋白[24]。【拟解决的关键问题】本研究利用Pull down筛选马流产沙门氏菌的优势抗原,明确该抗原的检测特异性范围,并将其克隆到表达载体通过截短分段表达来实现可溶性表达,旨在建立一种马流产沙门氏菌病通用型ELISA抗体诊断方法,为临床马流产沙门氏菌病的诊断和防控提供一种有效工具。
1 材料与方法
试验于2018年3月至2022年3月在中国农业科学院哈尔滨兽医研究所,动物疫病防控全国重点实验室,由马传染病与慢病毒病研究创新团队进行。
1.1 质粒和菌株及样品
马流产沙门氏菌菌种180316H.AES.G(其菌种保藏编号为:CGMCC No.18341)由哈尔滨兽医研究所马传染病与慢病毒创新团队分离鉴定,原核表达宿主菌Rosetta(DE3)购自TIANGEN,pET28a载体由动物疫病防控全国重点实验室保存;180份临床样品来自8个不同的牧场,130份沙门氏菌阴性血清、感染马及对照马共58份血清由动物疫病防控全国重点实验室制备及保存。马传染性贫血病毒(equine infections anemia virus,EIAV)、马流感病毒(equine influenza virus,EIV)、马疱疹病毒(equine herpes virus,EHV)、马动脉炎病毒(equine arteritis virus,EAV)、马泰勒虫(,)、驽巴贝斯虫(,)马链球菌()、大肠杆菌()、马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌等阳性血清由该实验室制备及保存。
1.2 主要试剂
IPTG购自宝生物工程(大连)有限公司;DNA Marker DL 2000,T4 DNA连接酶,购自上海生工生物工程有限公司;琼脂糖为Promega公司产品,兔源马流产沙门氏菌阳性血清购自中国兽医药品监察所;细菌基因组DNA提取试剂盒购自TIANGEN。HRP标记的抗马IgG二抗(KPL)。
1.3 马流产沙门氏菌优势抗原的筛选
首先对马流产沙门氏菌阳性、阴性血清IgG的纯化,利用0.45 μm滤膜分别将2 mL马流产沙门氏菌阳性血清和阴性血清进行过滤处理,抗体纯化按照HiTrap Protein G HP(GE)说明书进行操作。其次制备马流产沙门氏菌抗原复合物,在生物安全柜中取8 mL处于对数期的马流产沙门氏菌新鲜菌液,4 ℃,10 000 r/mim 离心2 min后收集菌体,然后加入2 mL 无菌PBS重悬,离心弃上清,充分清洗菌体2次。然后加入1.5—2 mL无菌PBS重悬,进行超声破碎。功率39%,工作3 s,间歇5 s,工作5 min。最后将细菌裂解物,4 ℃,10 000 r/min 离心2 min,取上清,利用BCA测蛋白浓度,并调蛋白浓度为1 mg·mL-1备用。然后参照文献[25]方法对马流产沙门氏菌抗体与抗原进行pull-down试验;最后对质谱结果进行分析。
1.4 ompA的克隆
根据质谱分析结果参考序列,将ompA基因按照以下引物进行扩增(表1),反应体系20 μL:2×Taq Master Mix,10 μL;上下游引物,1 μL;ddH2O,6 μL;模板,2 μL;反应条件为:预变性95 ℃5 min;95℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s(600 bp 以内延伸30 s、600—1 000 bp延伸60 s、1 000—1 500 bp 延伸90 s),共35个循环;72 ℃终延伸10 min;待PCR反应结束后取7 μL PCR产物进行1%的琼脂糖凝胶电泳分析。依据Gel Extraction Kit琼脂糖凝胶DNA回收试剂盒说明书,纯化回收特异的DNA条带。pET28a载体和目的片段分别用H I和I I进行双酶切,回收纯化基因和线性化的pET-28a。用T4 DNA连接酶连接ompA基因和线性化的pET-28a,将连接产物转化入Rosetta,涂布于卡那抗性的LB固体培养基,37 ℃培养16 h。对阳性克隆菌落提取质粒,经过PCR方法鉴定阳性质粒送库美生物进行测序,测序正确后质粒命名为pET28a-1、pET28a-2、pET28a-3。
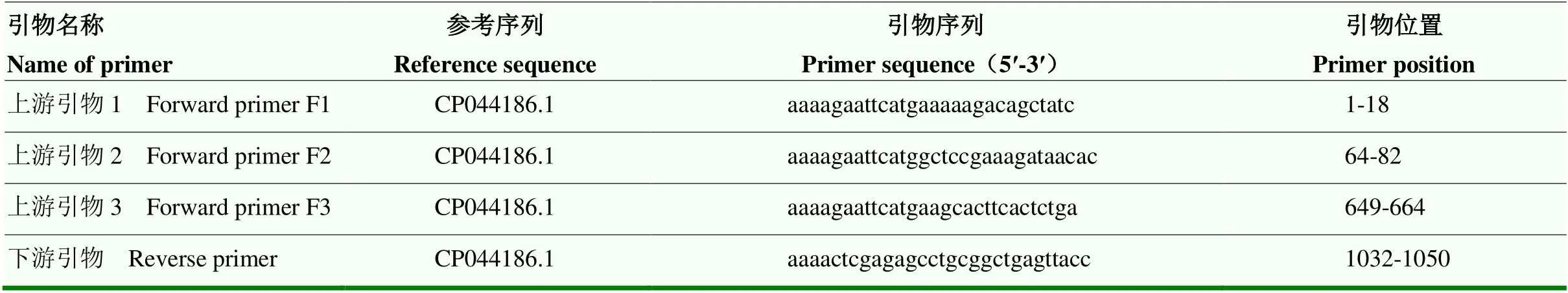
表1 PCR扩增引物
1.5 ompA蛋白的表达
将阳性菌落接种于5 mL含有1 µg·mL-1卡那青霉素(Kanamycin,Kan)的新鲜LB液体培养基中,在37 ℃下170 r/min震荡培养16 h,以1﹕100比例接种于Kan/LB液体培养基中,37 ℃170 r/min培养,等到菌液OD600nm为0.3—0.4左右时,加入终浓度为0.6 mmol·L-1的IPTG,24 ℃进行诱导表达。诱导后,取4 mL菌液,进行富集菌体并加入1.5 mL PBS进行超声破碎,38%功率,超5 s停5 s,工作时长2 min;破碎后,4 ℃、12 000 r/min离心5 min,上清备用。沉淀同样用等量PBS冲洗两遍,再用等量PBS重悬。分别取40 µL上清样品和沉淀重悬样品并各加入10 µL 5 x SDS-PAGE Loading Buffer 混合均匀,95 ℃煮沸5 min,利用4%—12%或12%的蛋白胶进行SDS- PAGE;电泳结束后,用于考马斯亮蓝染色,分析蛋白的表达情况。对可溶性蛋白纯化后进行Western blot分析,分别以马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌阳性血清和沙门氏菌阴性血清为一抗(1﹕200稀释),HRP标记的抗马IgG为二抗(1﹕5 000)进行Western blot分析,验证蛋白的反应原性和广谱性。
1.6 间接ELISA方法的建立
用棋盘法确定最佳ompA3蛋白包被浓度和血清样品、酶标二抗(HRP标记抗马IgG二抗)的稀释倍数。用磷酸盐缓冲液将重组ompA3蛋白稀释成1、0.5及0.25 µg·mL-1,取100 µL/孔包被96孔酶标板4 ℃过夜,将马流产沙门氏菌阳性、阴性血清按1﹕200—1﹕1 600进行2倍倍比系列稀释,酶标二抗做1﹕8 000、1﹕10 000、1﹕12 000、1﹕15 000稀释,进行间接ELISA,加入TMB,作用10 min酶标仪检测OD450nm值。选取P/N值最大(P/N为阳性血清与阴性血清在相同稀释度下OD450nm值的比值),且满足阴性血清OD450 nm<0.1时的抗原包被浓度、血清稀释度、酶标二抗稀释度为最佳反应条件。利用建立的间接ELISA方法对130份马流产沙门氏菌阴性血清进行检测,计算全部阴性血清OD450nm的平均值(X)和标准差(SD),并确定X+3SD作为该方法检测临床马流产沙门氏菌抗体阳性和阴性的临界值。
1.7 间接ELISA方法的特异性、敏感性检测
利用建立的iELISA检测马流产沙门氏菌、马传染性贫血病病毒、马流感病毒(H7N7、H3N8)、马动脉炎病毒、马疱疹病毒(I型、II型、III型、IV型、VII型)、马泰勒虫、驽巴贝斯虫、马腺疫链球菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌等病原的阳性血清,同时设立阴性血清对照,重复2个孔,验证该方法的特异性。选取马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌阳性血清,对阳性血清先进行2倍系列稀释,然后再利用iELISA方法评估4种血清的检测敏感性,其中血清的最大稀释度即为最大效价。
1.8 OmpA iELISA监测马流产沙门氏菌感染后马血清中的抗体水平。
选取沙门氏菌阴性马,以静脉方式感染注射100亿个/mL 马流产沙门氏菌,动态监测感染后ompA抗体水平,同时设立对照组马以相同方式注射1 mL PBS。感染前采血,感染后前12 d每天采血,然后每隔1周采血一次。同时利用ompA iELISA与对感染马及对照马共58份血清进行抗体监测。
1.9 马流产沙门氏菌病通用性间接ELISA方法的临床应用
采用建立的iELISA方法对4个来自流产疫情区及4个健康区牧场送检血清临床样本进行检测,并将检测结果与MAT结果进行比较。
2 结果
2.1 Pull-down探寻马流产沙门氏菌的优势抗原
通过pull-down试验,相比于对照组,试验组出现了1条特异性的条带(图1,框中标记)。将pull-down下来的特异性条带送去北京华大蛋白质研发中心有限公司进行质谱鉴定,结果该条带为ompA蛋白。通过pull-down技术筛选到的优势抗原将为下一步建立马流产沙门氏菌病诊断试剂盒奠定基础。
2.2 沙门氏菌ompA基因的克隆
利用设计的3对引物,将分成不同大小片段扩增出来,分别通过酶切后,连接到pET28a上,并转化到Rosetta。测序证实为沙门氏菌序列。将3个阳性质粒分别命名为pET28a-、pET28a-、pET28a-(图2)。
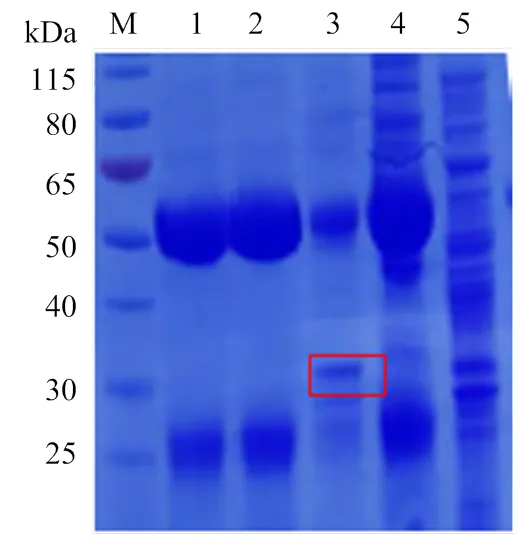
M:蛋白分子质量标准;1:马流产沙门氏菌阳性血清纯化后抗体;2:马流产沙门氏菌阴性血清纯化后抗体;3:Beeds+马流产沙门氏菌阳性血清抗体+马流产沙门氏菌抗原复合物;4:Beeds+马流产沙门氏菌阴性血清抗体+马流产沙门氏菌抗原复合物;5:马流产沙门氏菌抗原
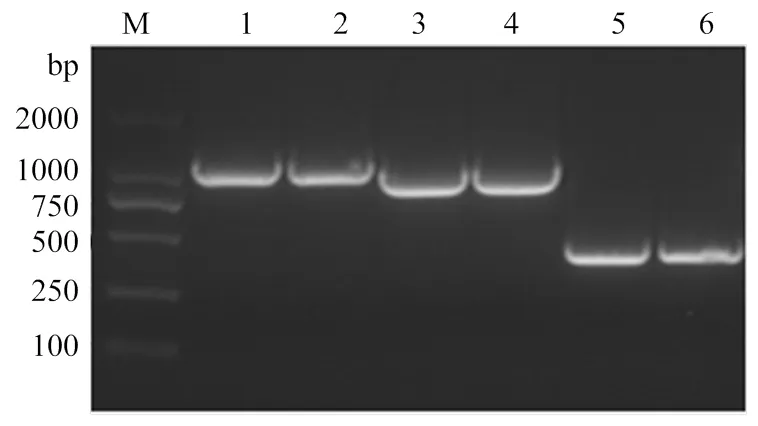
M:DM2000DNA Marker;1-2:ompA1;3-4:ompA2;5-6:ompA3
2.3 目的蛋白的诱导表达与纯化
将鉴定含有pET28a-、pET28a-、pET28a-质粒的3种表达菌进行24 ℃诱导表达,并将诱导的菌超声后进行SDS-PAGE电泳、考马斯亮蓝染色和脱色分析。结果表明ompA1和ompA2蛋白均以包涵体形式表达,ompA3蛋白以可溶性形式表达(图3)。
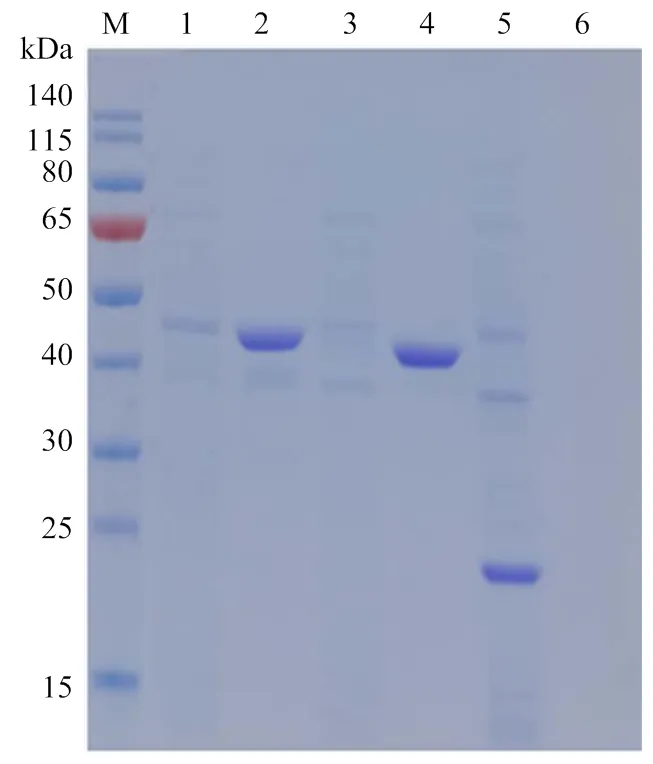
M:蛋白分子质量标准;1:ompA1蛋白诱导后的上清;2:ompA1蛋白诱导后的沉淀;3 ompA2蛋白诱导后的上清;4:ompA2蛋白诱导后的沉淀;5:ompA3蛋白诱导后的上清;6:ompA3蛋白诱导后的沉淀
2.4 ompA3蛋白的验证
以马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌阳性和沙门氏菌阴性血清,进行Western blot 分析。结果表明,马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌阳性血清均可以与ompA3蛋白反应,证实ompA3蛋白具有较好的保守性,可以作为马流产沙门氏菌病诊断的通用性抗原(图4)。
2.5 反应条件的确定
通过对iELISA方法各条件的优化,确定最佳的反应条件如下:抗原1 µg·mL-1在4 ℃过夜包被,5%的脱脂乳,在37 ℃封闭1.5 h,血清1﹕200稀释(5%脱脂乳稀释)37 ℃作用1 h,二抗1﹕10 000稀释(5%BSA稀释)37℃作用30 min,TMB显色10 min(37 ℃)。
2.6 ELISA cut off值的确定
根据130份沙门氏菌阴性血清的检测结果,平均值(X=0.097,和标准差(SD= 0.018)通过生物学统计分析方法计算出临床血清检测时阳性和阴性血清的临界值(X+3SD)为0.143,当临床血清OD值大于临界值则判为阳性,低于临界值则判为阴性。

M:蛋白分子质量标准;1:马流产沙门氏菌阳性血清;2:鼠伤寒沙门氏菌阳性血清;3:都柏林沙门氏菌阳性血清;4:肠炎沙门氏菌阳性血清;5:沙门氏菌阴性血清
2.7 特异性鉴定
利用建立的iELISA方法对马流产沙门氏菌、马传染性贫血病病毒、马流感病毒(H7N7、H3N8)、马动脉炎病毒、马疱疹病毒(I型、II型、III型、IV型、VII型)、马腺疫链球菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌等阳性血清检测,结果显示,只有马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌阳性血清的检测结果为阳性,而其他病原阳性血清检测结果均为阴性。
2.8 敏感性鉴定
对马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌标准阳性血清进行效价测定,结果表明,马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌阳性血清效价均可以达到16x。
2.9 人工感染动物血清的抗体监测
利用MAT和ompA iELISA,对感染马及对照马进行抗体检测。MAT结果表明(图5-A),在以静脉1010CFU/mL感染马时,MAT第4天抗体即可出现阳性,7—12 d达到顶峰,12 d后抗体水平逐渐下降,维持抗体阳性至69 d,之后抗体转阴性。ompA iELISA结果表明(图5-B),第7天抗体转为阳性,比MAT晚3 d。第13—20天,达到顶峰。之后不断下降。ompA iELISA维持到116 d仍为阳性水平。
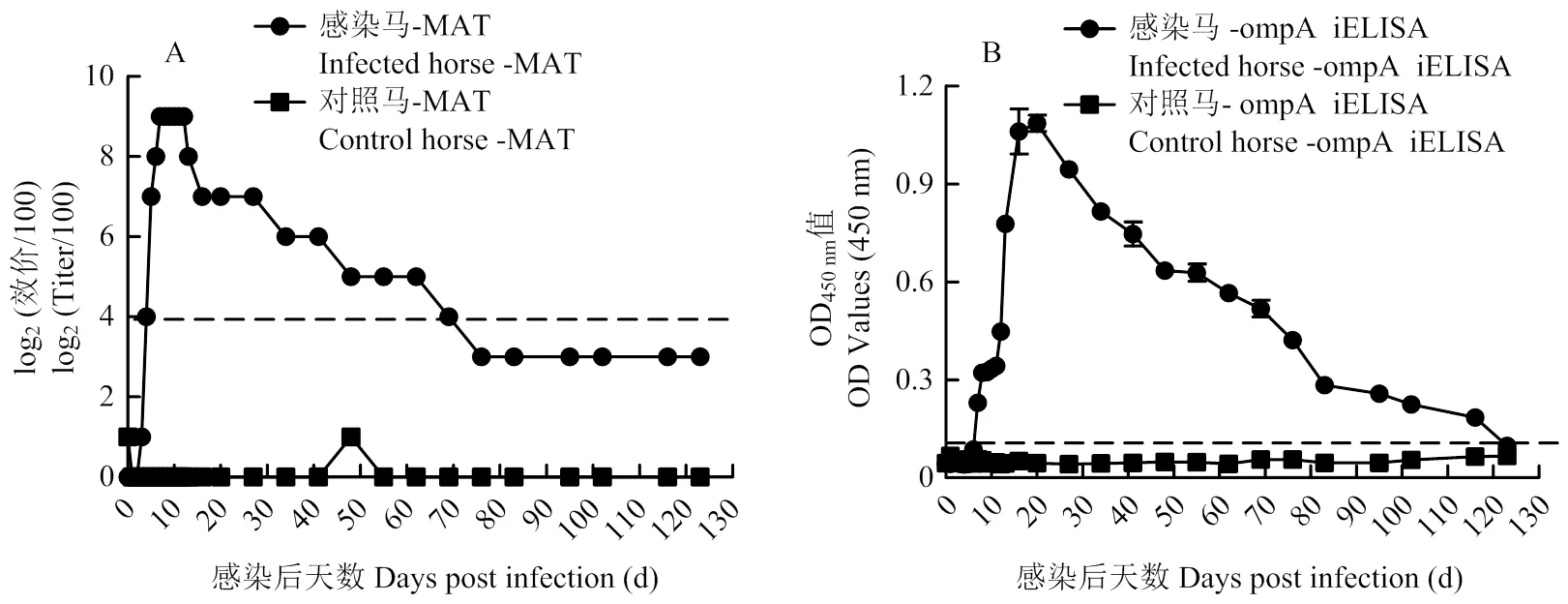
图5 对感染马及对照马血清中马流产沙门氏菌抗体的监测结果
2.10 临床样品检测
对来自8个农场的180份血清进行检测(表2),微量凝集结果表明,对于有流产流行的4个农场抗体阳性检出率为7%—42.9%,而非流产流行区抗体阳性检出率为0。而本研究建立的ompA iELISA方法,对于有流产流行4个农场,其抗体阳性检出率为42.9%—100%,而非流产流行区,抗体阳性检出率为0。同时对检测结果进行统计(表3),结果表明,微量凝集和ompA iELISA检测结果均为阳性的样品份数是14,检测结果均为抗体阴性的是66份,其中ompA iELISA比微量凝集多检出97份。
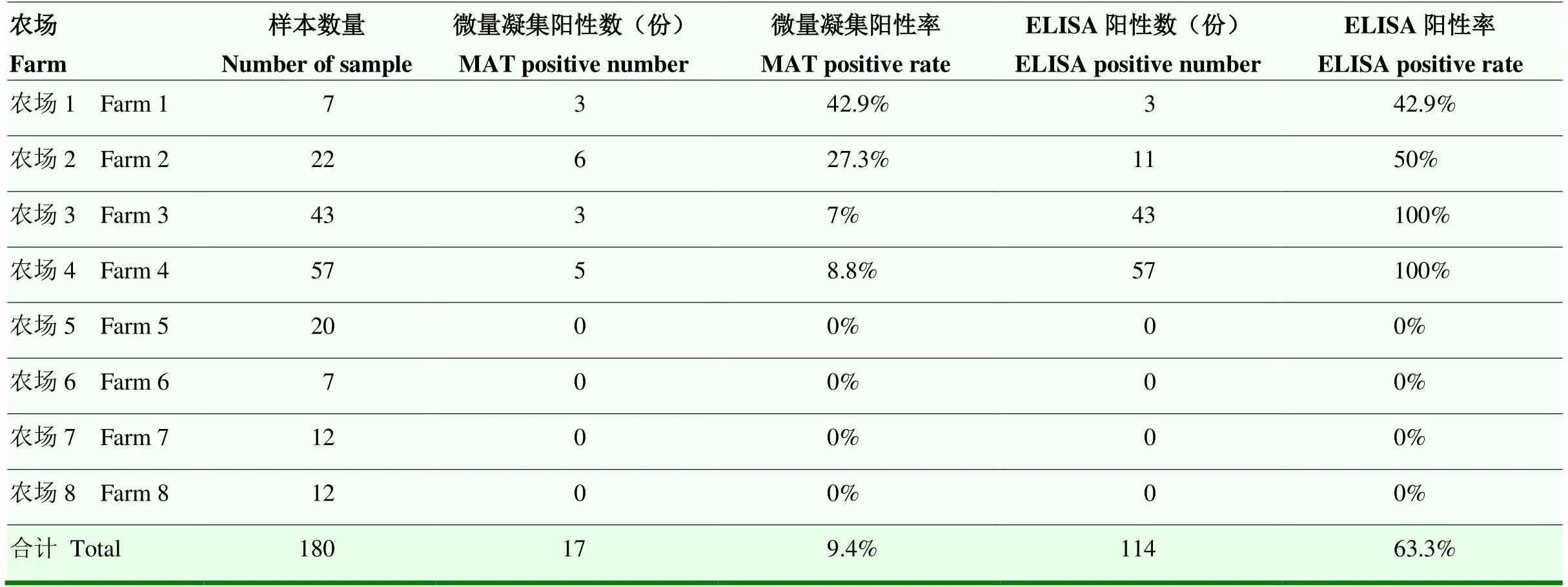
表2 临床样本的检测
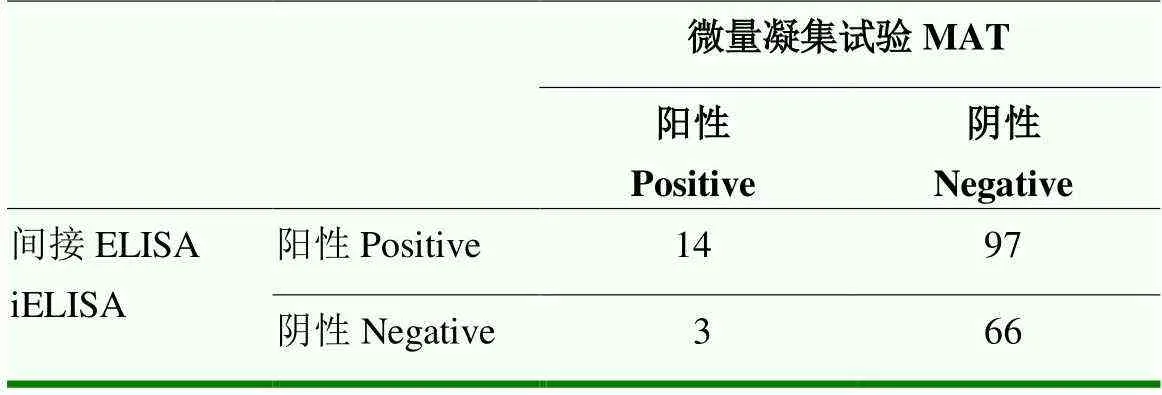
表3 两种方法检测结果的比较
3 讨论
3.1 关于马流产沙门氏菌病血清学诊断方法的现状与不足
马、驴流产疾病的发生对马、驴产业造成很大的经济损失,环境因素、饲养管理、细菌性因素等均可引起马属动物的流产,其中细菌性流产占主要部分[26-27];引起马、驴流产或副伤寒的细菌主要有宿主适应性的马流产沙门氏菌,可能还有非宿主适应性鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌等。但随着养殖规模扩大及流动性增加,沙门氏菌混合感染情况可能会越来越常见,因此建立一种马流产沙门氏菌病通用性的血清学诊断方法尤为重要。传统的血清学凝集方法如试管凝集,每次只能稀释一支试管,操作繁琐不适合大量样本的检测,同时存在因主观因素而导致的判读不准确,不能作为疾病的精确诊断,微量凝集[19]克服了试管凝集不足,可以同时对多个样品进行稀释实现大规模样品检测,但敏感性仍存在不足。而ELISA检测方法与试管凝集、微量凝集方法相比灵敏度更高,特异性更强[28-29],国内研究人员利用马流产沙门氏菌全菌包被的ELISA对样品进行了检测,其敏感性相比凝集有所提高[30],但使用全菌包被的缺点是抗原复杂,相比单一抗原成分特异性可能会存在不足。
3.2 本研究中候选抗原的选择
为了提高ELISA特异性、敏感性,本研究采用马流产沙门氏菌阳性血清与马流产沙门氏菌抗原复合物孵育进行免疫沉淀优势抗原,最终获得了马流产沙门氏菌的优势抗原ompA,马流产沙门氏菌阳性血清能够将ompA抗原沉淀下来,说明ompA在体液免疫中发挥着非常重要的作用。沙门氏菌种类繁多,ompA蛋白在沙门氏菌属内高度保守,可以作为沙门氏菌属诊断的候选蛋白,其中马流产沙门氏菌ompA蛋白在氨基酸上与鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌同源性99.4%—100%,并且能被以上4种沙门氏菌的阳性血清同时识别,因此ompA适合作为建立马流产沙门氏菌病通用型诊断候选蛋白。
3.3 与前人研究方法的对比
利用ompA3蛋白,本研究通过优化反应条件建立了马流产沙门氏菌病ELISA抗体诊断方法。该方法具有良好的特异性,仅与马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌的阳性血清反应,与马传染性贫血病毒、马流感病毒、马疱疹病毒等阳性血清均无交叉反应。通过感染马血清及临床样品进一步评估了iELISA方法的检测性能。对静脉感染马流产沙门氏菌马血清进行监测,iELISA可以持续监测抗体阳性到116 d,相比凝集试验多监测抗体阳性47 d,因此iELISA具有更好的敏感性。对于凝集第4天可以检测到抗体阳性而iELISA第7天才能检测到抗体阳性现象,我们推测可能与感染方式有关,后期我们通过肌肉注射方式进行感染健康马时,发现凝集试验第8天可以检测到抗体阳性而iELISA第5天检测到抗体阳性,iELISA检测结果相比凝集提早3 d(数据未展示),结果也验证了我们的猜想。通过对8个不同牧场的180份样品进行检测,ompA iELISA的总体阳性检出率为63.3%,比微量凝集阳性检出率高53.9%,证明了ompA iELISA具有更好的敏感性,因此也更适合用于马流产沙门氏菌病的血清学诊断。此外,我们对发生流产疫情区微量凝集检测结果阳性而ompA iELISA检测结果为阴性的3份样品进行了Western blot验证,结果3份血清均不与ompA蛋白反应,仅1份可以与沙门氏菌属共有的菌铁蛋白反应[25]。既不与ompA反应也不与菌铁蛋白反应的2份血清是否与沙门氏菌感染有关仍需要进一步阐明。
3.4 本方法的适用场景和有待研究的问题
沙门氏菌的血清型众多,是多种人畜共患病原体。其中目前已知可感染马属动物的只有本研究中涉及的4种致病沙门氏菌,尚未有其他沙门氏菌感染马属动物的报道,但理论上不能排除本方法可以检测其他具有共同ompA抗原的沙门氏菌在感染马属动物后引起的抗体反应。因本研究建立的间接ELISA方法是利用HRP标记的抗马二抗进行目标抗体的检测,因此并不适用于其他动物如猪、鸡沙门氏菌感染的检测。然而,本方法选择的包被蛋白是ompA蛋白,该蛋白不仅在马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠炎沙门氏菌内高度保守,在沙门氏菌属内也是保守的,如将检测二抗换成针对不同物种抗体的标记二抗并加以优化,同时进行临床试验的评估,也存在进一步在其他物种检测的可能。总之,本研究方法针对目前引起马流产的4种沙门氏菌感染的抗体检测具有较好的效果,对其他沙门氏菌抗体的检测和应用有待进一步研究。
4 结论
本研究通过Pull-down成功获得了马流产沙门氏菌优势抗原ompA,通过Western blot验证ompA蛋白可以与马流产沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌和肠炎沙门氏菌阳性血清反应,证实ompA蛋白具有广谱性,适合作为马流产沙门氏菌病的通用型诊断抗原。利用获得的可溶性ompA3蛋白,成功建立了ELISA抗体检测方法,并证实了该方法具有良好的特异性以及沙门氏菌属的广谱适用性,可以作为马流产沙门氏菌病的通用型诊断方法。通过对试验感染马样品及临床样品评估,证实了该ELISA方法相比微量凝集试验具有更好的敏感性,可以作为马流产沙门氏菌病诊断的有效工具。
[1] HOTES S, TRAULSEN I, KRIETER J.control measures with special focus on vaccination and logistic slaughter procedures. Transboundary and Emerging Diseases, 2011, 58(5): 434-444.
[2] SCHAT K A, NAGARAJA K V, SAIF Y M. Pullorum disease: Evolution of the eradication strategy. Avian Diseases, 2021, 65(2): 227-236.
[3] KACZOREK-ŁUKOWSKA E, SOWIŃSKA P, FRANASZEK A, DZIEWULSKA D, MAŁACZEWSKA J, STENZEL T. Can domestic pigeon be a potential carrier of zoonotic Salmonella? Transboundary and Emerging Diseases, 2021, 68(4): 2321-2333.
[4] WANG H, LIU K J, SUN Y H, CUI L Y, MENG X, JIANG G M, ZHAO F W, LI J J. Abortion in donkeys associated withabortus equi infection. Equine Veterinary Journal, 2019, 51(6): 756-759.
[5] 李阳, 杨康, 张宝江, 苏艳. 马流产沙门氏菌新疆分离株FliC基因的克隆及分子特征分析. 中国畜牧兽医, 2014, 41(11): 20-24.
LI Y, YANG K, ZHANG B J, SU Y. Cloning and molecular character analysis of FliC gene ofabortus equi isolated from Xinjiang. China Animal Husbandry & Veterinary Medicine, 2014, 41(11): 20-24. (in Chinese)
[6] UZZAU S, BROWN D J, WALLIS T, RUBINO S, LEORI G, BERNARD S, CASADESÚS J, PLATT D J, OLSEN J E. Host adapted serotypes of. Epidemiology and Infection, 2000, 125(2): 229-255.
[7] 崔思列, 李春盛. 驴驹鼠伤寒沙门氏菌病调查研究报告. 兽医科技杂志, 1983, 13(2): 10-16.
CUI S L, LI C S. Investigation on typhimurium salmonellosis of donkey foal. Journal of Veterinary Science and Technology, 1983, 13(2): 10-16. (in Chinese)
[8] ALAM J, SINGH B R, HANSDA D, SINGH V P, VERMA J C. Evaluation of aroA deletion mutant ofsub species enterica serovar Abortusequi for its vaccine candidate potential. Indian Journal of Experimental Biology, 2009, 47(11): 871-879.
[9] STRITOF Z, HABUS J, GRIZELJ J, KOSKOVIC Z, BARBIC L J, STEVANOVIC V, TOMIC D H, MILAS Z, PERHARIC M, STARESINA V, TURK N. Two outbreaks ofabortusequi abortion in mares in croatia. Journal of Equine Veterinary Science, 2016, 39: S63.
[10] NIWA H, HOBO S, KINOSHITA Y, MURANAKA M, OCHI A, UENO T, OKU K, HARIU K, KATAYAMA Y. Aneurysm of the cranial mesenteric artery as a site of carriage ofsubsp.serovar Abortusequi in the horse. Journal of Veterinary Diagnostic Investigation, 2016, 28(4): 440-444.
[11] DI GENNARO E E, GUIDA N, FRANCO P G, MORAS E V, MUÑOZ A J. Infectious abortion caused bysubsp enterica serovar Abortusequi in Argentina. Journal of Equine Veterinary Science, 2012, 32(10): S74.
[12] 孙殿和. 对爆发性马副伤寒流产的防治报告. 青海畜牧兽医杂志, 1984, 14(3): 32-35.
SUN D H. Prevention and treatment of paratyphoid fever induced abortion in horse. Chinese Qinghai Journal of Animal and Veterinary Sciences, 1984, 14(3): 32-35. (in Chinese)
[13] 童昆周, 白文彬, 田枫岚, 代克珍, 张自刚, 陈毓璋, 周长钧, 刘风岗. 马流产沙门氏杆菌C系弱毒菌苗的研究. 中国农业科学, 1980, 13(1): 80-89.
TONG K Z, BAI W B, TIAN F L, DAI K Z, ZHANG Z G, CHEN Y Z, ZHOU C J, LIU F G. Studies on a live attenuated vaccine against paratyphoid equine abortion. Scientia Agricultura Sinica, 1980, 13(1): 80-89. (in Chinese)
[14] 王积禄, 孙来魁, 巩元庆, 陈关林. 互助县马沙门氏杆菌病调查. 青海畜牧兽医杂志, 1987, 17(5): 43.
WANG J L, SUN L K, GONG Y Q, CHEN G L. Investigation of salmonella in Huzhu county. Chinese Qinghai Journal of Animal and Veterinary Sciences, 1987, 17(5): 43. (in Chinese)
[15] 郑慎修. 马流产沙门氏菌病诊断报告. 中国兽医科技, 1986, 16(11): 31-32.
ZHENG S X. Diagnostic report of equine abortus salmonellosis. Chinese Journal of Veterinary Science and Technology, 1986, 16(11): 31-32. (in Chinese)
[16] 孙莹慧, 刘康军, 陶璐瑶, 孟霞, 崔璐莹, 姜桂苗, 赵付伟, 李建基, 王亨. 驴源马流产沙门菌的耐药表型及毒力基因检测. 中国兽医学报, 2019, 39(10): 1959-1962.
SUN Y H, LIU K J, TAO L Y, MENG X, CUI L Y, JIANG G M, ZHAO F W, LI J J, WANG H. Detection of antimicrobial resistance and virulence genes ofabortusequi isolated from donkeys. Chinese Journal of Veterinary Science, 2019, 39(10): 1959-1962. (in Chinese)
[17] 冯培祥, 杨莉, 赵付伟, 姜桂苗, 高维平, 嵇传良. 驴沙门菌的分离鉴定及药敏试验. 中国兽医杂志, 2018, 54(8): 81-84.
FENG P X, YANG L, ZHAO F W, JIANG G M, GAO W P, JI C L. Isolation, identification and drug sensitivity test of donkey. Chinese Journal of Veterinary Medicine, 2018, 54(8): 81-84. (in Chinese)
[18] 孙阳阳, 杨美, 解晓莉, 程凯慧, 张亮, 楚会萌, 任亚初, 杨宏军. 驴源沙门氏菌的分离鉴定、耐药及毒力分析. 山东农业科学, 2019, 51(11): 143-148.
SUN Y Y, YANG M, XIE X L, CHENG K H, ZHANG L, CHU H M, REN Y C, YANG H J. Isolation, identification, drug resistance and virulence analysis offrom donkey. Shandong Agricultural Sciences, 2019, 51(11): 143-148. (in Chinese)
[19] 郭奎, 王宁, 王金慧, 初晓雨, 赵语婷, 郭巍, 刘荻萩, 胡哲, 王晓钧. 马流产沙门氏菌的分离鉴定及其微量凝集抗体检测方法的建立与应用. 中国农业科学, 2020, 53(10): 2112-2121.
GUO K, WANG N, WANG J H, CHU X Y, ZHAO Y T, GUO W, LIU D Q, HU Z, WANG X J. Establishment and preliminary application of microagglutination detection method forabortus equi. Scientia Agricultura Sinica, 2020, 53(10): 2112-2121. (in Chinese)
[20] WANG J, GUO K, LI S, LIU D, CHU X, WANG Y, GUO W, Du C, WANG X, HU Z. Development and application of real-time PCR assay for detection ofabortusequi. Journal of Clinical Microbiology, 2023, 61(3): e0137522.
[21] GALL D, NIELSEN K, BERMUDEZ R M, DEL REAL M C M, HALBERT G, GROULX R, MORENO F, CHOW E Y, CHECKLEY S L. Development of an indirect enzyme-linked immunosorbent assay for detecting equine serum antibodies to the lipopolysaccharide ofabortusequi. Research in Veterinary Science, 2006, 81(2): 215-217.
[22] LEE J S, JUNG I D, LEE C M, PARK J W, CHUN S H, JEONG S K, HA T K, SHIN Y K, KIM D J, PARK Y M. Outer membrane protein a ofserovar Typhimurium activates dendritic cells and enhances Th1 polarization. BMC Microbiology, 2010, 10: 263.
[23] PUOHINIEMI R, KARVONEN M, VUOPIO-VARKILA J, MUOTIALA A, HELANDER I M, SARVAS M. A strong antibody response to the periplasmic C-terminal domain of the OmpA protein ofis produced by immunization with purified OmpA or with whole.orbacteria. Infection and Immunity, 1990, 58(6): 1691-1696.
[24] SINGH S P, WILLIAMS Y U, MILLER S, NIKAIDO H. The C-terminal domain ofserovar typhimurium OmpA is an immunodominant antigen in mice but appears to be only partially exposed on the bacterial cell surface. Infection and Immunity, 2003, 71(7): 3937-3946.
[25] 徐志超. 鸡白痢沙门氏菌优势抗原细菌铁蛋白诱导产生IFN-β的分子机理[D]. 北京:中国农业大学,2016:125.
XU Z C. The molecular mechanism ofβ induction by the major antigen bacterioferritin of Salmonella Pullorum [D]. Beijing:China Agricultural University 2016:125. (in Chinese).
[26] 李玉学. 群牧母马发生流产的原因及防制措施. 畜牧兽医科技信息, 2014(4): 32-33, 34.
LI Y X. Reasons and preventive measures of abortion in herd mare. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2014(4): 32-33, 34. (in Chinese)
[27] 王世民, 王彩蝶, 张艳楠, 苏艳. 马流产沙门菌fimY基因同源性分析及蛋白表达. 动物医学进展, 2015, 36(6): 39-42.
WANG S M, WANG C D, ZHANG Y N, SU Y. Homology analysis and expression of gene fimY ofabortus equine. Progress in Veterinary Medicine, 2015, 36(6): 39-42. (in Chinese)
[28] 康孟佼, 朱春红, 蒋颖, 姚丰华, 吴娟, 段小丽, 朱国强. 肠炎沙门菌间接ELISA检测方法的建立. 中国家禽, 2010, 32(15): 22-25.
KANG M J, ZHU C H, JIANG Y, YAO F H, WU J, DUAN X L, ZHU G Q. Development of an indirect enzyme-linked immunosorbent assay for detection of. China Poultry, 2010, 32(15): 22-25. (in Chinese)
[29] 钱珊珊. 沙门菌SpiC蛋白单克隆抗体的研制与初步应用[D].扬州:扬州大学, 2015:51.
QIAN S S. Development and primary application of monoclonal antibodies against Salmonella SpiC protien[D]. Yangzhou: Yangzhou University, 2015:51. (in Chinese)
[30] 杨康, 苏艳, 李阳, 张宝江. ELISA和微量凝集法检测马流产沙门菌血清抗体的比较. 畜牧与兽医, 2015, 47(6): 130-132.
YANG K, SU Y, LI Y, ZHANG B J. Comparison of ELISA and micro agglutination assay for determination of Salmonella antibody. Animal Husbandry & Veterinary Medicine, 2015, 47(6): 130-132. (in Chinese)
Development and Application of a Universal iELISA Antibody Assay for Abortion-Causingin Equidae
GUO Kui, ZHANG ZeNan, LI ShuaiJie, CHU XiaoYu, WANG YaoXin, GUO Wei, HU Zhe, WANG XiaoJun
Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences/State Key Laboratory for Animal Disease Control and Prevention, Harbin 150069
【Objective】The aim for this study was to identify the predominant antigen ofand to develop a sensitive, specific and universal iELISA assay method for the rapid and accurate detection ofantibodies in equidae.【Method】For the purpose of screening out dominant antigens forAbortusequi, the immunoprecipitation (pull down) tests were performed usingAbortusequipositive/negative sera with whole bacterium antigens ofabortusequi. Then, amino acid sequence alignment of the dominant antigen were compared withtyphimuriumDublin,andEnteritidis to verify itsconservative. Three pairs of specific primers were designed and synthesized according to the nucleotide sequence of the full ompA gene published in GenBank. Three ompA genes with different lengths were amplified by PCR, and then cloned into pET28a vector and transformedRosetta (DE3) competent cell. The expressed products were analyzed by SDS-PAGE electrophoresis and Western-blot test after induced by IPTG. The reactivity of the purified protein was verified usingAbortusequi,Typhimurium,Dublin (Dublin), andEnteritidis serums, and one negative serum by Western blot. An indirect ELISA method for the diagnosis of equine abortion salmonellosis was developed by optimizing the amount of coating antigen, serum and secondary antibody concentrations using the purified ompA3 protein as the coating antigen, and evaluating the specificity and sensitivity of the iELISA, and finally applying the iELISA to detection of clinical samples.【Result】In this study, the ompA dominant antigen ofAbortusequi was screened.AbortusequiompA was conservative and showed 99.4%-100% identical withTyphimurium,Dublin andEnteritidis strains at the amino acid level. Three target genes were successfully obtained by PCR amplification. Three recombinant plasmids, including pET28a-, pET28a-, and pET28a-were successfully constructed. The expressed products were analyzed by SDS-PAGE electrophoresis and Western-blot test after induced by addition of IPTG to a final concentration of 0.6 mmol·L-1for 5 h at 24 ℃. The recombinant ompA1 and ompA2 were obtained in an inclusion and soluble recombinant ompA3 proteins. The soluble recombinant ompA3 were identified by Western blot, which had a specific reaction with fourpositive serums, therefore, the ompA3 was considered as a potential target candidate for serological detection ofAn iELISA method was developed in a maximum P/N ratio using the coating antigen at a concentration of 1 μg·mL-1, a serum dilution of 1﹕200 and secondary antibody was 1﹕10000. The cutoff value was 0.143, and an OD450value over 0.143 was considered as positive. The specificity test showed that the coated antigen did not cross-react with the positive serum of common equine infectious diseases. The iELISA provided better sensitivity by detecting antibodies in intravenously infected horses, as the iELISA could continue to monitor antibody positivity up to 116 days, 47 days longer than microagglutination test (69 days). The established iELISA method was used to detect antibodies in 180 serum samples from 8 different farms. The average positive rate of iELISA antibody was 63.3%, which was 53.9% higher than that of micro agglutination test.【Conclusion】The soluble ompA3 protein was successfully expressed, and a universal indirect ELISA antibody method was established for the diagnosis of equine abortus salmonellosis. The method enables detection of antibodies toAbortusequi in clinical samples.The method has good specificity and sensitivity and could be a promising candidate tools for use in the monitoring of the equine abortus salmonellosis epidemic.
Equine abortus salmonellosis; ompA; universal; iELISA; diagnostic

10.3864/j.issn.0578-1752.2023.12.015
2022-03-25;
2022-05-30
十四五国家重点研发计划重点专项(2021YFD1800500)、“中国-哈萨克斯坦跨境动物疫病防控联合研究及一带一路科技合作平台建设”项目(2020YFE0203400)
郭奎,E-mail:guokuiking@163.com。通信作者王晓钧,E-mail:wangxiaojun@caas.cn。通信作者胡哲,E-mail:huzher@126.com
(责任编辑 林鉴非)

