氯胺酮通过抑制谷氨酸受体和蛋白激酶损害孕鼠子代的学习记忆能力
赵菁华,姜 胜,张儒新,李沫萱,杨 玙,秦 潜,高 利,曾 欢*,王 巍*,宋厚辉*
(1.浙江农林大学 动物科技学院/动物医学院 浙江省畜禽绿色生态健康养殖应用技术研究重点实验室/动物健康互联网检测技术浙江省工程研究中心,浙江 杭州 311300;2.东北农业大学 动物医学学院,黑龙江 哈尔滨 150030)
学习和记忆是大脑的高级功能,麻醉药物的使用是否会影响学习和记忆能力已引起越来越多的关注[1-2]。有关报道表明有些全身麻醉患者可能出现认知功能障碍[3]。几乎2%的孕妇因各种原因需要手术治疗,产前因素是影响后代智力发育的主要因素[4-5]。近年来,在啮齿类动物和灵长类动物进行的大量试验表明,临床中常用的麻醉剂(如氯胺酮)会导致大脑发育障碍、神经毒性和长期认知功能障碍[6-7]。常用的麻醉剂大多是脂溶性的,容易通过血脑屏障,进入胎儿血液循环和脑组织。因此,麻醉药是否会损害胎儿的大脑发育尤其值得关注[8-9]。研究表明,海马体是氯胺酮损伤的主要部位,而且海马的CA1和CA3区域被认为与空间学习和记忆能力密切相关[10]。麻醉剂量的氯胺酮会导致认知能力的改变,然而潜在的机制仍不清楚。
谷氨酸受体在大脑皮层和海马中高度表达,并在神经发育、学习记忆、感觉和突触可塑性中发挥核心作用。因此,神经元中谷氨酸受体的调节对于突触传递非常重要[11]。蛋白激酶(CaMKⅡ、PKA、PKC)对突触可塑性也发挥重要调节作用,大量研究报道神经元细胞中蛋白激酶的激活参与离子通道、受体脱敏、神经递质释放和突触传递的调节,这个过程是长时程增强(LTP)形成的分子机制之一[12-13]。本研究通过建立孕鼠氯胺酮暴露模型,探究氯胺酮对子代幼鼠行为学、轴突数目、尼氏小体和树突棘密度的影响,检测海马中谷氨酸受体和相关蛋白激酶的表达,研究结果将为兽医临床麻醉药物的使用提供理论参考。
1 材料与方法
1.1 实验动物将体质量(230±20) g的雄性和雌性Wistar大鼠置于温度和湿度适宜的环境中,自由采食饮水,并进行12 h的光照/黑暗循环。所有动物的试验程序均按照浙江农林大学实验动物伦理委员会规范进行。
1.2 主要试剂氯胺酮(购自沈阳市兽药厂);RIPA裂解液、PMSF、蛋白上样缓冲液、BCA蛋白定量试剂盒、尼氏染液等购自碧云天生物技术有限公司;蛋白Marker购自上海天能科技有限公司;GAPDH、CaMKⅡ、PKA、PKC、GluR1、GluR2、GluN1、GluN2A和GluN2B单克隆抗体购自美国CST;IgG-HRP抗体购自上海优宁维生物科技股份有限公司;脱脂奶粉购自完达山乳品有限公司;高尔基染液购自合肥万物生物;反转录试剂盒购自北京全式金生物技术有限公司;试验中使用的引物都由生工生物工程(上海)股份有限公司合成。
1.3 主要仪器水迷宫试验系统购自上海然哲仪器厂;超净工作台购自上海灯晟仪器厂;-80℃冰箱购自青岛海尔集团;EPS 300电泳仪购自上海天能科技有限公司;SX-500高压灭菌锅购自上海天美科技有限公司;液氮罐购自美国Thermo Scientific公司;倒置显微镜购自日本Nikon;梯度PCR仪购自日本TaKaRa Bio株式会社。
1.4 麻醉及样品采集将30只Wistar大鼠分成10个笼子(每个笼子1只雄鼠和2只雌鼠),底部放置1个铁网。第2天如果检测到雌鼠阴道内有阴道栓子,则认为该鼠已怀孕,标记为妊娠第0天,并将孕鼠隔离饲养。妊娠第14天,将20只孕鼠随机分为对照组(C组,n=10)和氯胺酮组(K组,n=10)。氯胺酮组孕鼠首先肌肉注射氯胺酮(80 mg/kg),每隔1 h按照40 mg/kg补药3次,对照组孕鼠同样时间注射相同体积的生理盐水。在子代出生后第25~29天,连续5 d分别取对照组和氯胺酮组子代幼鼠进行Morris水迷宫试验。行为学试验结束后,将子代幼鼠断颈处死,分离出海马体,1/2放入液氮冻存,其余组织固定在10%福尔马林溶液中。
1.5 Morris水迷宫试验在直径为120 cm、高50 cm 的圆形水箱中装满35 cm深的水,并保持(24±1)℃的温度。迷宫被分成4个大小相等的象限:SW、SE、NE和NW。在其中1个象限中,逃生平台被淹没在水面以下1.5 cm处。在出生后第25~29天,子代幼鼠连续5 d接受测试,每日4次(测试间隔60~70 min)。将每只大鼠依次放入4个象限中,最多允许60 s定位平台。如果大鼠在60 s 内没有到达平台,则将它们引导到平台,然后让它们在那里停留10 s。所有测试都进行录像,并通过视频跟踪系统记录60 s内大鼠游泳路径轨迹以及进入平台象限区域的次数。
1.6 透射电镜观察将子代幼鼠海马切成小于1 mm3的组织块,用2.5%戊二醛磷酸缓冲液固定2 h;将0.2 mol/L磷酸缓冲液与双蒸水等量混合配成冲洗液,冲洗组织块2次,每次间隔15 min。先后采用酒精和丙酮进行脱水,包埋后将组织块修成塔形,用超薄切片机切成超薄切片,再置于铜网上。用枸橼酸铅染色液对切片进行染色,最后,将载有超薄切片的铜网置于透射电镜内进行观察和拍摄。将照片输入形态学图像分析系统中,对照片中的轴突进行识别计数。
1.7 尼氏小体染色将固定好的海马体先制作成组织切片,使用二甲苯Ⅰ和二甲苯Ⅱ进行脱蜡,然后使用100%,95%,90%,80%,70%,50%的酒精进行梯度浓度脱水,每次浸泡5 min,接着使用蒸馏水对组织切片进行3次冲洗,每次5 min。冲洗后使用1%甲苯胺蓝染色40 min,最后使用蒸馏水将切片上残余的染液清洗干净,再置于不同浓度的酒精中进行脱水,最后经过二甲苯透明后,使用中性树胶封片。
1.8 高尔基染色通过高尔基染色可以显示神经元和胶质细胞树突棘的形态变化。将子代幼鼠的海马体切成5 mm厚的小块,浸泡在1.5%的硝酸盐水溶液中镀银,避光储存3 d,每天都使用新的镀银液体,目的是使镀银更加充分。使用火棉胶包埋组织块,使用切片机切片,将切片置于2%的重铬酸钾水溶液中进行漂洗,漂洗时间为10~15 min,当天可以放1张盖玻片,在显微镜下直接观察。
1.9 RT-PCR本试验所用引物序列详见表1。对海马体中的总RNA进行提取:将海马体放入1 mL 的TRIzol裂解液中进行研磨,经过两相分离后,得到的上层透明液体即为提取的RNA。上清中加入等体积的异丙醇,混合后进行离心,经过清洗和干燥后,使用移液枪反复吹打将RNA完全溶解。使用反转录试剂盒将RNA反转录成cDNA。RT-PCR反应结束后,应用2-ΔΔCt计算RT-PCR数据。
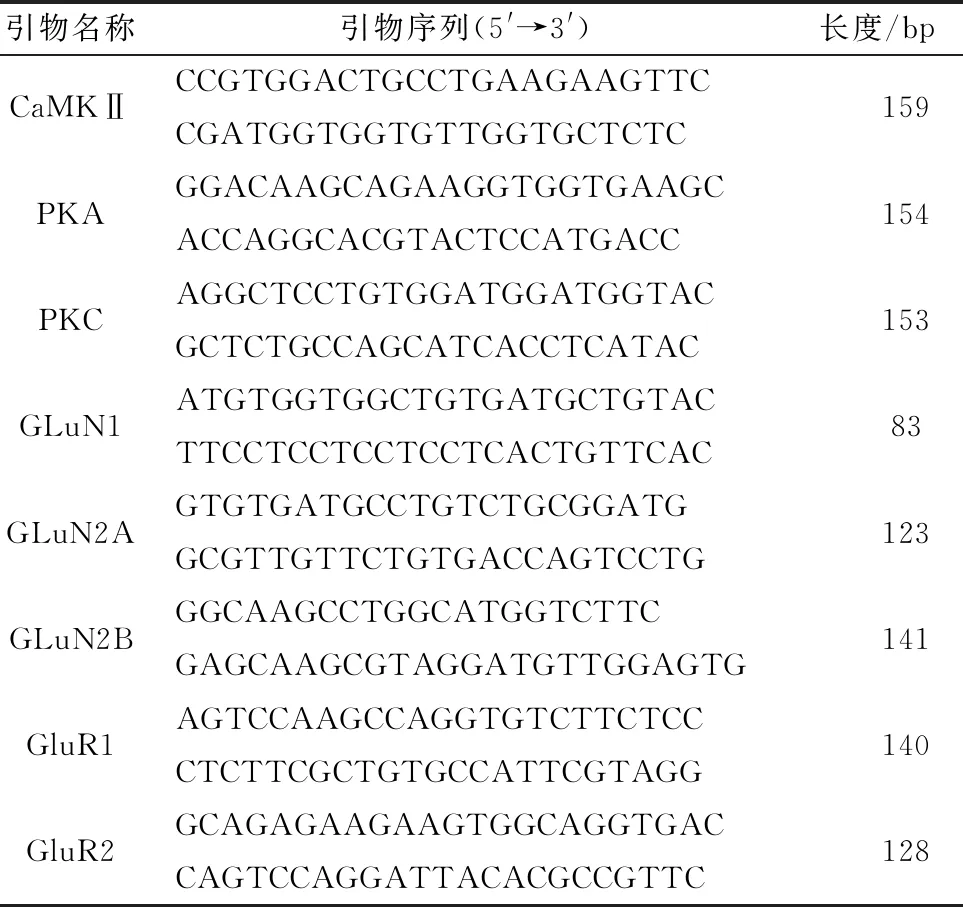
表1 引物相关信息
1.10 Western blot首先取0.1 g的海马组织加入裂解液,然后进行研磨,所有操作都要在液氮里进行。将取出的样品裂解完全后进行离心,取上清进行蛋白含量的测定,加入染液进行定量测定。配制分离胶和浓缩胶,上层胶的电泳条件为80 V、25 min,下层胶的电泳条件为120 V、70 min左右。使用200 mA电流进行转膜,封闭结束后孵育一抗,抗体分别为GAPDH、CaMKⅡ、PKA、PKC、GluR1、GluR2、GluN1、GluN2A和GluN2B。使用二抗进行孵育后进行洗涤曝光,最后使用Image J软件对蛋白条带进行分析。
1.11 数据处理使用GraphPad Prism 7.0软件进行数据统计和分析,对数据进行正态分析和方差齐性检验后,使用独立样本t检验分析对照组和氯胺酮组的数据。P<0.05为两组数据之间存在显著性差异。
2 结果
2.1 氯胺酮麻醉对子代幼鼠学习记忆的影响在Morris水迷宫试验中,每次试验60 s内小鼠寻找到平台所用的时间即为逃逸潜伏期测定值。结果显示,在测试第2~4天,对照组和氯胺酮组子代幼鼠的逃逸潜伏期存在显著性差异(P<0.01)。而且随着测试天数的增加,两组大鼠的逃避潜伏期测定值逐渐降低(图1A)。同时比较了60 s内两组大鼠跨越平台次数,结果发现氯胺酮组大鼠的次数比对照组降低,但两组之间没有显著性差异(图1B)。对照组大鼠寻找平台的运动轨迹比氯胺酮组更密集,活动范围几乎覆盖整个水池内(图1C,D)。检测结果说明氯胺酮麻醉会损伤子代幼鼠在空间方面的学习记忆能力。
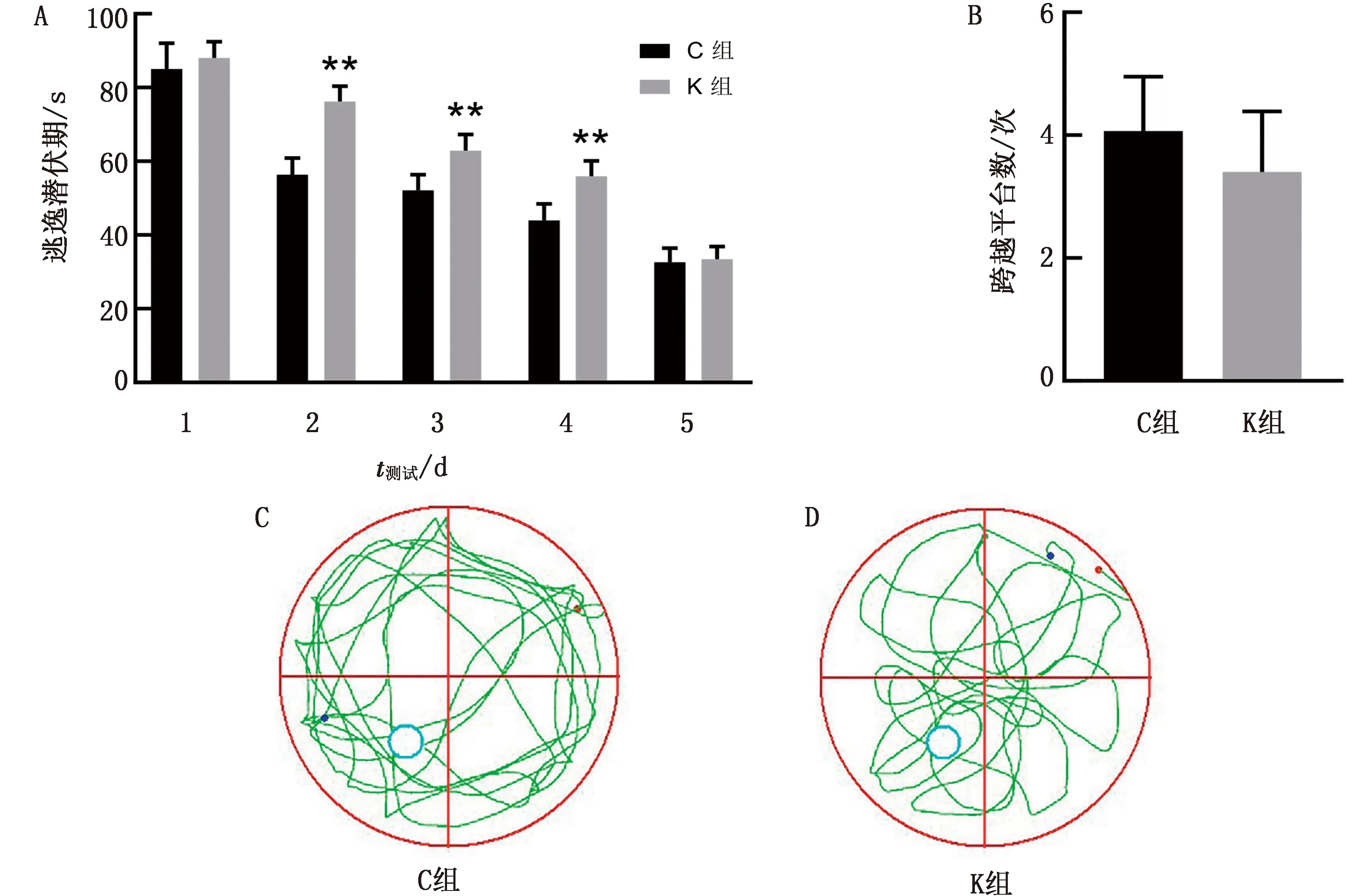
A.定位导航试验60 s内找到平台的时间;B.子代幼鼠穿过平台区域的次数;C~D.大鼠在空间探索试验中的运动轨迹。与对照组比较,*示P<0.05,**示P<0.01。下同
2.2 氯胺酮麻醉对子代幼鼠神经元轴突数量的影响使用透射电子显微镜观察了子代幼鼠海马CA1和CA3区轴突数目,图片中可以看到大量有髓鞘包绕的轴突终末(Ax),每个轴突终末内均含有大量的突触小泡和线粒体。从图片分析结果可以看出,在CA1和CA3区,对照组的轴突终末数目显著高于氯胺酮组,轴突分布紧密,并和临近的树突形成突触连接,氯胺酮组轴突终末分布的比较稀疏(图2A~D)。每张片子随机选择5个不同区域进行轴突数目计数,发现氯胺酮麻醉导致子代幼鼠CA1和CA3区轴突数目显著降低(P<0.01)(图2E)。
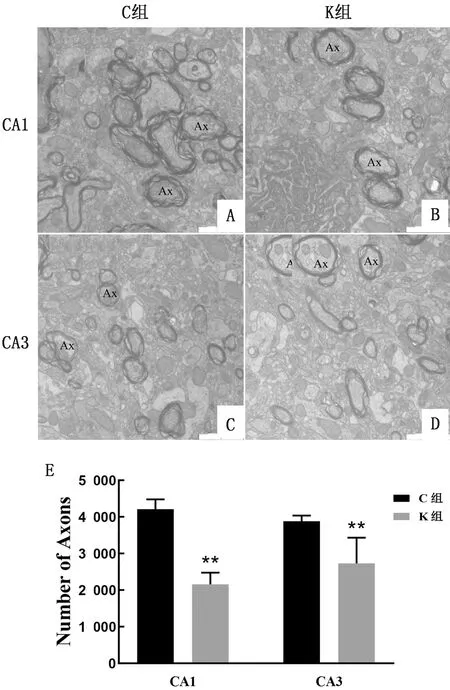
A.对照组海马体CA1区轴突(Ax)形态;B.氯胺酮组海马体CA1区轴突形态;C.对照组海马体CA3区轴突形态;D.氯胺酮组海马体CA3区轴突形态;E.两组大鼠单位面积内轴突数目统计学结果
2.3 氯胺酮麻醉对子代幼鼠神经元尼氏小体的影响尼氏小体是分布于神经细胞胞质内的三角形或椭圆形小块状物质,能被碱性染料染成蓝色。每张切片随机选择5个不同的视野进行观察,结果发现对照组子代幼鼠神经元尼氏小体数量更多,排列更密集,染色更深(图3C,E)。氯胺酮组的神经元尼氏小体染色明显变浅,尼氏小体出现溶解或萎缩,边缘混乱(图3D,F)。光密度分析结果表明,氯胺酮麻醉后海马体CA1和CA3区尼氏小体平均光密度相对于对照组显著降低(P<0.01),与切片染色结果相一致(图3G)。
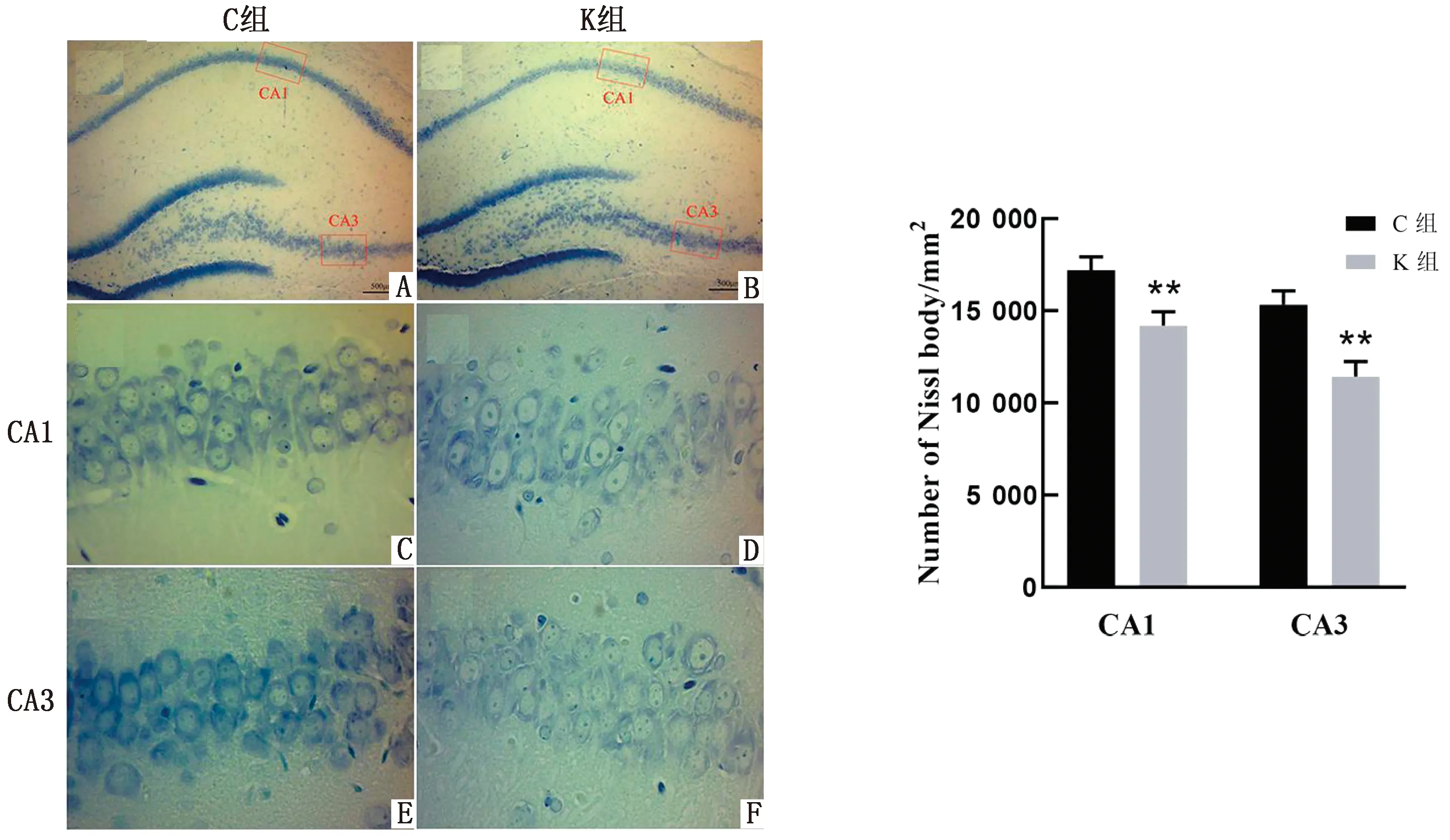
A.对照组海马体尼氏染色整体形态;B.氯胺酮组海马体尼氏染色整体形态;C,D.两组大鼠CA1区尼氏小体染色结果;E,F.两组大鼠CA3区尼氏小体染色结果;G.两组大鼠单位面积内尼氏小体数目统计学结果
2.4 氯胺酮麻醉对子代幼鼠神经元树突棘数量的影响高尔基染色可以将神经元上的树突棘染成黑色,使用光学显微镜在油镜下对海马CA1和CA3区的树突棘进行计数,随机选择10 μm长度的不同神经元的梢部和基部,计算每组树突上的棘数量,从而明确氯胺酮麻醉对神经元形态可塑性的影响。结果发现,氯胺酮组树突棘稀疏(图4C~D,H~I),无论是CA1或者CA3区,氯胺酮组单位长度上的树突棘数量相对于对照组都显著降低(P<0.05)(图4E,J)。
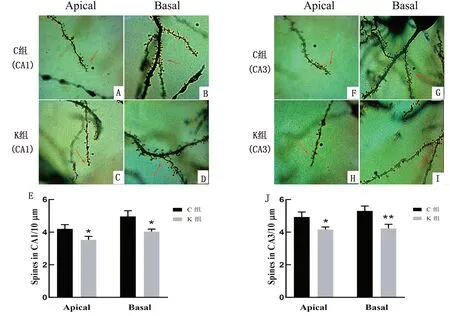
A~B.对照组CA1区梢部和基部树突棘形态;C~D.氯胺酮组CA1区梢部和基部树突棘形态;E.两组大鼠CA1区单位长度内树突棘数目统计学结果;F~G.对照组CA3区梢部和基部树突棘形态;H~I.氯胺酮组CA3区梢部和基部树突棘形态;J.两组大鼠CA3区单位长度内树突棘数目统计学结果
2.5 氯胺酮麻醉对子代幼鼠谷氨酸受体和蛋白激酶基因表达的影响使用RT-PCR方法检测海马区离子型谷氨酸受体和蛋白激酶基因的转录水平。研究发现,与对照组比较,氯胺酮麻醉组的CaMKⅡ、PKC、GLuN2A和GluR1的基因表达显著降低(P<0.05),GLuN1和GLuN2B的基因表达存在极显著性差异(P<0.01),PKA和GluR2的基因表达量虽然降低,但相对于对照组没有显著性差异(P>0.05)(图5)。
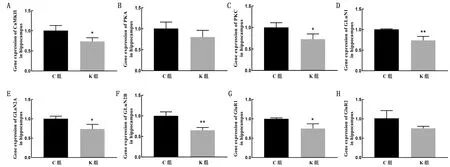
A~H.分别为CaMKⅡ、PKA、PKC、GLuN2A、GLuN2B、GLuR1和GLuR2基因的表达水平
2.6 氯胺酮麻醉对子代幼鼠谷氨酸受体和蛋白激酶蛋白表达的影响使用Western blot方法检测海马区离子型谷氨酸受体和蛋白激酶的蛋白表达。结果发现,麻醉组的CaMKⅡ(P<0.05)、PKA、PKC、GLuN2A、GLuN2B、GluR1和GluR2的蛋白表达相对于对照组显著降低(P<0.01),但两组之间的GLuN1蛋白表达没有显著性差异(P>0.05)(图6)。

A~H.分别为CaMKⅡ、PKA、PKC、GLuN2A、GLuN2B、GLuR1和GLuR2蛋白的表达水平
3 讨论
氯胺酮属于苯环已哌啶类静脉麻醉药,对呼吸系统的抑制作用较小,因此广泛应用于中外兽医临床[14]。几乎所有的麻醉药都会通过胎盘屏障,之前有研究发现很多麻醉药都会导致中枢神经系统的神经元发生凋亡,并导致晚年的行为障碍[15]。本研究发现在母鼠怀孕第14天持续注射氯胺酮会导致子代幼鼠学习和记忆功能发生损伤。Morris水迷宫试验通常用来评估子代幼鼠的空间学习记忆能力,本研究发现氯胺酮组幼鼠需要花费更多的时间才能找到定位平台,说明子代幼鼠的空间学习记忆功能水平降低。
尼氏小体主要参与神经元蛋白质的合成,在细胞发生损伤时,尼氏小体的形态会发生敏感性变化,因此常用尼氏染色来判断神经元的状态[16]。尼氏小体染色常用的染料包括甲酚紫和甲苯胺蓝等,可以将尼氏小体染成蓝色,蓝色颗粒的密度和数量与神经元状态呈正相关。研究发现奎宁等化学药物会导致神经元细胞出现空泡变性,尼氏小体大量溶解或消失,进而导致与突触相关的蛋白质的合成减少[17]。本研究发现,氯胺酮麻醉会导致子代幼鼠神经细胞尼氏小体的数量降低,说明孕鼠持续使用氯胺酮会导致后代的神经元发生损伤,并进一步导致神经生长相关蛋白的合成减少。突触在神经传递中发挥重要作用,轴突和树突的正常状态可以保证整个神经系统信号传递有规律的进行。本研究中透射电镜和高尔基染色结果表明,氯胺酮也会使海马体轴突和树突棘的数量减少,突触信息传递功能受损,进而导致子代幼鼠学习和记忆功能水平降低。
中枢神经系统的突触可塑性是机体完成高级功能(如学习和记忆)的基础,突触可塑性相关蛋白的合成对于维持神经系统的正常功能非常重要。中枢神经系统中的突触传递主要由谷氨酸介导的兴奋性突触完成,并导致兴奋性突触后电位的出现。NMDA和AMPA型谷氨酸受体是突触后膜的重要组成部分,因为它们对于突触传递至关重要。研究报告称,阻断NMDA受体会降低突触可塑性并损害儿童突触前发育的学习和记忆[18]。分布在海马体中的NMDA受体介导学习和记忆功能,是产生和维持LTP的关键部分。在本研究中,我们发现NMDA受体亚基(GLuN1、GLuN2A、GLuN2B)的表达下降,说明氯胺酮抑制了NMDA受体的激活,损伤了突触,最终导致子代幼鼠学习和记忆能力下降。除此之外,神经系统许多重要功能也需要AMPA受体参与,包括突触可塑性的维持和记忆的形成[19]。有人提出突触后蛋白的棕榈酰化可上调AMPA受体膜的表达并增强突触功能,从而间接表明AMPA受体对突触功能的重要性[20]。YANG等[21]报道苯并芘通过阻碍谷氨酸神经递质的传递来降低AMPA受体亚基的表达,从而增加SNAP-25的含量并扩大突触间隙,最终影响突触的传递。这与本研究结果相似,本研究中氯胺酮麻醉导致AMPA受体亚基(GluR1和GluR2)含量呈不同程度下降,轴突和树突棘密度也呈不同程度下降,最终削弱了海马神经元的突触可塑性。
蛋白激酶在LTP和突触可塑性中发挥重要作用,它们可以调节突触的相关功能蛋白,促进新树突棘的形成,并在激活时影响核转录因子和蛋白质翻译起始因子的磷酸化状态。因此蛋白激酶在LTP的诱导和维持中起着积极的调节作用[22]。CaMKⅡ是一种丝氨酸/苏氨酸激酶,在突触后膜高表达,一项研究表明,CaMKⅡ/NMDAR是维持LTP的重要记忆分子[23]。CaMKⅡ还通过C末端特异性丝氨酸的磷酸化增强谷氨酸AMPA受体的磷酸化,CaMKⅡ还可增强AMPA受体功能,影响突触可塑性[24]。PKA常见于动物体内,是中枢神经系统的重要信号因子之一。PKA不仅可以调节AMPA受体的转运,还可以促进轴突的再生,调节突触前神经递质的释放,从而调节突触活动[25]。在本研究中,PKA和AMPA受体亚基的变化呈相同趋势,氯胺酮麻醉导致两者的含量均降低,结合高尔基染色结果表明,PKA通路对维持突触活性至关重要。大量研究表明PKC与突触可塑性和LTP的形成密切相关,抑制PKC会减少LTP的形成,从而影响学习和记忆[26]。在目前的研究中,孕鼠注射氯胺酮会导致子代幼鼠记忆相关的蛋白激酶表达显著降低,这可能是导致突触可塑性和神经功能异常的关键原因。
综上,对怀孕中期的母鼠进行长时间的氯胺酮麻醉会对子代幼鼠的空间学习和记忆能力造成损伤,并导致轴突和树突棘的生成减少,使谷氨酸受体亚基和相关蛋白激酶的蛋白合成下降。本研究为兽医临床中麻醉药物的使用提供了理论补充,并为进一步降低麻醉药物的副作用提供了方向。

