羊传染性脓疱病毒ORF120蛋白以剂量依赖性方式抑制宿主细胞非POU结构域八聚体结合蛋白(NONO)的表达
于昭辉,周艳龙,吕丽君,刘兴源,徐梦实,方梓煜,李卓梅,关继羽,高 丰,赵 魁
(吉林大学 动物医学学院 人兽共患病研究教育部重点实验室,吉林 长春 130062)
羊传染性脓疱病又称“羊口疮”,是由痘病毒科、副痘病毒属的羊传染性脓疱病毒(Orf virus,ORFV)引起的一种高度接触性的人兽共患传染病[1],广泛分布在世界各养羊地区。尽管ORFV感染能够诱导机体产生强烈的免疫应答反应,但其仍可重复感染宿主[2]。研究表明,ORFV重复感染的一个重要原因是病毒可利用自身编码的免疫调节蛋白逃逸宿主的免疫反应,这些免疫调节因子包括ORFV117基因编码的哺乳动物白介素-10同系物(vIL-10)[3]、ORFV020基因编码产生的干扰素抗性蛋白(OVIFNR)[4]、ORFV112基因编码的趋化因子结合蛋白(CBP)[5]、粒细胞巨噬细胞集落刺激因子(GM-CSF)和白细胞介素-2(IL-2)抑制因子(GIF)以及病毒血管内皮生长因子-E(VEGF-E)等[6]。此外,ORFV被证实能通过编码多个NF-κB转录调节因子抑制剂(ORFV002、ORFV024、ORFV073、ORFV119、ORFV120和ORFV121),促进病毒在细胞中存活[7]。
非POU结构域八聚体结合蛋白(non-POU-domain-containing octamer binding protein,NONO),也称为p54(nrb),属于果蝇行为/人类剪接(DBHS)蛋白家族[8],是一种多功能核蛋白,广泛存在于大多数哺乳动物细胞核中,尤其是在副核的亚核结构域。大量研究表明,NONO参与mRNA剪接、DNA解链、DNA损伤修复、基因转录调控等细胞生命活动[9-10],此外,其与多种恶性肿瘤的发生发展、细胞免疫反应等密切相关,包括肝癌、肺癌、乳腺癌、膀胱癌、前列腺癌、肾细胞癌、黑色素瘤等[11-13]。近期研究发现,宿主蛋白NONO在人类免疫缺陷病毒(HIV-1)[14]、伪狂犬病病毒(PRV)[15]和EB病毒(EBV)[8]等多种病毒感染过程中也发挥重要的调节作用。
本研究从病毒-宿主互作角度,利用酵母双杂交、Co-IP、激光共聚焦技术等证实NONO蛋白与病毒ORF120蛋白在细胞核中共定位并存在相互作用,并进一步利用Western blot方法证实NONO蛋白与病毒ORF120蛋白表达存在剂量依赖性的相互抑制,为后期深入探讨宿主NONO蛋白在ORFV感染过程中的功能研究提供依据,并将为全面解析ORFV致病分子机制以及抗病毒药物靶标的筛选奠定基础。
1 材料与方法
1.1 材料DMEM购自大连美仑生物;TRIzol试剂购自Invitrogen公司;BCA蛋白测定试剂盒购自碧云天试剂公司;pcDNA3.1-mCherry、pcDNA3.1-His载体购自Invitrogen公司;pCMV-N-FLAG载体购自Clontech公司;蛋白A/G琼脂糖珠收集抗体结合蛋白购自Thermo Fisher公司;Alexa Fluor 594、Alexa Fluor 488抗体购自Abcam公司;NONO抗体、His标签抗体、GAPDH抗体购自Proteintech公司。
1.2 方法
1.2.1细胞和病毒 原代胎羊鼻甲骨(OFTu)细胞由本实验室分离培养并保存;HeLa细胞由本实验室保存;野生型病毒OV-SY17由本实验室分离鉴定并保存;OV-SY17Δ120基因缺失毒株和拯救毒株OV-SY17-RV120由本实验室构建并保存。
1.2.2基因扩增和质粒构建 用TRIzol提取OV-SY17感染OFTu细胞的总RNA,然后逆转录成cDNA。通过PCR扩增病毒ORF120基因和宿主蛋白NONO基因,然后分别连接到载体pGBKT7和载体pGADT7上,构建pGBKT7-ORF120和pGADT7-NONO质粒。将PCR扩增获得的ORF120基因片段连接至pcDNA3.1-His载体,构建His-ORF120表达质粒。将NONO基因片段分别连接至pcDNA3.1-mCherry和pCMV-N-FLAG载体上,构建mCherry-NONO质粒和N-FLAG-NONO质粒。用于质粒构建的引物如表1所示。

表1 引物序列
1.2.3酵母双杂交筛选 为了明确ORF120蛋白与宿主蛋白的互作,首先将扩增的病毒ORF120基因连接到pGBKT7载体上,用pGBKT7-empty作为对照,在SDO(SD/-Trp)、SDO/X(SD/-Trp/X-α-Gal)和SDO/X/A(SD/-Trp/X-α-Gal/AbA)平板上验证pGBKT7-ORF120载体对酵母细胞的自激活和毒性。之后,将表达pGBKT7-ORF120的酵母菌株(Y2HGold)和文库酵母菌株(Y187)杂交,利用Western blot检测ORF120的表达情况;在DDO/X/A(SD/-Leu/-Trp/X-α-Gal/AbA)板上选择阳性菌落,根据其在QDO/X/A培养基上的生长情况对其进行鉴定,提取阳性质粒并进行PCR和测序鉴定。将质粒pGBKT7-p53和pGADT7-T共转化的细胞作为相互作用蛋白的阳性对照,而用pGBKT7-Lam和pGADT7-T共转化的细胞作为阴性对照,根据酵母细胞在选择性培养基上的生长情况来评估所检测蛋白质的相互作用。
1.2.4免疫共沉淀(co-immunoprecipitation,Co-IP) 利用Co-IP进一步确定病毒ORF120蛋白与宿主因子NONO之间的相互作用。将GFP-ORF120和N-Flag-NONO质粒分别共转染HeLa细胞和OFTu细胞,转染后24 h,收获细胞、裂解,用抗GFP或抗Flag抗体4℃孵育6 h后,利用蛋白A/G琼脂糖珠收集结合蛋白。最后,将产生的免疫沉淀用PBS洗涤3次,进行SDS-PAGE和Western blot分析。
1.2.5激光共聚焦观察 分别在HeLa细胞和OFTu细胞中共转染GFP-ORF120和mCherry-NONO质粒,转染后24 h,用PBS洗涤细胞3次,经4%多聚甲醛固定15 min,并用0.025% Triton X-100渗透处理。在室温下用5%脱脂奶粉封闭1 h后,用DAPI染核,并用激光共聚焦显微镜观察。为了进一步证实ORF120蛋白和宿主蛋白NONO的相互作用,将缺失病毒OV-SY17Δ120和拯救病毒OV-SY17-RV120(MOI=10)模拟感染或感染OFTu细胞。然后,用4%多聚甲醛固定细胞,0.025% Triton X-100渗透,5%脱脂奶粉封闭后,用抗NONO抗体于4℃ 进行孵育。然后以Alexa Fluor 594标记的山羊抗兔抗体或Alexa Fluor 488标记的羊抗兔抗体在37℃ 孵育1 h,最后,用DAPI 染核,并用共聚焦显微镜观察荧光。
1.2.6Western blot检测 为了进一步研究ORF120蛋白与宿主因子NONO表达的相关性,将His-ORF120质粒和N-Flag-NONO质粒分别共转染OFTu细胞或HeLa细胞,转染24 h后,收集细胞,裂解,提取蛋白后进行免疫印迹分析。
2 结果
2.1 酵母双杂交筛选确定宿主NONO蛋白为ORF120互作蛋白为了确定ORF120蛋白在细胞中的互作蛋白,首先提取OFTu细胞的mRNA(图1A),并反转为cDNA(图1B),然后构建OFTu细胞的cDNA文库,并成功构建了诱饵载体pGBKT7-ORF120。当pGBKT7-ORF120在酵母细胞中表达时,pGBKT7-ORF120转化酵母感受态细胞在SDO(SD/-Trp)培养基上的生长速率、状态与阳性对照无明显差异,且pGBKT7-ORF120转化酵母感受态细胞在SDO/X(SD/-Trp/X-α-Gal)和SDO/X/A(SD/-Trp/X-α-Gal/AbA)培养基不能生长成正常菌落,因此,pGBKT7-ORF120无毒性和自激活(图1D)。随后,将表达pGBKT7-ORF120的酵母菌株(Y2H Gold)和文库酵母菌株(Y187)杂交,Western blot检测显示ORF120在Y2H gold酵母细胞中正常表达(图1C);然后,用ORF120筛选来自OFTu细胞的cDNA文库,观察到酵母细胞呈现出三叶草的形状(图1E)。将选定的菌落转移到DDO/X/A(SD/-Leu/-Trp/X-α-Gal/AbA)板上,并在QDO/X/A板(SD/-Ade/-His/-Leu/-Trp/X-α-Gal/AbA)进一步鉴定,获得正常生长且变蓝的阳性菌落,利用PCR以及测序进行鉴定(图1F)。序列比对分析发现了一种位于大多数哺乳动物细胞核中的多功能核蛋白,即非POU结构域八聚体结合蛋白(NONO)。为了进一步证实ORF120蛋白和NONO蛋白的相互作用,用质粒pGBKT7-p53和pGADT7-T共转化的细胞作为阳性对照,而用pGBKT7-Lam和pGADT7-T共转化的细胞作为阴性对照。质粒pGBKT7-Lam和pGADT7-T或pGADT7-NONO共转化的酵母细胞,以及pGBKT7-ORF120和pGADT7-T共转化的酵母细胞,均不显示蓝色。而质粒pGBKT7-ORF120和pGADT7-NONO共转化的酵母细胞,在SD选择板上观察到强烈的生长现象(图1G),表明ORF120蛋白和NONO蛋白之间存在相互作用。
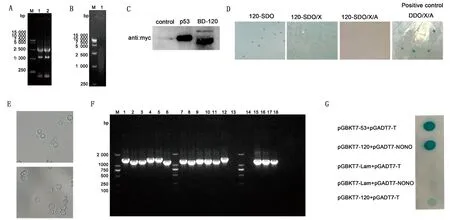
A,B.OFTu细胞mRNA及cDNA电泳检测;C.Western blot检测Y2Hgold酵母细胞中ORF120蛋白的表达情况,p53蛋白作为阳性对照;D.pGBKT7-ORF120的表达、自激活和毒性检测;E.转化酵母细胞在光学显微镜下的生长情况;F.酵母双杂交阳性菌落的PCR鉴定;G.质粒pGBKT7-ORF120和pGADT7-NONO的生长情况
2.2 Co-IP证实ORF120蛋白与宿主NONO蛋白之间的相互作用为了进一步证实ORF120蛋白与宿主蛋白NONO存在相互作用,对GFP-ORF120和N-Flag-NONO质粒转染的HeLa细胞和OFTu细胞的蛋白提取物进行Western blot分析,并用抗GFP或抗Flag抗体检测。与对照组相比,ORF120蛋白与宿主蛋白NONO发生免疫共沉淀(图2A,B),进一步证实ORF120与NONO蛋白的相互作用。
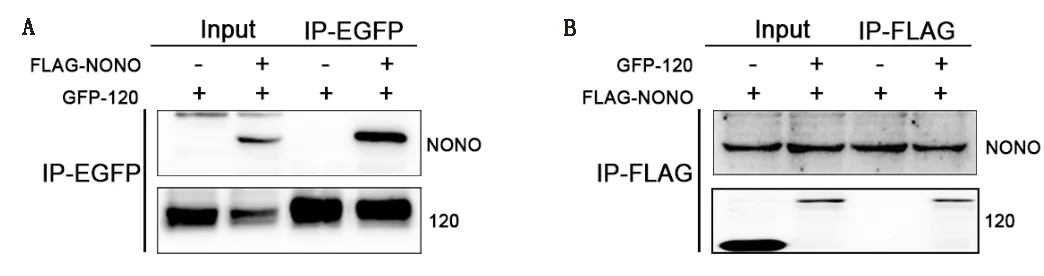
A.GFP-ORF120和N-Flag-NONO质粒转染HeLa细胞的蛋白提取物的Western blot检测结果;B.GFP-ORF120和N-Flag-NONO质粒转染OFTu细胞的蛋白提取物的Western blot检测结果
2.3 ORF120蛋白与NONO蛋白存在共定位现象利用激光共聚焦显微镜观察ORF120蛋白与宿主NONO蛋白的定位分布。ORF120主要分布于细胞质,在细胞核中仅有少量点状分布。如图3A所示,GFP-ORF120和mCherry-NONO质粒共转染HeLa细胞后,ORF120与NONO在细胞核边缘存在共定位现象;共转染OFTu细胞时,2种蛋白在胞核略靠近边缘处存在明显的共定位现象(图3B)。此外,分别用拯救病毒OV-SY17-RV120和缺失病毒OV-SY17Δ120感染OFTu细胞,由于蛋白表达量低,为观察到明显现象延长了感染时间,导致细胞核出现明显变形。观察发现,被拯救病毒OV-SY17-RV120感染的OFTu细胞中, RFP-ORF120蛋白与NONO蛋白也存在共定位,而被OV-SY17Δ120感染的细胞中未观察到共定位现象(图3C)。上述结果证实ORF120蛋白与NONO蛋白存在共定位现象,为进一步研究病毒ORF120蛋白与宿主NONO蛋白的互作提供理论依据。
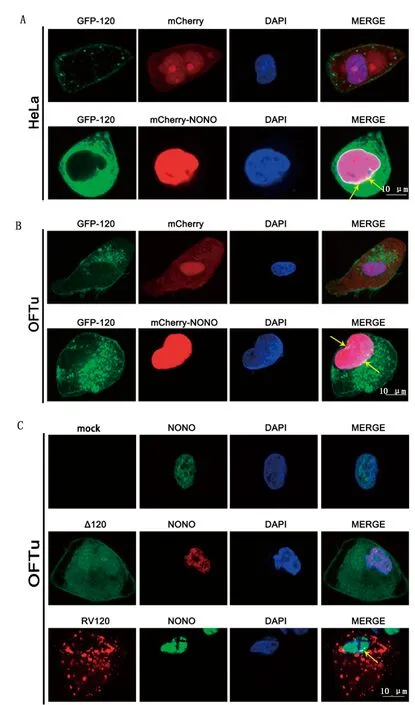
A.GFP-ORF120和mCherry-NONO质粒转染HeLa细胞中ORF120与NONO蛋白的共定位现象(箭头标出);B.GFP-ORF120和mCherry- NONO质粒转染OFTu细胞中ORF120与NONO蛋白的共定位现象(箭头标出);C.携带RFP荧光标记拯救毒株(OV-SY17-RV120)和携带GFP荧光标记缺失毒株(OV-SY17Δ120)感染细胞中ORF120与NONO蛋白的共定位观察(箭头标出)
2.4 ORF120蛋白与宿主NONO蛋白存在剂量依赖性的相互抑制作用为了进一步确定ORF120蛋白与宿主蛋白NONO的互作关系,利用Western blot检测His-ORF120和N-Flag-NONO共转染OFTu细胞或HeLa细胞中ORF120蛋白和NONO蛋白的表达水平。结果显示,在ORF120过表达的OFTu细胞和HeLa细胞中,NONO表达量下降(图4A,C),而NONO过表达的OFTu细胞和HeLa细胞中,ORF120表达也呈现降低趋势(图4B,D),表明ORF120蛋白和NONO之间存在剂量依赖性的相互抑制。
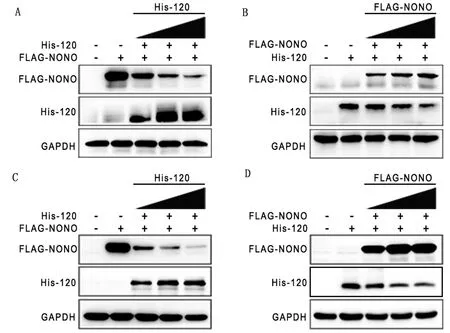
A,C.ORF120蛋白过表达的OFTu细胞和HeLa细胞中NONO表达量下降; B,D.NONO蛋白过表达OFTu细胞和HeLa细胞中ORF120表达量呈下降趋势
3 讨论
目前,ORFV被证实可通过自身编码的多种免疫调节因子调节宿主的抗病毒反应,然而,其如何通过劫持宿主细胞实现感染和复制的机制尚不清楚[7],从病毒与宿主角度出发,深入开展宿主蛋白在ORFV感染过程中的功能研究,将为解析ORFV免疫逃逸机制奠定基础。本课题组的前期工作证实,病毒ORF120蛋白主要分布于细胞质,是与病毒毒力相关的蛋白;同时,ORF120蛋白可通过与胞浆G3BP1蛋白的结合对NF-κB天然免疫信号通路进行调节[16]。由于ORF120蛋白被观察到在胞核中也有少量分布,那么胞核是否存在与其互作的宿主蛋白则有待于挖掘[17]。因此,本研究旨在通过进一步寻找与ORF120蛋白互作的宿主蛋白,为全面解析ORFV逃逸宿主的抗病毒免疫机制提供突破口。
NONO蛋白为DBHS蛋白家族的一员,可参与蛋白质-蛋白质以及蛋白质-核酸[18]的相互作用,调节多种正常生理活动,如在细胞迁移等方面发挥作用[19];另外,NONO蛋白也与多种肿瘤的发生发展、细胞免疫反应等密切相关,如参与cGAS介导的先天性免疫激活,可通过直接与病毒衣壳的结合来对抗病毒侵染[20]。作为参与细胞免疫的重要组分,该蛋白也是病毒感染过程中的重要调控靶标,人类免疫缺陷病毒(HIV-1)[14]、伪狂犬病病毒(PRV)[15]和EB病毒(EBV)[8]等多种病毒均可通过对NONO蛋白的调控逃避宿主免疫反应,促进自身的复制增殖。
在本研究中,我们使用酵母双杂交系统研究了宿主因子与ORF120蛋白的相互作用,发现宿主NONO蛋白与ORF120蛋白具有相互作用。之后,结合免疫共沉淀、激光共聚焦共定位分析进一步验证了两者之间的互作。进一步利用Western blot检测证实NONO蛋白与病毒ORF120蛋白表达存在剂量依赖性的相互抑制作用。过表达病毒ORF120蛋白能够降低宿主因子NONO蛋白的表达,表明ORF120蛋白可通过对宿主因子NONO蛋白的调控参与ORFV复制环节的调节,为后期深入探讨宿主NONO蛋白在ORFV感染过程中的功能研究提供重要理论依据,同时为全面解析ORFV致病机制以及抗病毒药物靶点的筛选提供新思路。

