麦芽提取物调控NLRP3/Caspase-1/IL-1β通路抑制高催乳素血症大鼠垂体前叶细胞增殖及催乳素分泌
汪爱华,张小华,张飞忠,王雄,赵勇
高催乳素血症(hyperprolactinemia,HPRL)是一种下丘脑-垂体轴生殖内分泌紊乱综合征,发病率较高,特点是血清催乳素(prolactin,PRL)水平明显升高[1]。HPRL 的主要临床症状包括溢乳、月经失调、多毛,甚至不孕等[2]。目前临床上多使用溴隐亭等药物治疗HPRL。溴隐亭虽然有一定的疗效,但其引起的头晕、恶心、呕吐,对多巴胺受体激动剂耐药等不良反应也不容忽视[3]。因此,更加安全有效的治疗对于HPRL 意义重大。据报道,麦芽提取物(malt extract,ME)可降低HPRL 大鼠脑垂体PRL 的表达[4]。垂体前叶细胞是机体的重要内分泌腺细胞,关于ME对HPRL大鼠垂体前叶细胞增殖及PRL分泌的影响鲜有报道。相关研究显示,靶向多巴胺受体D2(dopamine receptor D2,DRD2)依赖性Nod样受体蛋白3(Nod-like receptor protein 3,NLRP3)/胱天蛋白酶-1(cysteinyl aspartate specific protease-1,Caspase-1)/白细胞介素-1β(interleukin-1β,IL-1β)通路可抑制小胶质细胞活化[5]。而ME 能否通过调控DRD2 介导的NLRP3/Caspase-1/IL-1β 通路活化来影响HPRL大鼠垂体前叶细胞增殖及PRL分泌尚不明确。本研究旨在探究ME 对HPRL 大鼠垂体前叶细胞增殖及PRL分泌的影响及其作用机制。
1 材料与方法
1.1 动物 8 周龄SPF 级雌性SD 大鼠12 只,体质量240~250 g,购自凯学生物科技(上海)有限公司,生产许可证号:SCXK(沪)2021-0002,所有动物实验均获得本院动物伦理委员会的批准(批准文号:21005026)。
1.2 主要试剂及仪器 ME(规格:100 g)购自北京普非生物公司;NLRP3 激活剂腺苷三磷酸(adenosine 5'-triphosphate,ATP)购自美国MCE 公司;盐酸甲氧氯普胺购自上海金穗生物科技有限公司;RPMI 1640 培养基购自上海乐赛生物科技有限公司;CCK-8 试剂盒购自上海广锐生物公司;Annexin V-FITC/PI 细胞凋亡试剂盒购自武汉益普生物公司;PRL 酶联免疫吸附试验(ELISA)试剂盒购自上海钦诚生物公司;兔源增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、DRD2、生长激素、PRL、多巴胺转运体(dopamine transporter,DAT)、NLRP3、Caspase-1、IL-1β、GAPDH 一抗及羊抗兔IgG二抗均购自英国Abcam 公司。TS2009 型光学显微镜购自河南云飞科技发展有限公司;SAF-680T 酶标仪购自上海巴玖实业有限公司;CytoFLEX S流式细胞仪购自贝克曼库尔特商贸(中国)有限公司;DYCZ-24DH 型双板垂直电泳仪购自北京六一仪器厂。
1.3 HPRL大鼠模型的构建 按照随机数字表法抽取6只大鼠,通过皮下注射100 mg/kg 盐酸甲氧氯普胺注射液,每日1次,持续5 d 的方式构建HPRL 大鼠模型[6]。若大鼠出现倦怠、呼吸急促、易怒等症状,且血清PRL 水平异常升高时,认为造模成功,造模成功的大鼠设为HPRL 组。剩余的6 只大鼠设为对照组,皮下注射等体积生理盐水。
1.4 大鼠垂体前叶细胞的分离 分别从对照组和HPRL 组大鼠中分离垂体前叶细胞。具体步骤:将大鼠麻醉处死后,取下大脑,无菌分离垂体前叶并放在RPMI 1640 培养基中,用剪刀将其剪成1 mm3碎块,加入胶原酶和DNA 酶Ⅰ,在常温水浴下消化1 h,弃上清液,用培养液洗涤2 次后再用含20%胎牛血清(FBS)的RPMI 1640 培养基培养细胞[7]。将从对照组大鼠中分离出的垂体前叶细胞命名为NC组,从HPRL组中分离的垂体前叶细胞命名为Model组。
1.5 大鼠垂体前叶细胞的免疫组织化学染色鉴定 将专用圆形盖玻片放入24 孔板中,加入密度为1×104个/mL 的细胞悬液,培养至细胞汇合度达70%时,加入生长激素、PRL 一抗,4 ℃下孵育过夜,再加入二抗工作液孵育30 min,经DAB显色、苏木素复染后进行免疫细胞化学鉴定,阴性对照用磷酸盐缓冲液替代一抗进行孵育,光学显微镜观察大鼠垂体前叶细胞中生长激素、PRL表达情况。
1.6 大鼠垂体前叶细胞的处理 根据前期预实验结果,将Model 组大鼠垂体前叶细胞分别用0、25、50、100 mg/L ME,5 mmol/L ATP[8],100 mg/L ME+5 mmol/L ATP 处理48 h,依次命名为空白组(Blank 组)、ME 低剂量组(ME-L 组)、ME 中剂量组(ME-M 组)、ME 高剂量组(ME-H 组)、ATP 组、ME-H+ATP组,处理结束后,收集细胞用于后续实验。
1.7 指标检测
1.7.1 垂体前叶细胞形态的观察 细胞分组处理48 h后再用结晶紫染色20 min,光学显微镜下观察各组垂体前叶细胞形态。
1.7.2 CCK-8 法检测垂体前叶细胞增殖 将各组细胞以1×104个/孔的密度接种在96 孔板中,培养48 h 后,将10 µL CCK-8 试剂加入每个孔中并孵育1 h。使用酶标仪检测450 nm波长处的光密度(OD450)值。
1.7.3 流式细胞术检测垂体前叶细胞凋亡 将各组垂体前叶细胞稀释至密度为1×106个/mL,取100 µL 细胞悬液加入离心管中,向其中加入5µL Annexin V-FITC 试剂室温避光孵育10 min,再向离心管中加入5 µL PI 试剂,避光孵育5 min,最后加入PBS 使溶液终体积达到500µL。利用流式细胞仪检测细胞凋亡情况。
1.7.4 ELISA 法检测垂体前叶细胞上清液中PRL 水平 严格按照试剂盒说明书检测垂体前叶细胞上清液中PRL水平。
1.7.5 Western blot检测垂体前叶细胞中DRD2、DAT、PCNA、NLRP3、Caspase-1、IL-1β 蛋白表达 RIPA 裂解缓冲液提取大鼠垂体前叶细胞总蛋白质,蛋白质经定量、电泳分离、转膜、封闭后,将膜与一抗DRD2(1∶2 000)、DAT(1∶1 000)、PCNA(1∶1 000)、NLRP3(1∶2 000)、Caspase-1(1∶1 000)、IL-1β(1∶2 000)、GAPDH(1∶2 000)在4 ℃下孵育过夜,然后与二抗(1∶1 000)在37 ℃下孵育1 h。加入ECL 试剂检测蛋白质印迹。Image-Pro Plus 6.0软件分析蛋白质条带灰度值。以目的蛋白与内参蛋白灰度值比值作为目的蛋白的相对表达量。
1.8 统计学方法 使用SPSS 22.0 软件进行数据分析,符合正态分布的计量资料以表示,多组间均数比较采用单因素方差分析,组间多重比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠垂体前叶细胞的鉴定 阴性对照细胞胞质有少量阳性颗粒,胞核呈蓝色;生长激素阳性颗粒存在于所有大鼠垂体前叶细胞中,细胞质染色深,呈深棕褐色;PRL 阳性颗粒存在于所有大鼠垂体前叶细胞中,细胞质着色稍浅,呈浅棕褐色。分离培养的大鼠垂体前叶细胞能正常分泌生长激素和PRL。NC 组、Model 组分离细胞即为大鼠垂体前叶细胞,见图1。
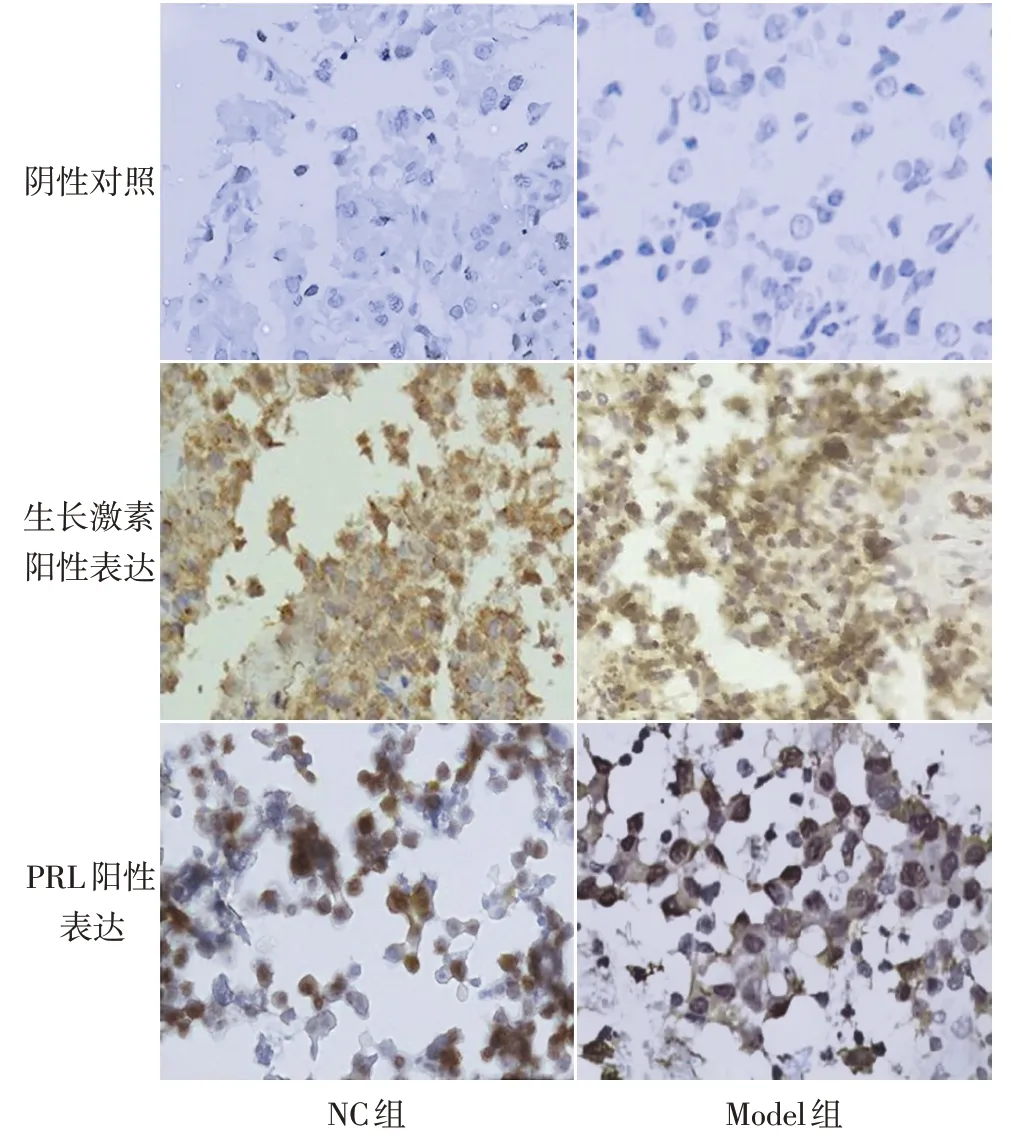
Fig.1 Immunohistochemical identification of growth hormone and PRL secreted by anterior pituitary cells of rats(×200)图1 免疫组织化学鉴定大鼠垂体前叶细胞中生长激素和PRL的表达(×200)
2.2 ME 对各组垂体前叶细胞形态的影响 NC 组垂体前叶细胞形状规则;Blank组垂体前叶细胞体积变小,形状不规则,细胞核固缩;与Blank 组比较,ME-L 组、ME-M 组、ME-H 组垂体前叶细胞形态有所改善,而ATP组垂体前叶细胞形态更加不规则;与ME-H 组比较,ME-H+ATP 组垂体前叶细胞体积及形状不规则,见图2。

Fig.2 Morphological comparison of anterior pituitary cells of rats between different groups(crystal violet staining,×200)图2 各组大鼠垂体前叶细胞形态比较(结晶紫染色,×200)
2.3 ME对各组大鼠垂体前叶细胞增殖的影响 与NC组比较,Blank组垂体前叶细胞OD450值升高(P<0.05);与Blank组比较,ME-L组、ME-M组、ME-H组大鼠垂体前叶细胞OD450值降低,且呈剂量依赖性,而ATP 组大鼠垂体前叶细胞OD450值升高(P<0.05);与ME-H 组比较,ME-H+ATP 组大鼠垂体前叶细胞OD450值升高(P<0.05),见表1。
Tab.1 Comparison of OD450 value,apoptosis rate and PRL level of anterior pituitary cells of HPRL rats between different groups表1 各组HPRL大鼠垂体前叶细胞OD450值、细胞凋亡率、PRL水平比较 (n=6,)

Tab.1 Comparison of OD450 value,apoptosis rate and PRL level of anterior pituitary cells of HPRL rats between different groups表1 各组HPRL大鼠垂体前叶细胞OD450值、细胞凋亡率、PRL水平比较 (n=6,)
*P<0.05,**P<0.01;a与NC 组比较,b与Blank 组比较,c与ME-L组比较,d与ME-M组比较,e与ME-H组比较,P<0.05。表2、3同。
组别NC组Blank组ME-L组ME-M组ME-H组ATP组ME-H+ATP组F OD450值0.39±0.03 1.18±0.11a 0.95±0.08b 0.74±0.05bc 0.45±0.04bcd 1.44±0.12b 0.81±0.07e 139.400**细胞凋亡率(%)12.64±0.31 4.05±0.10a 6.21±0.11b 8.36±0.12bc 11.12±0.13bcd 1.59±0.08b 7.34±0.16e 3 416.000**PRL(mg/L)193.36±4.12 368.82±7.11a 321.26±5.79b 280.65±5.33bc 221.27±4.34bcd 473.54±8.32b 305.56±6.71e 1 405.000**
2.4 ME 对各组垂体前叶细胞凋亡的影响 与NC组比较,Blank 组垂体前叶细胞凋亡率降低(P<0.05);与Blank组比较,ME-L组、ME-M组、ME-H组垂体前叶细胞凋亡率升高,且呈剂量依赖性,而ATP组垂体前叶细胞凋亡率降低(P<0.05);与ME-H组比较,ME-H+ATP 组垂体前叶细胞凋亡率降低(P<0.05),见图3、表1。
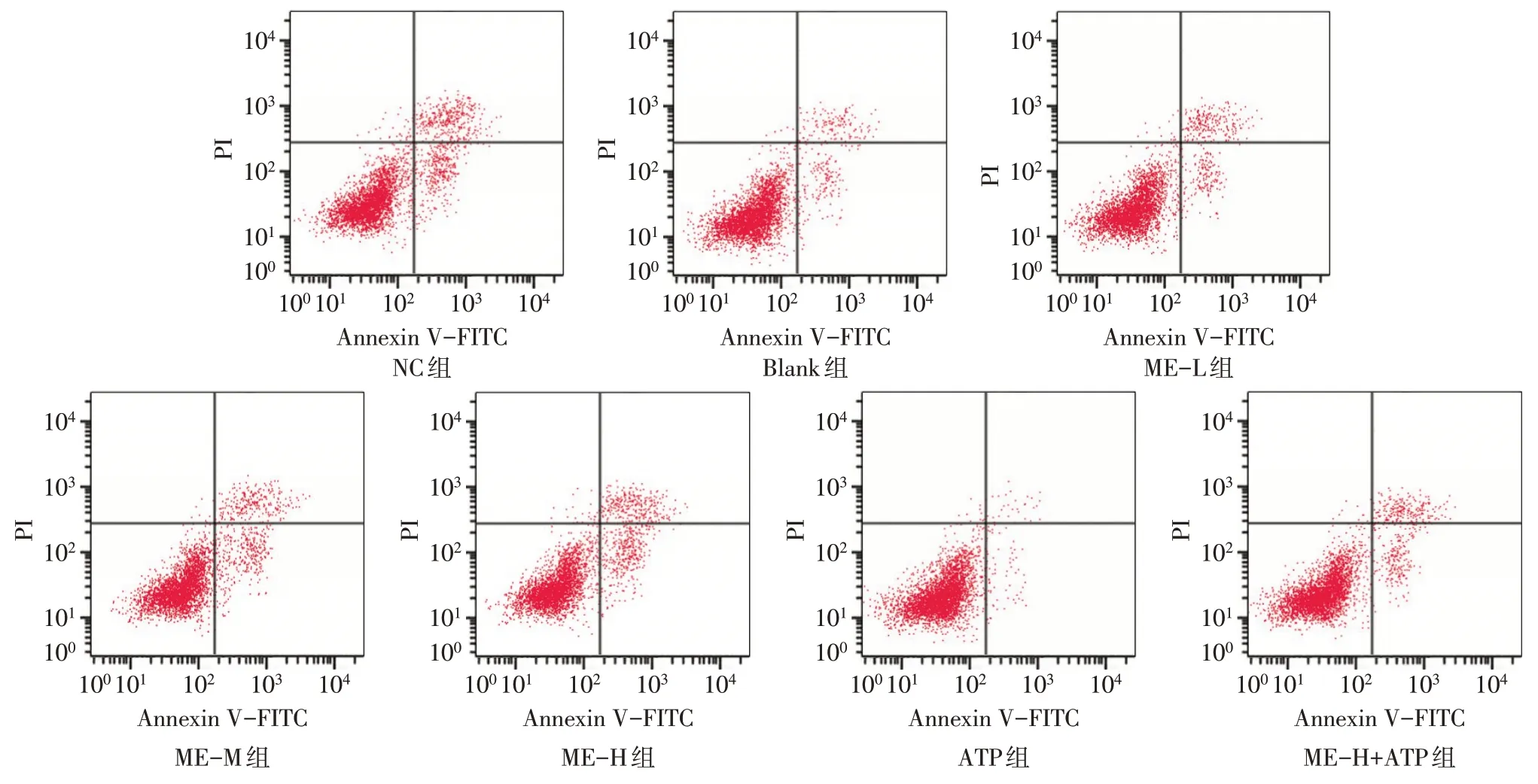
Fig.3 Apoptosis of anterior pituitary cells in each group detected by flow cytometry图3 流式细胞术检测各组垂体前叶细胞凋亡
2.5 ME对各组垂体前叶细胞上清液中PRL水平的影响 与NC 组比较,Blank 组垂体前叶细胞上清液中PRL 水平升高(P<0.05);与Blank 组比较,ME-L组、ME-M 组、ME-H 组大鼠垂体前叶细胞上清液中PRL水平降低,且呈剂量依赖性,而ATP组大鼠垂体前叶细胞上清液中PRL水平升高(P<0.05);与MEH 组比较,ME-H+ATP 组大鼠垂体前叶细胞上清液中PRL水平升高(P<0.05),见表1。
2.6 ME 对各组垂体前叶细胞多巴胺表达的影响 与NC 组比较,Blank 组垂体前叶细胞中DRD2蛋白表达降低,DAT 蛋白表达升高(P<0.05);与Blank 组比较,ME-L、M、H组垂体前叶细胞中DRD2蛋白表达升高,DAT 蛋白表达降低,且呈剂量依赖性,而ATP组垂体前叶细胞中DRD2蛋白表达降低,DAT 蛋白表达升高(P<0.05);与ME-H 组比较,ME-H+ATP 组垂体前叶细胞中DRD2 蛋白表达降低,DAT蛋白表达升高(P<0.05),见图4、表2。
Tab.2 Comparison of expression levels of DRD2 and DAT proteins in anterior pituitary cells of rats in each group表2 各组大鼠垂体前叶细胞中DRD2、DAT蛋白表达的比较(n=6,)
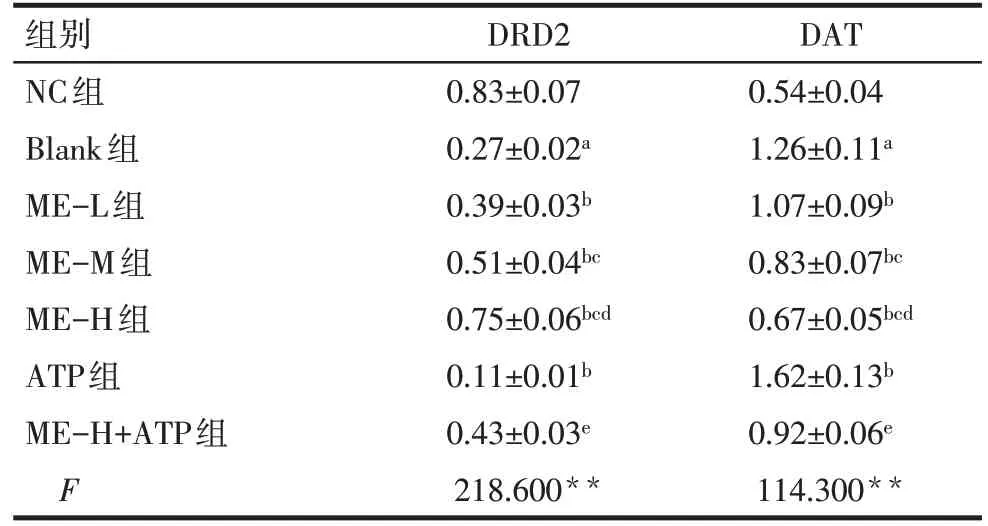
Tab.2 Comparison of expression levels of DRD2 and DAT proteins in anterior pituitary cells of rats in each group表2 各组大鼠垂体前叶细胞中DRD2、DAT蛋白表达的比较(n=6,)
组别NC组Blank组ME-L组ME-M组ME-H组ATP组ME-H+ATP组F DRD2 0.83±0.07 0.27±0.02a 0.39±0.03b 0.51±0.04bc 0.75±0.06bcd 0.11±0.01b 0.43±0.03e 218.600**DAT 0.54±0.04 1.26±0.11a 1.07±0.09b 0.83±0.07bc 0.67±0.05bcd 1.62±0.13b 0.92±0.06e 114.300**

Fig.4 Western blot analysis of DRD2 and DAT protein expression in rat anterior pituitary cells图4 Western blot检测大鼠垂体前叶细胞中DRD2、DAT蛋白表达
2.7 ME 对各组垂体前叶细胞中增殖相关蛋白及NLRP3/Caspase-1/IL-1β 通路相关蛋白表达的影响 与NC 组比较,Blank 组大鼠垂体前叶细胞中PCNA、NLRP3、Caspase-1、IL-1β蛋白表达升高(P<0.05);与Blank组比较,ME-L组、ME-M组、ME-H组大鼠垂体前叶细胞中的PCNA、NLRP3、Caspase-1、IL-1β蛋白表达降低,且呈剂量依赖性,而ATP组大鼠垂体前叶细胞中PCNA、NLRP3、Caspase-1、IL-1β蛋白表达升高(P<0.05);与ME-H 组比较,ME-H+ATP 组大鼠垂体前叶细胞中的PCNA、NLRP3、Caspase-1、IL-1β 蛋白表达升高(P<0.05),见图5、表3。
Tab.3 Comparison of expression levels of PCNA,NLRP3,Caspase-1,IL-1β in anterior pituitary cells of each group表3 各组大鼠垂体前叶细胞中PCNA、NLRP3、Caspase-1、IL-1β蛋白表达水平比较(n=6,)

Tab.3 Comparison of expression levels of PCNA,NLRP3,Caspase-1,IL-1β in anterior pituitary cells of each group表3 各组大鼠垂体前叶细胞中PCNA、NLRP3、Caspase-1、IL-1β蛋白表达水平比较(n=6,)
组别NC组Blank组ME-L组ME-M组ME-H组ATP组ME-H+ATP组F PCNA 0.27±0.02 0.88±0.07a 0.73±0.06b 0.55±0.05bc 0.36±0.02bcd 1.28±0.11b 0.63±0.05e 183.500**NLRP3 0.58±0.04 1.57±0.12a 1.32±0.10b 1.11±0.09bc 0.73±0.06bcd 1.82±0.13b 1.20±0.11e 120.500**Caspase-1 0.38±0.03 1.42±0.11a 1.24±0.12b 1.01±0.08bc 0.54±0.04bcd 1.68±0.12b 1.12±0.13e 134.900**IL-1β 0.15±0.01 1.23±0.11a 1.06±0.11b 0.83±0.09bc 0.32±0.03bcd 1.58±0.11b 1.20±0.13e 178.700**

Fig.5 Western blot analysis of PCNA,NLRP3,Caspase-1,IL-1β in rat anterior pituitary cells图5 Western blot检测大鼠垂体前叶细胞中PCNA、NLRP3、Caspase-1、IL-1β蛋白表达
3 讨论
垂体前叶是由多种内分泌细胞组成,其可以合成和分泌多种类型的激素,从而协调多项生理功能,包括生长、新陈代谢、应激反应、生殖和哺乳,如泌乳细胞分泌PRL[9]。适当的PRL 对于维持生殖功能、免疫系统调节、代谢稳态和胰腺胰岛素分泌十分重要,而PRL 水平过高易引起HPRL 等多种疾病[10]。在正常情况下,大鼠垂体前叶细胞的增殖活性和PRL 水平较低[11]。本研究分离出正常大鼠和HPRL大鼠的垂体前叶,并经剪碎、消化、培养等操作后,形态学观察及免疫组织化学染色证实成功得到NC组、Model 组大鼠垂体前叶细胞。此外,本研究发现,与NC 组比较,Blank 组大鼠垂体前叶细胞OD450值、上清液中PRL 水平升高,细胞凋亡率降低,表明HPRL大鼠垂体前叶细胞增殖活性及PRL 水平异常升高。PCNA 作为常用于衡量细胞增殖能力的常用指标,其水平越高,表明细胞增殖能力越强[12]。Blank组大鼠垂体前叶细胞中PCNA蛋白表达水平高于NC组,再次证实了HPRL大鼠垂体前叶细胞增殖能力异常增强。PRL 在正常情况下是被限制释放的,且由多巴胺介导,多巴胺可作用于细胞表面的DRD2,进而抑制PRL 的分泌[13]。DAT 是特异性表达于多巴胺能神经元的蛋白,其水平升高,可使多巴胺浓度降低,进而促进PRL 的分泌[14]。本研究结果显示,与NC 组比较,Blank 组垂体前叶细胞中DRD2 蛋白表达降低,DAT 蛋白表达升高,提示Blank 组垂体前叶细胞多巴胺表达受到抑制。
ME 中含有一定量的黄酮和多糖,已有研究显示,ME 能明显降低甲氧氯普胺诱导HPRL 小鼠的PRL水平[15];ME对实验性HPRL具有良好的治疗效果[16]。而关于ME 对HPRL 大鼠垂体前叶细胞增殖及PRL分泌的影响鲜有报道。本研究显示,ME可抑制HPRL 大鼠垂体前叶细胞增殖及PRL 分泌,且呈剂量依赖性,提示ME 有可能成为治疗HPRL 的药物。
DRD2 已被视为HPRL 治疗中的潜在靶点[17]。在ATP、活性氧、溶酶体内容物或其他因素的刺激下,NLRP3 募集衔接分子凋亡相关斑点样蛋白和Caspase-1 前体以促进Caspase-1 活化,这个过程导致促炎细胞因子IL-1β的表达[18]。近年来多项研究表明,DRD2 介导的NLRP3/Caspase-1/IL-1β 通路参与多种疾病的进展,如DRD2 通过抑制星形胶质细胞中NLRP3/Caspase-1/IL-1β通路的激活,进而抑制神经炎症的进展[19]。本研究亦证实ME 可以上调HPRL 大鼠垂体前叶细胞中DRD2 蛋白表达,而ME能否调控NLRP3/Caspase-1/IL-1β 通路影响HPRL大鼠垂体前叶细胞增殖及PRL分泌尚不明确。本研究结果显示,ME可抑制HPRL大鼠垂体前叶细胞中NLRP3、Caspase-1、IL-1β蛋白表达,推测ME可能通过抑制NLRP3/Caspase-1/IL-1β 通路进而抑制HPRL 大鼠垂体前叶细胞增殖及PRL 分泌。为了验证该推测,本研究在高剂量ME 作用的基础上再用NLRP3 激活剂ATP 干预HPRL 大鼠垂体前叶细胞,结果显示,ATP减弱了高剂量ME对HPRL大鼠垂体前叶细胞增殖与PRL 分泌的抑制作用,证实了ME可能通过抑制NLRP3/Caspase-1/IL-1β 通路进而抑制HPRL 大鼠垂体前叶细胞增殖及PRL 分泌。然而,本研究未在高剂量ME 作用的基础上再设置DRD2 的阻断剂来干预HPRL 大鼠,进而验证ME 对NLRP3/Caspase-1/IL-1β 通路的抑制作用是否是通过DRD2来介导的,这是本研究的不足之处。
综上所述,ME可能通过抑制NLRP3/Caspase-1/IL-1β 通路进而抑制HPRL 大鼠垂体前叶细胞增殖及PRL 分泌。然而本研究仅仅进行了体外研究,有待体内实验进一步验证。

