一种新的粒毛盘菌多糖对小鼠急性肝损伤的保护作用
何雅玲, 张鑫淼, 叶 明
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
肝脏是人体的重要器官,在人体营养、新陈代谢、解毒和免疫中起着至关重要的作用,但很容易受到有毒物质的伤害,包括酒精、药物滥用、病毒感染和意外中毒等[1]。事实证明,严重的急性肝损伤可能会导致黄疸、严重的凝血功能障碍和其他致命的临床问题[2]。 目前为止,仍然缺乏可靠的药物来治愈这种伤害,可见肝病已成为影响人类健康的最常见疾病之一[3]。
顺铂(CP)是一种非特异性的细胞毒性抗肿瘤药物,虽然可以杀死肿瘤细胞,但对正常细胞也可产生毒性作用[4]。有研究表明,顺铂对肝脏、肾脏、肺脏、脾脏和大脑具有毒性作用[5]。其中肾毒性已进入动物和临床研究阶段,但肝毒性尚未引起足够重视,因此,降低顺铂引起的肝脏毒性仍是亟待解决的问题。
粒毛盘菌是一类分布广泛的腐生性真菌,是世界菌物资源的重要组成部分[6]。近几年对粒毛盘菌的研究发现该类真菌可以产生多种活性物质。粒毛盘菌YM156胞内黑色素在镉暴露小鼠中通过抗氧化和抗炎作用对肝损伤具有治疗作用[7]。粒毛盘菌多酚可以作为抗凝剂,并且可以用作潜在的天然药物预防血栓形成[8]。进一步研究发现,粒毛盘菌多糖具有较好的抗氧化[9]、抗肿瘤[10]、免疫调节[11]、降血糖[12]等功能,其中,粒毛盘菌YM406胞外多糖(LEP-2a)及其衍生物对CCl4所致急性肝损伤具有改善作用[6]。但是关于粒毛盘菌多糖对顺铂诱导小鼠急性肝损伤保护作用尚不清楚。
本文从粒毛盘菌YM38发酵液中提取、纯化、分离出多糖LEP-1a,建立顺铂诱导的急性肝损伤模型,研究LEP-1a对顺铂诱导小鼠急性肝损伤的肝保护作用,为LEP-1a作为一种治疗顺铂引起急性肝损伤的新药提供了理论依据。
1 材料和方法
1.1 材料
粒毛盘菌YM38子实体收集于安徽黄山,并由合肥工业大学微生物资源与应用研究中心保存;小鼠肝脏测定的普通试剂盒购于南京建城生物工程研究院;小鼠血清白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)测定的ELISA试剂盒购于联科生物技术股份有限公司;水飞蓟素购于阿拉丁试剂(上海)有限公司。其余试剂均为分析纯。
1.2 粒毛盘菌YM38多糖LEP-1a的提取纯化
根据文献[11]提取方法,粒毛盘菌YM38发酵液体发酵10 d结束后,对其菌液进行抽滤、旋蒸,用95%乙醇进行醇沉,离心取沉淀,沉淀用蒸馏水复溶,通过Sevage法除蛋白,30% H2O2脱色,将脱色完的多糖溶液在流动的自来水中透析48 h, 再用蒸馏水透析24 h后冷冻干燥获得粗多糖。
粗多糖通过DEAE-cellulose 52色谱柱分别用0、0.1、0.3、0.5 mol/L NaCl进行洗脱,收集由0.1 mol/L NaCl洗脱的主要组分,并进一步用双蒸水在Sephadex G-100色谱柱中进行洗脱,收集分级分离后的主要组分,透析、冻干后得到新的粒毛盘菌多糖LEP-1a。
1.3 实验方法
1.3.1 实验分组
在食品安全预防工作和监管工作中,无论是美国还是欧盟,都能通过专业机构收集和分析一些有关的食品风险、安全信息等,也能为法律法规的实施提供科学依据。为了增强消费者的自身保护能力,掌握食品安全的实际信息,可以促使食品安全信息系统的形成,加强对不合格产品的分析,保证食品市场检测信息的渗透,在科学探究的情况下,也可以更好地服务于社会。
8周龄健康的ICR雄性小鼠购自安徽医科大学(25~28 g,40只)(证书编号:安徽医学实验动物的第一号许可证)。所有实验小鼠均在标准条件下严格喂养,并保持在可控制的温度(24~26 ℃)、湿度(55±5)%和12 h的明/暗循环中,可以自由饮水和进食。
所有小鼠适应饲养1周后,随机分为5组(n=6),包括正常(N)组、模型(M)组(顺铂45 mg/kg)、阳性药(P)组(水飞蓟素100 mg/kg)、LEP-1a低剂量(LL)组(100 mg/kg)、LEP-1a高剂量(LH)组(200 mg/kg)。 正常组和模型组小鼠灌胃蒸馏水0.2 mL,其余组小鼠等量灌胃给药,连续7 d,在第7天灌胃3 h后,除正常组腹腔注射0.1 mL生理盐水,其余组单剂量腹腔注射0.1 mL顺铂,禁食不禁水,16 h后脱颈处死小鼠,并从眼球中采血,血浆在4 ℃下以4 000 r/min的速度离心15 min产生血清[13]。将一部分肝组织固定在4%多聚甲醛中以进行组织学分析,其余的肝脏组织则存放在-80 ℃的冰箱中,以进行进一步的生化分析。
1.3.2 体质量和肝指数分析
小鼠体质量每周称量1次。在最后一次治疗16 h后称质量,处死小鼠,解剖取出肝脏,计算肝脏指数,具体计算公式如下:

1.3.3 小鼠肝脏生化指标分析
将肝组织在生理盐水(1∶9)中匀浆,并将匀浆液于3 500 r/min在4 ℃下离心10 min。 收集上清液,并严格遵守制造商(南京建城生物工程研究所)市售的试剂盒测试规则测定甘油三酯(TG)、总胆固醇(TC)、丙二醛(MDA)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)水平。
1.3.4 小鼠血清生化指标分析
1.3.5 小鼠肝脏组织形态学染色
将适量肝组织置于10%福尔马林缓冲液中固定24 h后对其进行脱水、浸蜡、包埋、切片,并用苏木精-伊红(HE)染色后用显微镜观察。从肝右叶收集肝组织样品,用10%福尔马林缓冲液固定,包埋在肝中,分成5 μm切片,并用苏木精-伊红(HE)染色[14]。
1.4 数据分析
所有实验数据使用Origin 8.0进行统计分析,以(平均值±标准差)表示,采用one-way ANOVA分析各组数据是否存在显著性差异。当P<0.05和P<0.01时,在统计学上分别被认为差异性显著和极显著。
2 结果与分析
2.1 LEP-1a对小鼠体质量和肝指数的影响
LEP-1a对小鼠体质量、肝脏质量和肝指数的影响见表1所列。由表1可知:各组小鼠初始体质量无明显差异,顺铂给药导致模型组小鼠体质量下降显著(P<0.01),肝脏质量和肝指数在所有组中表达最高,说明顺铂造模成功;与模型组相比,粒毛盘菌多糖高、低剂量给药组(LL和LH) 肝指数均不同程度降低。结果表明LEP-1a能够抑制急性肝损伤小鼠的肝脏指数升高,使肝功能得到一定改善,具有一定治疗效果。
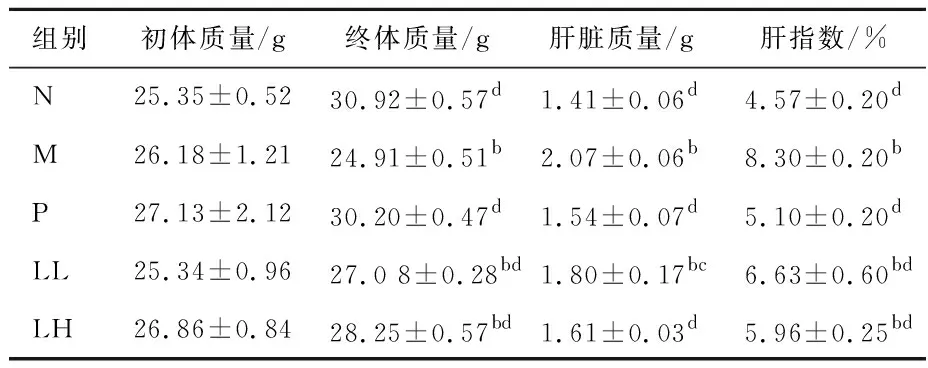
表1 LEP-1a对小鼠体质量和肝脏指标的影响
2.2 LEP-1a对小鼠肝脏TG和TC水平的影响
LEP-1a对小鼠肝脏TG和TC水平的影响如图1所示。
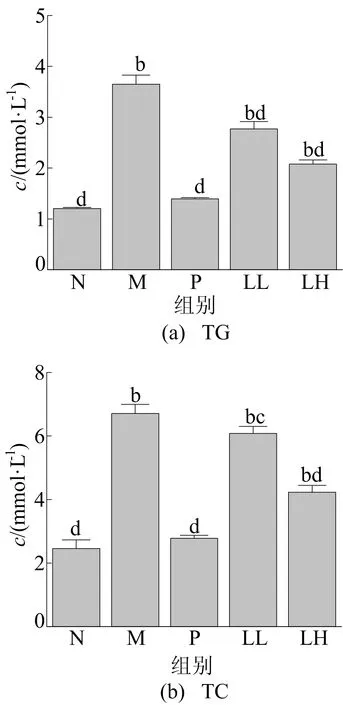
图1 LEP-1a对小鼠体内TG和TC水平的影响
从图1可以看出,与正常(N)组相比,阳性治疗(P)组中TG、TC浓度无显著差异(P>0.05),模型组小鼠TG、TC浓度极显著升高(P<0.01),说明小鼠急性肝损伤模型已建立;与模型(M)组相比,粒毛盘菌多糖预处理组(LL和LH)小鼠肝脏中TG、TC浓度均明显降低,具有统计学意义(P<0.05)。
2.3 LEP-1a对小鼠肝功能的影响
血清ALT、AST和AKP活性与肝损伤程度成正比[15]。LEP-1a对小鼠肝功能的影响如图2所示。从图2可以看出,与正常组相比,模型(M)组的血清中ALT、AST和AKP活性显著升高(P<0.01)。
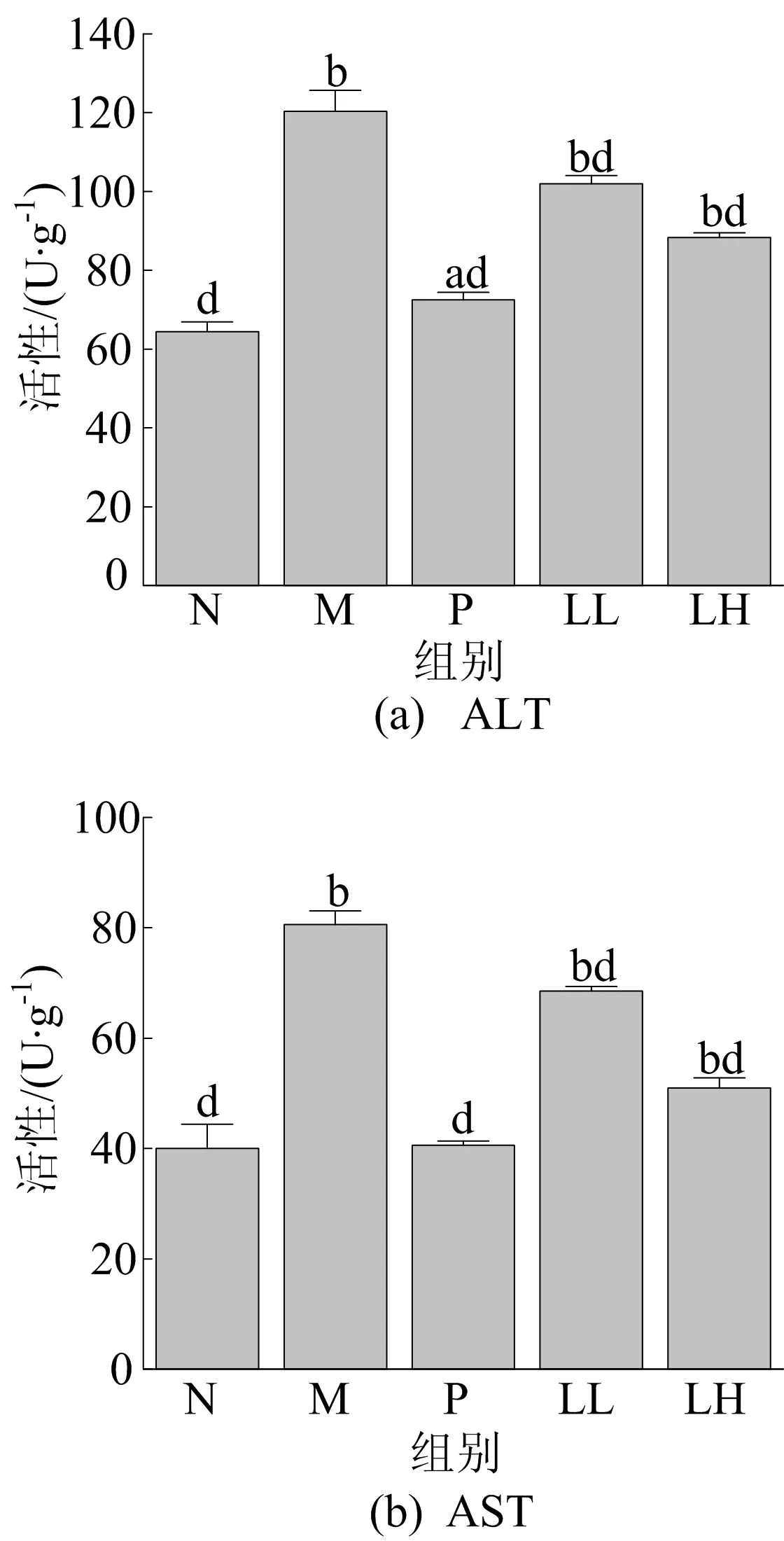
图2 LEP-1a对小鼠肝功能的影响
阳性治疗组与正常组相比几乎无显著差异(P>0.05),粒毛盘菌多糖预处理组(LL和LH) 以剂量依赖性方式逆转了模型(M)组血清ALT、AST和AKP活性的升高(P<0.05)。这种变化与文献[16]的研究结果相似,顺铂处理组中AST和ALT活性明显高于其他组。本研究中LEP-1a预处理可以减轻顺铂诱导的急性肝损伤,说明LEP-1a对肝脏具有保护作用。
2.4 LEP-1a对小鼠肝脏氧化应激的影响
在药物或化学诱导的肝毒性中,氧化应激常被认为是肝细胞损伤的原因。脂质过氧化的最终产物MDA是氧化损伤的标志物,同时,氧化应激也导致相关抗氧化酶活性降低,如SOD和CAT活性降低[17]。LEP-1a对顺铂诱导的小鼠肝脏脂质过氧化的影响见表2所列。由表2可知,与正常(N)组相比,顺铂诱导显著增加了MDA的量(P<0.01)。然而,所有LEP-1a预处理组均以剂量依赖性方式降低MDA的量(P<0.01)。此外,模型(M)组的SOD和CAT活性最低,经过LEP-1a预处理,SOD 和CAT活性显著升高(P<0.01)。结果表明LEP-1a能显著降低MDA的量,增强SOD和CAT活性,对顺铂诱导的氧化应激具有潜在的治疗作用。

表2 LEP-1a对小鼠体内氧化应激酶的影响
2.5 LEP-1a对小鼠血清炎症因子的影响
许多细胞因子(如TNF-α、IL-1β)在肝损伤中起着至关重要的作用[18]。为了研究LEP-1a预处理的潜在抗炎作用,测定TNF-α和IL-1β的表达水平。LEP-1a对小鼠血清TNF-α和IL-1β质量浓度的影响如图3所示。从图3可以看出:与正常(N)组相比,模型(M)组的血清TNF-α和IL-1β的质量浓度显著增加(P<0.01);相反,与模型(M)组相比,多糖组预处理组(LL和LH)的TNF-α和IL-1β质量浓度显著降低(P<0.01)。结果表明,LEP-1a对炎性因子TNF-α和IL-1β均有明显的抑制作用,能够调控顺铂引发的炎症反应、减轻炎症、抑制肝损伤,从而进一步达到保肝活性。

图3 LEP-1a对TNF-α和IL-1β质量浓度的影响
2.6 LEP-1a对小鼠肝脏组织病理学的影响
为了确定顺铂注射后对炎症性肝损伤的影响,通过HE染色对小鼠肝脏进行了组织学分析。LEP-1a对小鼠肝脏组织病理学的影响如图4所示。从图4可以看出:正常(N)组小鼠肝细胞排列整齐,结构清晰可见,且无明显病理现象;模型(M)组小鼠肝细胞增大,可见细胞破裂、坏死,存在严重的炎性细胞浸润现象,表明药物性肝损伤造模成功;与模型(M)组小鼠相比,多糖预处理组(LL和LH),小鼠肝脏病变明显缓解,炎性细胞浸润减轻,细胞轮廓清晰可见,肝损伤程度减轻。结果表明LEP-1a对顺铂诱导的急性肝损伤具有一定的缓解作用。
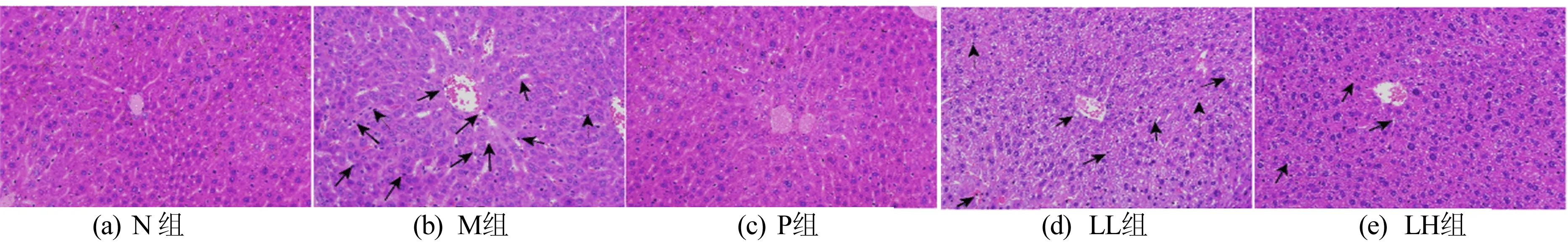
图4 LEP-1a对小鼠肝脏组织病理学形态的影响
图4中,黑色箭头表示肝细胞体积增大,炎性细胞浸润,细胞核收缩。
3 讨 论
本文从粒毛盘菌YM38发酵液中提取了天然多糖LEP-1a,并通过腹腔注射顺铂建立小鼠急性肝损伤模型,首次评估LEP-1a的保肝作用。众所周知,肝脏是脂肪形成和胆固醇代谢的中心器官[19]。因此肝脏中TG和TC的水平可以用作肝损伤的生化指标。白首乌花多糖能够明显降低小鼠TG和TC水平,对酒精性肝损伤小鼠肝脏脂质水平具有潜在抑制作用[20]。本研究中给予小鼠顺铂后,肝脏中TG和TC水平升高,LEP-1a预处理能够显著降低TG 和TC水平。已知AST、ALT和ALP是肝功能的重要标志物,而它们活性增加表明肝细胞坏死和细胞膜通透性障碍[21]。当少量肝细胞坏死时,肝细胞中的ALT、AST和AKP会释放到血清中,导致血清中相关含量急剧升高[22]。文献[23]研究发现灵芝(Ganodermaapplanatum)多糖预处理可显著降低血清AST、ALT、ALP水平从而减轻CCl4诱导的肝损伤。本研究表明顺铂给予引起模型组血清ALT、AST和AKP水平升高,而LEP-1a预处理组中ALT、AST和AKP水平均降低,说明LEP-1a 能够缓解顺铂所致的肝脏损伤。
顺铂可以在肝脏组织中大量积累,诱导氧化应激反应,氧化应激造成了抗氧化防御的不平衡,这也是造成急性肝损伤的部分原因[24]。MDA是脂质过氧化作用的最终产物,可以将超氧化物变成过氧化物[25]。SOD经常被用作细胞氧化状态的标志物,是抵抗氧化应激的重要因素[26]。SOD和 CAT作为生物体内最主要的酶促防御体系,能有效清除活力氧自由基[27]。研究表明,LEP-1a可通过增加SOD和CAT的活性以及降低肝脏中MDA的量来抑制炎症细胞向肝脏的浸润,并增强抗氧化活性。结果与灵芝多糖[28]、水溶性黑木耳根多糖[29]的研究结果一致,说明真菌多糖能有效预防小鼠药物性肝脏损伤。
顺铂诱导可增加肝组织中炎症介质和TNF-α[30]。TNF-α是一种内源性致热原,可以导致发热,引起细胞凋亡[31]。IL-1β作为重要的促炎因子,响应组织损伤而快速表达[21]。在本研究中,与模型组相比,LEP-1a预处理组能够显著抑制小鼠炎性因子TNF-α和IL-1β的表达,降低体外的炎症反应以及肝坏死的严重程度,与文献[32]结果一致。同时,肝脏组织病理学染色表明给予LEP-1a预处理后,炎性细胞浸润明显减少,无大量坏死肝细胞,且高剂量LEP-1a组比低剂量组治疗效果明显。因此本文研究表明,LEP-1a能够通过提高小鼠肝脏抗氧化能力和抑制肝脏炎症因子的产生抑制肝损伤,达到保护肝脏作用。

