4种品系小鼠角质形成细胞原代培养比较研究
关艳玲,章萍萍,陈 秀,蒋励萍,魏 伟,马 旸
皮肤是一个复杂的器官,由表皮、真皮和皮下脂肪组织构成[1-2]。表皮细胞主要由角质形成细胞(keratinocyte,KC)构成,从基底层到角质层,KC呈现不同的增殖、迁移和分化等新陈代谢过程[3]。因小鼠背部皮肤生理结构与人类皮肤相似,所以常被用于皮肤相关动物实验中[4]。原代KC提取方法主要包括:中性蛋白酶消化法、胰蛋白酶消化法、中性蛋白酶和胰蛋白酶联合消化法以及嗜热菌蛋白酶消化法[5-7]。 胰蛋白酶作用于基底层细胞和棘层细胞,作用强度大,经济有效且操作最为简单方便。选择哪种品系的小鼠提取原代KC最合适尚未有明确的研究,该研究选用4种品系的成年小鼠背部皮肤,使用胰蛋白酶消化法获取原代KC,比较其增殖和分化能力,为皮肤相关疾病模型小鼠的品系选择提供一定的实验依据。
1 材料与方法
1.1 实验动物8周龄BALB /c、C57BL/6、KM的雄性小鼠各5只,由安徽医科大学实验动物中心提供。5只8周龄雄性BALB /c遗传背景裸小鼠,由江苏集萃药康生物科技股份有限公司提供,生产许可证号:SCXK(苏)2018-0008,使用许可证号:SYXK(苏)2018-0027。
1.2 主要试剂胰蛋白酶消化液(含0.25%胰酶和0.02%EDTA)、青-链霉素抗菌溶液和BeyoClickTMEdU-488细胞增殖检测试剂盒(上海碧云天生物技术有限公司); 154完全培养基和生长因子(美国Gibco公司); DAPI 染色液及防荧光淬灭封片液(北京索莱宝生物公司);CCK-8(上海陶素生化公司);keratin 14(K14)抗体(美国 Proteintech 公司)。
1.3 主要仪器Infinite M1000 PRO 多功能酶标仪购自瑞士Tecan公司;Image Xpress Micro 4型高内涵细胞成像分析仪购自美国 Molecular Devcies 公司。
1.4 成年小鼠背部皮肤表皮与真皮分离8周龄BALB /c、C57BL/6、KM、裸小鼠,剔除小鼠背部毛发,脱毛膏涂抹3 min后去除,暴露皮肤组织,异氟烷吸入处死。器械经高压灭菌后使用,所用试剂无菌,全程无菌超净台中操作,避免细胞污染。剪取背部皮肤,修剪成约3 cm×3 cm正方形,表皮朝下,用无菌注射器针头固定在锡箔纸包裹的泡沫盒上,手术刀小心快速清理皮下脂肪组织和血管。75%乙醇清洗1次,含双抗的dPBS清洗3 次。表皮向上放置在25 cm2培养皿中,加入适量胰蛋白酶消化液,4 ℃消化20 h。
1.5 成年小鼠背部皮肤表皮KC分离与原代培养取消化后的皮肤至无菌超净台,手术刀剥离表皮细胞,转移表皮细胞至1.5 ml EP管中,加1 ml含2%血清的dPBS,剪碎后先后通过70、40 μm细胞过滤网,用2% dPBS重悬细胞至50 ml离心管中,同时用5 ml注射器软活塞研磨;1 800 r/min离心5 min,弃上清液,1 ml 154完全培养基缓缓吹打重悬细胞,移入1.5 ml EP管中,计数。接种于6孔板,48 h后换液,用倒置显微镜对培养的原代KC进行观察,并拍照记录。
1.6 原代KC鉴定4% 多聚甲醛固定30 min;加 0.1% TritonX-100通透5 min;5% BSA 封闭 30 min;加入抗体K14,4 ℃ 孵育过夜;加荧光二抗室温避光孵育1 h;DAPI 染细胞核,孵育5 min;正置显微镜观察细胞染色情况并拍照。
1.7 CCK-8法检测不同品系、不同种板密度原代KC活力原代KC以每孔不同梯度的细胞密度接种于96孔板。37 ℃、5% CO2培养箱中孵育,在不同时间加入CCK-8试剂与培养基1 ∶10的混合液,孵育3 h,酶标仪测量450 nm处的吸光度。
1.8 EdU法检测原代KC增殖原代KC以每孔3.2×104的密度接种于24孔板,培养5 d后,加入EdU工作液孵育2 h;4% 多聚甲醛固定30 min;0.3%Triton-X100通透15 min;加入Click反应液室温避光孵育30 min;Hoechst染核避光孵育10 min,显微镜下拍照。
1.9 高内涵细胞成像法检测测原代KC增殖原代KC以每孔8×103密度接种于96孔板,培养72 h后,弃培基加PBS洗涤细胞;4%多聚甲醛固定 30 min,加 DAPI 染核,孵育5 min; PBS洗涤后用高内涵细胞成像系统拍照,统计细胞总数。
1.10 Western blot法检测原代KC分化原代KC以每孔2×105密度接种于6孔板,培养48 h后换液,继续培养48 h;弃培基加入蛋白裂解液,冰上裂解30 min,转移至1.5 ml EP管中,加入5×上样缓冲液,金属浴煮蛋白8 min;进行蛋白免疫印迹检测表达情况。

2 结果
2.1 4种不同品系的成年小鼠背部皮肤KC原代分离培养的对比
2.1.1胰蛋白酶消化法对4种品系成年小鼠背部皮肤消化时间比较 胰酶消化法分离4种品系成年小鼠背部表皮和真皮时,消化时间影响分离效果。胰蛋白酶分别消化BALB/c、C57BL/6 、KM、裸小鼠4种品系小鼠背部皮肤16、14、18、16 h时,手术刀片轻刮,可见表皮与真皮之间的连接开始松散,部分表皮与真皮分离。随着消化时间的增长,达到最适消化时间,可完整剥离表皮,刮下一层致密排列的半透明状薄层细胞,此时细胞状态最佳。当4种品系小鼠背部皮肤消化时间分别超过24、22、26、24 h后,此时手术刀片可轻刮下一层柔软絮状无韧性细胞团,细胞存活率低。消化时间比较见表1。

表1 胰酶消化法对4种品系成年小鼠背部皮肤消化时间比较
2.1.2提取4种品系成年小鼠背部KC获得的数量对比 利用胰蛋白酶消化相同面积(3 cm×3 cm)的小鼠背部皮肤,经20~22 h消化后,过滤获得KC悬液,1 800 r/min离心5 min,1 ml 154完全培养基重悬可得原代KC。经计数可知C57BL/6小鼠来源的原代KC细胞数量最多,KM小鼠来源的原代KC细胞数量最少,消化获得BALB/c、C57BL/6、KM、裸小鼠原代KC的细胞个数分别为4.2×106、4.8×106、3.6×106、4.0×106个/ml。
2.1.34种品系成年小鼠背部KC形态学观察 提取的原代KC铺板48 h后,显微镜下可观察到3种形态的KC,包括悬浮的死亡细胞,半贴壁状态的圆形的KC,以及贴壁状态的鹅卵石样KC。原代培养8 d后,镜下可见多数鹅卵石样KC,少量椭圆、扁平状、中心有较大突出的细胞核,胞质面积大的处于分化后期的KC。见图1。
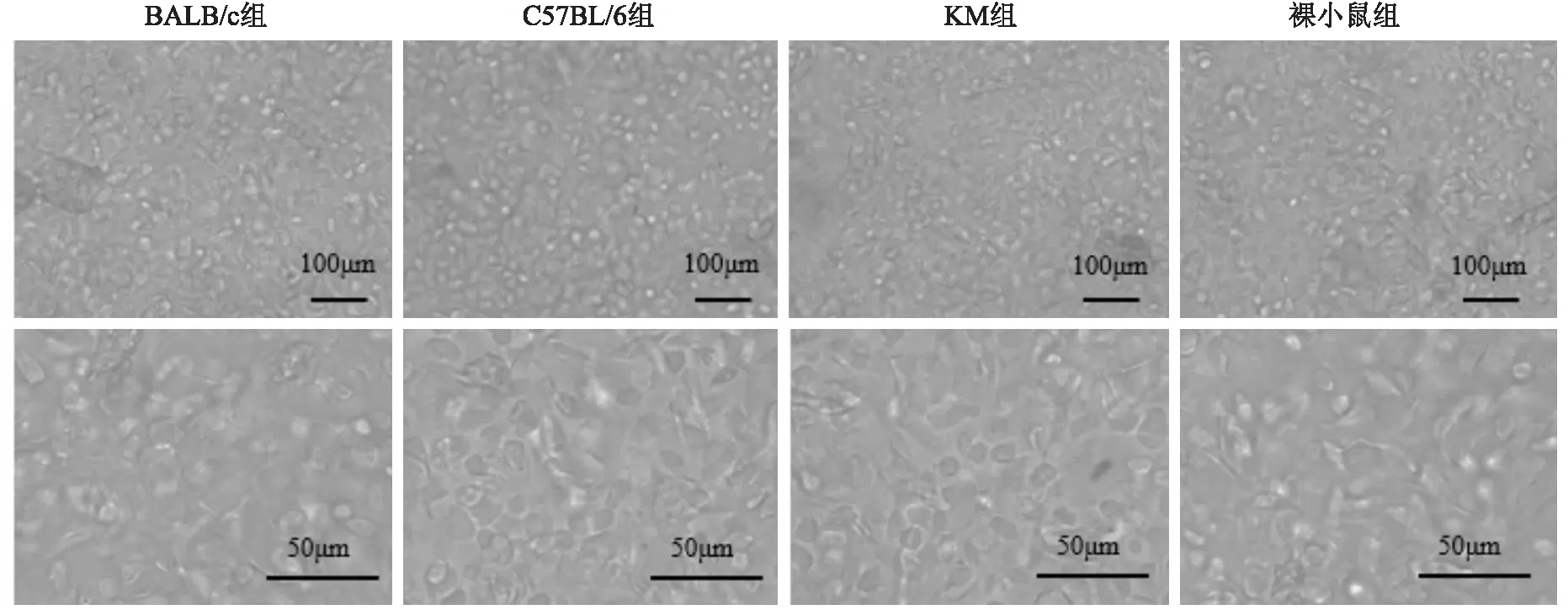
图1 4种品系成年小鼠原代KC生长状况
2.2 原代KC的免疫荧光鉴定分化蛋白K14是表皮基底层KC的阳性标志物。将提取的原代KC通过免疫荧光染色检测细胞K14表达情况,镜下可见胞质绿色荧光为阳染细胞,结果显示提取的细胞为基底层KC,符合KC特征,小鼠背部原代KC分离成功。见图2。

图2 免疫荧光检测原代KC中K14表达 ×200
2.3 4种品系原代KC最适宜接种密度的比较将提取的4种品系成年小鼠背部原代KC,以不同接种密度接种于96孔板。 CCK-8结果显示,BALB/c、KM、裸小鼠来源的原代KC以8×103个/孔的密度铺板增殖效率较高,而以1.6×104个/孔、3.2×104个/孔的密度铺板时,此时的增殖活力低于以8×103/孔的密度铺板的增殖活力,提示铺板细胞密度太大可能导致细胞出现接触抑制现象,使得细胞贴壁能力下降,细胞活力下降。C57BL/6来源的原代KC以1.6×104个/孔的密度铺板增殖效率较高,而以3.2×104个/孔的密度铺板时,此时的增殖活力稍低于以1.6×104个/孔的密度铺板的增殖活力(图3)。

图3 4种品系小鼠背部原代KC以不同密度铺板后增殖活力的变化
2.4 4种品系原代KC增殖能力比较
2.4.1CCK-8实验 原代KC以8×103/孔的密度铺板于96孔板,培养60 h后加CCK-8检测450 nm处的吸光度,实验结果见图4,比较可知C57BL/6来源的原代KC较其他3种品系小鼠来源的原代KC其增殖活力更加显著。

图4 CCK-8检测4种品系小鼠背部原代KC增殖能力统计图
2.4.2EdU实验 显微镜下观察统计,绿色与蓝色荧光重合的即为EdU阳性细胞。随机选取 5个高倍视野,Image J和GraphPad Prism软件统计EdU阳性细胞的百分率。EdU法测细胞增殖实验结果显示,在培养第5天时,C57BL/6来源的原代KC,其EdU阳性细胞率高于BALB/c、KM、裸小鼠来源的原代KC。见图5。

图5 EdU法测4种品系小鼠背部原代KC增殖能力
2.4.3高内涵实验 高内涵细胞成像法检测原代KC增殖能力,利用高内涵细胞成像软件分析系统,统计每孔细胞总数,通过比较细胞数量分析细胞增殖能力。结果如图6所示,C57BL/6原代KC的增殖能力大于BALB/c原代KC(P<0.05),与EdU法结果一致,KM和裸小鼠原代KC的增殖能力处于C57BL/6和BALB/c之间。

图6 高内涵检测4种品系小鼠背部原代KC增殖能力
2.5 4种品系成年小鼠背部皮肤原代KC分化程度比较KC是构成表皮的主要细胞成分,在体内处于不断增殖过程中,分裂的角化细胞主要位于其基底层,少数位于棘层。随着向表层的推移,细胞的分化程度逐渐增加,并丧失分裂活性。Western blot检测分化特异性角蛋白K1表达情况,结果显示4种品系小鼠K1表达差异无统计学意义,说明提取的原代KC分化程度差异无统计学意义。见图7。

图7 4种品系小鼠背部原代KC角蛋白K1表达情况
3 讨论
KC过度增殖和角化异常是银屑病的病理表现[8],创面愈合和皮肤屏障[9-10]也与KC密切相关,所以原代KC的提取和培养的实验技术是研究临床皮肤相关疾病的基础实验。KC是表皮的主要细胞类型,其特点是在体外分裂率低,20世纪70年代以来,国内外学者经过多年的研究和探索,为解决原代KC体外增殖能力弱这一问题,不断改进和优化提取及维持培养条件,包括小鼠周龄、皮肤部位、消化酶、培养基、生长因子的优化等[11-13],现在已经取得了很大进展。
小鼠周龄、皮肤部位、品系都会影响小鼠原代KC提取效率。新生小鼠皮肤提取的细胞产量高,表皮毛囊形成早期数量少,表皮和真皮分离难度较小,现已有较为完善的提取方式[5-6]。成年小鼠毛发呈周期性生长,分为生长期,衰退期,静止期,选择静止期小鼠(通常是6~12周龄)最佳;成年小鼠背部皮肤很薄,表皮只有1~2层KC,提取产量较低,而且毛囊密度较高表皮真皮分离困难;尾部皮肤KC有3~5层,毛囊密度低,表真皮分离易。由此可见,相比于新生小鼠,成年小鼠原代KC的分离和培养难度更大,但就长远的研究来看,克服成年小鼠原代KC分离培养的难题更具有意义。
该研究选择了Lichti et al[6]研究的成年小鼠背部皮肤提取方法,采用低钙无血清培养基,胰蛋白酶消化法(含EDTA)提取原代KC,EDTA不仅能破坏细胞间连接促进细胞解离,也能减少胰蛋白酶对细胞的损伤。该实验主要研究常用的4种小鼠品系在该提取条件下,对原代KC的增殖和分化能力是否有影响。选用常用的几种小鼠品系,BALB/c,C57BL/6,KM和裸小鼠,比较了成年小鼠背部提取原代KC的增殖、分化能力,结果显示与C57BL/6小鼠比较,BALB/c小鼠原代KC增殖活力较低,这一结果提示,在BALB/c和C57BL/6中选择研究原代细胞的相互作用时,C57BL/6是较好的品系选择。此外,在原代KC提取过程中,该研究表明需要使用未反复冻融的胰蛋白酶,否则消化效果会变差,此外皮肤组织包含表皮、真皮以及皮下脂肪组织,分离表皮和真皮前需要把皮下脂肪组织清理干净,这直接影响到表皮真皮分离时间和效果,比如KM小鼠皮肤皮下脂肪组织较其他3种品系的厚,完全去除困难,需要延长表皮真皮消化时间,该实验探究了不同品系小鼠的最佳消化时间,为不同品系小鼠原代KC提取时间的选择提供一定实验依据,调整实验细节从而获取高活力的原代细胞。在原代KC培养过程中,该研究表明细胞增殖能力和接种细胞密度有关:细胞密度太低,单个细胞增殖速度缓慢,后期细胞无法增长死亡;细胞密度过高,细胞贴壁效率低增值能力低,加快细胞死亡速度。4种成年小鼠背部原代KC铺板时都存在高密度铺板增殖抑制甚至不增殖,低密度铺板增殖抑制的现象,所以适宜的铺板密度会增加细胞存活率,优化铺板密度提高存活率。
综上所述,比较4种品系成年小鼠的增殖和分化能力,有助于为相关皮肤疾病提供技术基础,为提取原代KC的小鼠的品系选择提供实验依据。

