新生儿低血糖导致的脑损伤的风险因素及影像学特征分析
尚小姣 贾耀丽
1.叶县人民医院NICU (河南 平顶山 467200)
2.平顶山市第一人民医院新生儿重症监护病房 (河南 平顶山 467200)
新生儿低血糖是临床常见的代谢性疾病,具有发病率高、病因多等特点,患儿体内葡萄糖生成和消耗失衡,导致脑组织能量缺乏,易并发脑损伤[1]。低血糖脑损伤的风险因素较多,开展深入分析和探讨,有利于防治工作顺利进行。由于该病的症状表现不明显,临床上多采用影像学检查的方式对患儿进行诊断,磁共振成像(MRI)具有较高的软组织分辨率,且无辐射危害,能够反映患儿脑损伤情况,分析相关影像学特征,可帮助医生更准确地诊断疾病[2-3]。本研究通过对154例低血糖新生儿进行回顾性分析,旨在探讨新生儿低血糖导致的脑损伤的风险因素及影像学特征,详情如下。
1 资料与方法
1.1 一般资料回顾性分析2020年8月至2021年7月我院收治的154例低血糖新生儿的临床资料,均符合《美国新生儿低血糖管理指南》[4]中的诊断标准,其中男性83例,女性71例,胎龄32~41个月,平均胎龄(37.52±2.37)个月,分娩方式:顺产131例,剖宫产23例。
1.2 研究方法
1.2.1MRI检查 使用飞利浦1.5T磁共振扫描仪对患儿进行检查,设置参数为:层间隔2.0mm,厚度4.0mm,矩阵256×192~512×512,视野220×220cm,磁共振扩散加权成像(DWI)、经T1加权像(T1WI)、矢状面T2加权像(T2WI)任一异常则视为脑损伤。
1.2.2 资料收集 收集患儿性别、胎龄、分娩方式、有无围产期缺氧、有无喂养困难、有无惊厥、有无脑电图(EEG)异常、母亲是否合并妊娠糖尿病、低血糖持续时间等。
1.2.3 血清指标检查 抽取患儿晨起空腹静脉血3mL,离心半径10cm,离心速度3000r/min,离心时间10min,分离血清,使用酶联免疫吸附法检测脑红蛋白(NGB)、神经元特异性烯醇化酶(NSE)水平。
1.3 统计学方法采用SPSS 25.0统计学软件,计量资料用(±s)描述,组间比较行t检验,计数资料用[n(%)]描述,组间比较行χ2检验,影响因素采用单因素与Logistic多因素回归分析,P<0.05说明差异有统计学意义。
2 结 果
2.1 新生儿低血糖导致的脑损伤的单因素分析154例低血糖新生儿中,共27例发生脑损伤,发病率为17.53%。两组性别、分娩方式比较差异无统计学意义(P>0.05);与未发生组比较,发生组早产、围产期缺氧、喂养困难、惊厥、EEG异常、母亲合并妊娠糖尿病、低血糖持续时间>24h、NGB水平≥150mg/L、NSE水平≥50μg/L的患儿占比均更高(P<0.05),见表1。
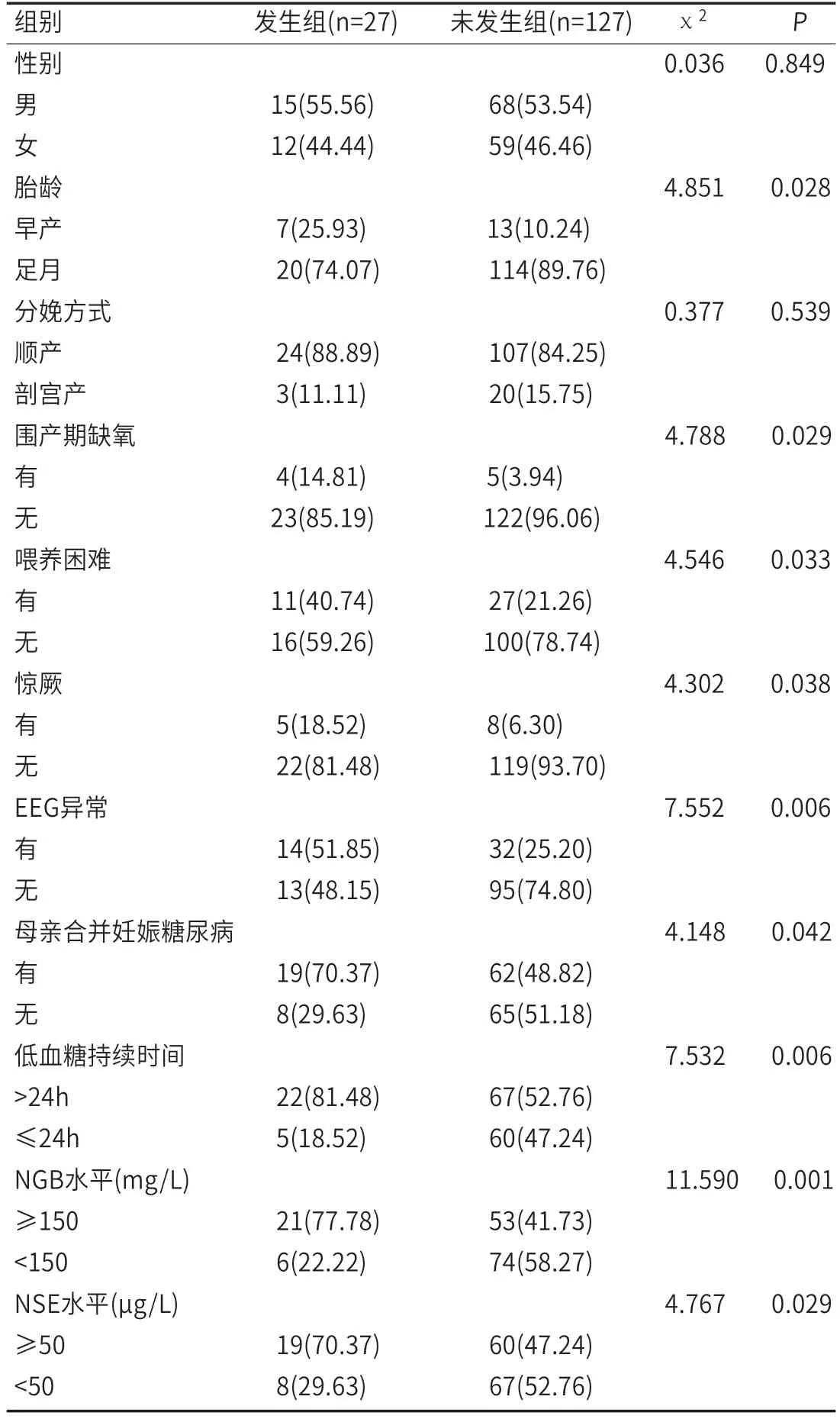
表1 新生儿低血糖导致的脑损伤的单因素分析
2.2 新生儿低血糖导致的脑损伤的Logistic多因素回归分析以单因素分析存在统计学差异的因素作为自变量,以低血糖脑损伤作为因变量,分别进行赋值,见表2。建立Logistic多因素回归模型,发现胎龄(OR=1.902)、围产期缺氧(OR=1.781)、喂养困难(OR=2.395)、惊厥(OR=12.366)、EEG异常(OR=15.251)、母亲合并妊娠糖尿病(OR=8.793)、低血糖持续时间(OR=8.156)、NGB水平(OR=2.935)、NSE水平(OR=2.411)是影响低血糖脑损伤发生的独立危险因素(P<0.05),见表3。
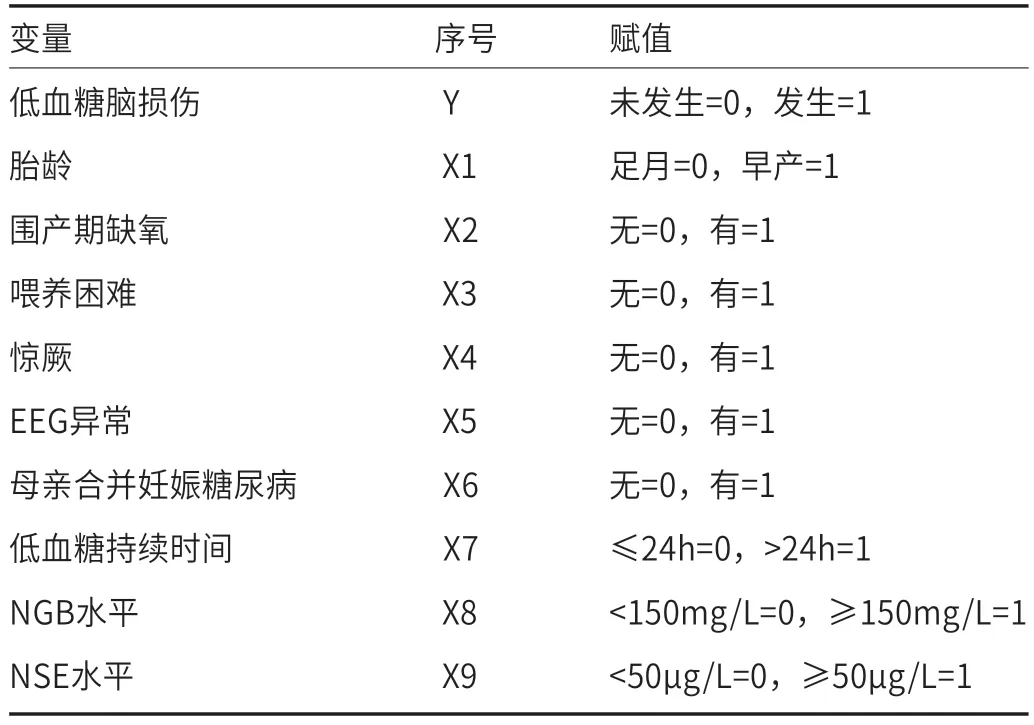
表2 变量赋值表
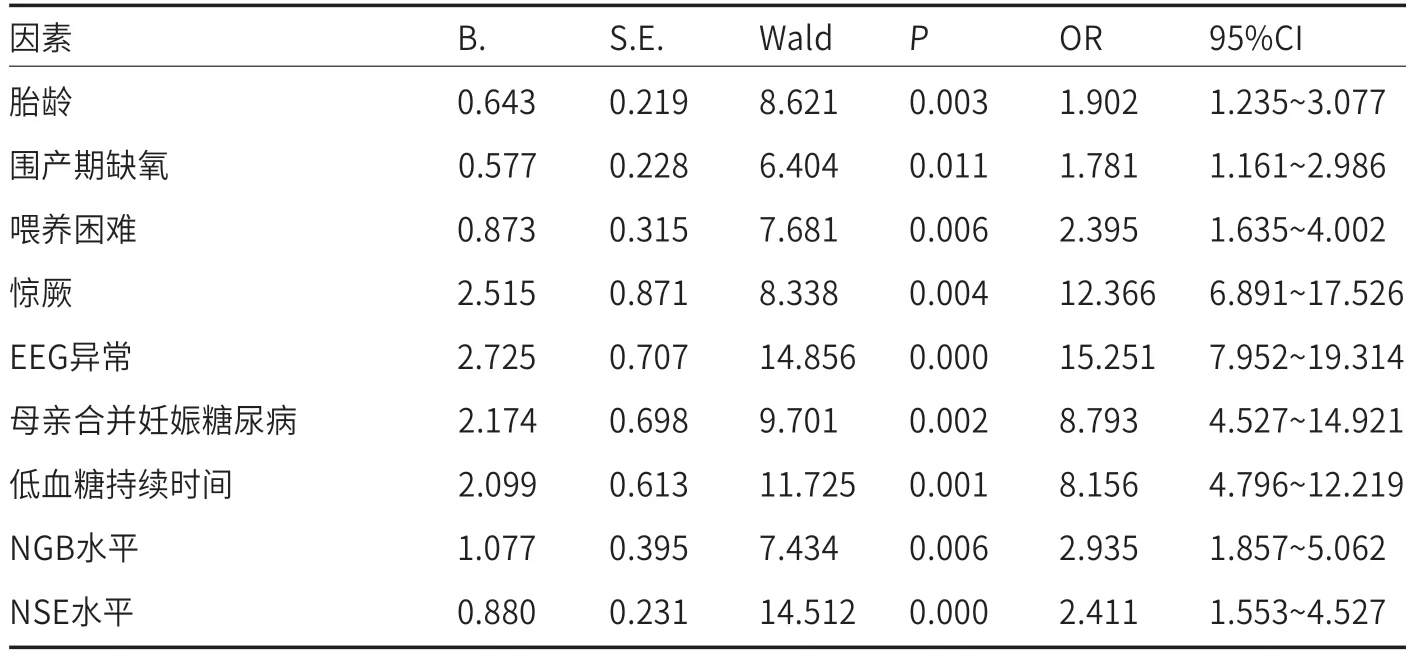
表3 新生儿低血糖导致的脑损伤的Logistic多因素回归分析
2.3 新生儿低血糖导致的脑损伤的影像学特征分析27例低血糖脑损伤患儿均存在顶枕部头皮层受累,DWI均表现为高信号,其中14例(51.85%)患儿T1WI、T2WI均正常信号,2例(7.41%)T1WI正常信号、T2WI高信号,2例(7.41%)T1WI低信号、T2WI正常信号,9例(33.33%)。T1WI低信号、T2WI高信号。
3 讨 论
新生儿低血糖脑损伤作为一种由低血糖引起的并发症,不仅会影响中枢神经发育,还可能造成严重的神经系统后遗症,对患儿未来的生活、学习造成不利影响[5-6]。随着影像学技术的发展,MRI、EEG等方法逐渐被应用到低血糖脑损伤诊断中,早期诊断有助于医生尽早开展治疗,预防后遗症的出现[7]。
通过Logistic多因素回归分析结果发现,影响低血糖脑损伤发病率的独立危险因素较多,主要包括:(1)胎龄(OR=1.902):早产儿在子宫内的发育时间更短,体内肝糖原储备较少,且早产儿的糖原形成和分解能力差、生活能力不足,更易发生低血糖脑损伤[8]。(2)围产期缺氧(OR=1.781):围产期缺氧会导致葡萄糖无氧酵解,无法被身体组织正常吸收,同时全身组织受到缺氧影响,能量消耗增加,使得低血糖脑损伤风险升高[9]。(3)喂养困难(OR=2.395):存在喂养困难的新生儿饮食量不足,无法从食物中摄取足够能量,更易发生低血糖脑损伤。(4)惊厥(OR=12.366):若新生儿发生惊厥,可导致肌肉阵挛,增加对葡萄糖的消耗,且惊厥会影响脑组织正常代谢,继而诱发或加重低血糖脑损伤。(5)EEG异常(OR=15.251):EEG能够客观反映神经细胞功能状态,EEG异常则提示神经细胞受损,需要考虑患儿是否存在低血糖脑损伤[10]。(6)母亲合并妊娠糖尿病(OR=8.793):母亲合并妊娠糖尿病会导致新生儿体内胰岛素水平偏高,难以维持正常血糖水平,母体高血糖可造成胎儿慢性缺氧和能源储备不足,加之新生儿出生后母体葡萄糖供应中断,使得低血糖脑损伤的发生风险进一步升高[11-12]。(7)低血糖持续时间(OR=8.156):低血糖会导致新生儿脑细胞对能量的摄取减少,无法维持正常生理活动,进而诱发脑损伤,低血糖维持的时间越长,新生儿发生脑损伤的风险越大[13]。(8)NGB水平(OR=2.935):NGB主要存在于脑组织内,当新生儿脑组织受损后,细胞膜稳定性下降,NGB大量进入血液循环,导致血清NGB水平升高,因此,若新生儿NGB水平异常,需要考虑低血糖脑损伤[14]。(9)NSE水平(OR=2.411):NSE主要存在于脑神经元、神经内分泌细胞中,脑损伤可导致NSE释放入血,进而出现水平升高,可将其作为低血糖脑损伤的风险因素之一[15]。
本研究结果中,27例低血糖脑损伤患儿均存在顶枕部头皮层受累,DWI均表现为高信号,其中14例患儿T1WI、T2WI均正常信号(51.85%),2例T1WI正常信号、T2WI高信号(7.41%),2例T1WI低信号、T2WI正常信号(7.41%),9例T1WI低信号、T2WI高信号(33.33%)。究其原因,低血糖脑损伤患儿脑组织能量供应不足,脑细胞出现损伤、水肿,脑组织水分子运动随即发生变化,导致MRI信号表现异常,而顶枕部头皮层的神经元和突触较多,对葡萄糖需求更大,因而此处的信号异常最为明显[16-17]。
综上所述,胎龄、围产期缺氧、喂养困难、惊厥、EEG异常、母亲合并妊娠糖尿病、低血糖持续时间、NGB、NSE水平等均与新生儿低血糖导致的脑损伤存在密切关系,其主要影像学特征为顶枕部头皮层DWI和T1WI、T2WI信号异常,临床需要及时采取针对性措施,以减少新生儿脑损伤的发生。

