ERECTA基因家族调控植物形态发育机制研究进展
赵雪雅,张坤鹏,张汇东,毕梦希,齐明芳
(沈阳农业大学现代设施园艺工程技术中心/北方园艺设施设计与应用技术国家地方联合工程研究中心/设施园艺教育部重点实验室/农业农村部园艺作物农业装备重点实验室,沈阳 110161)
ERECTA(ER)编码一个富含亮氨酸重复片段(Leucine-rich repeats,LRR)的类受体激酶(receptor like protein kinases,RLK),与其他RLKs相似,ER在细胞的信号转导过程中十分重要。ER突变体(er)在20世纪50年代首次在拟南芥中被分离出来,该突变体是通过X 射线辐射Landsberg种子产生的,该突变体因此被称为Landsberg erecta(Ler)[1],er突变体表现为株型矮化,节间缩短,花序紧凑,这种株型大大提高了空间利用率,因此在拟南芥的研究中被作为“野生型”广泛使用。ER参与调控植物生长发育的许多方面,如种子大小[2]、茎的伸长、花序形态[3-6]、叶片起始发育、角果长度等。另外,ER在植物逆境胁迫等方面的作用也逐渐被人们重视,例如病原体反应[7-9]、蒸腾效率[10]、植物的荫蔽反应[11-12]、耐旱性[13-14]、耐热性[15-16]等。
ER作为植物感知外界信号的类受体激酶参与调控多条信号通路,本研究简要介绍ER的蛋白结构、调控机制,以及在植物形态发生方面的调控作用,包括气孔形成、成花和花序结构、植物高度以及茎尖分生组织大小和叶原基启动等方面,为揭示ER在植物信号传递中分子机制提供重要参考。
1 ER蛋白结构与调控机制
ER基因编码一种受体样激酶(图1),由一个细胞外富含亮氨酸重复序列(LRR)结构域、一个跨膜结构域和一个胞质激酶结构域组成[17]。在被子植物中,ER家族由两个或多个基因组成。拟南芥中ER有2 个同源基因,ERL1和ERL2,这3 个基因组成ER基因家族(ERfs),在许多发育过程中存在功能冗余。
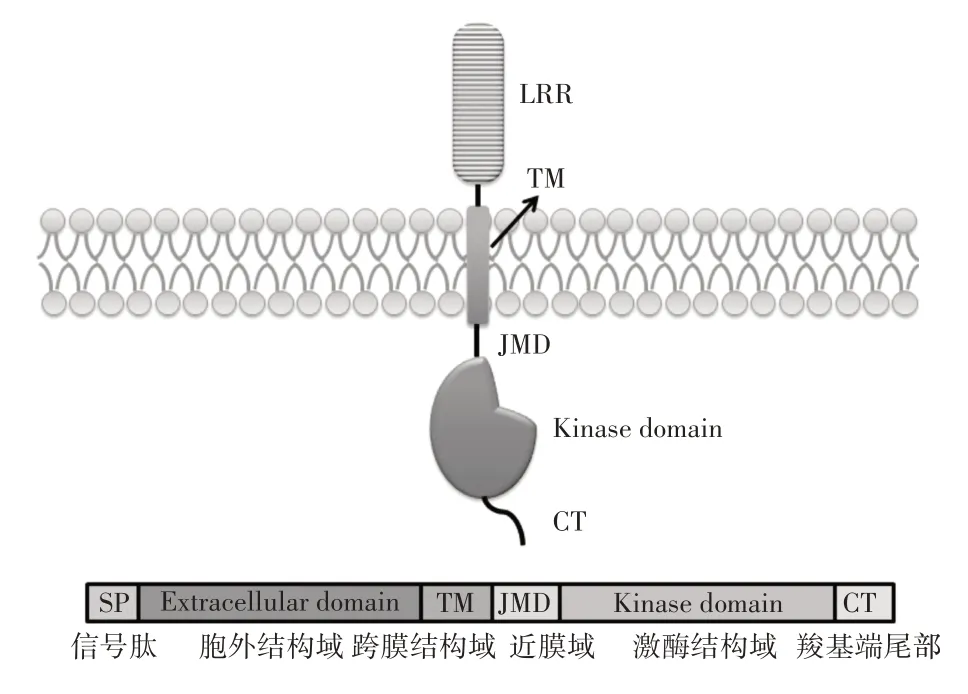
图1 ERECTA蛋白结构Figure 1 ERECTA protein structure
ER基因有27个外显子和26个内含子,不同物种中的ER 蛋白激酶结构域是相对保守的,而跨膜和胞外结构域保守程度较低[18]。ER 蛋白在细胞的信号转导过程中十分重要。当LRR 结构域识别到胞外配体时,跨膜结构将把信号传递到细胞内,同时胞外结构域能够与配体结合形成一种二聚体或多聚体,激活胞内带有磷酸化位点的激酶结构域发生磷酸化或去磷酸化反应。在激酶结构域与跨膜结构域之间还存在一段近膜结构域(Juxtamembrane domain,JMD),激酶的另一端存在一个羧基端尾部(C-terminal Tail,CT),激酶结构域的活性通常受JMD和CT这两个侧翼区域调节[19]。已有研究证明JMD 对ER 功能非常重要,CT 作用则小于激酶域和JMD,JMD 残基的磷酸化和去磷酸化通常调节RLK 的活性,影响它们的酶功能或它们与下游靶标相互作用的能力[20],但JMD的关键磷酸化位点仍未明确。四个磷酸化位点Thr807、Thr812、Tyr815和Tyr820是激酶结构域功能的关键,Thr807和Thr812对ER功能具有积极作用,而Tyr815和Tyr820两个位点的磷酸化则具有抑制作用[18]。这意味着ER的信号转导在不同调控途径中是不同的,这也解释了为什么不同的ER突变体表型差异较大。
由于ER 包含一个胞外的LRR 结构域,可以预期存在可与LRR 结构域结合的配体,并且活化的ER 蛋白会反过来触发下游信号传导。已有报道证明ER、ERL1 和ERL2 可以形成同源二聚体和异源二聚体[21]。ER 的活性则受分泌型小肽EPF/EPFL 家族的调节,拟南芥中的EPF/EPFL 家族包含11 个成员,参与ER 调控发育的过程[3]。他们还可以与SERKs(SOMATIC EMBRYOGENESIS RECEPTOR KINASEs) 和TMM(TOO MANY MOUTHS)形成复合物[21-22]。在ER下游发挥作用的是YODA、MKK4、MKK5、MPK3和MPK6组成的MAPK激酶级联反应[5,23]。这些配体与MAPK激酶级联在不同时期和不同组织中发挥作用使ER得以调控生长发育的许多过程。
2 ER信号通路在气孔形成中的作用
植物叶片气孔的正常发育离不开ERfs的调控,这一过程中ER与其同源基因ERL1和ERL2存在功能冗余。气孔发育遵循特征性的细胞分裂顺序,ER在气孔发育中功能及作用机制的研究最为深入,其作用机制如图2。气孔在发育的过程中,两个气孔之间至少被一个表皮细胞分隔开来,称为“一个细胞间隔”原则[24]。这种原则对于细胞之间信息传递、细胞分化、产生特定的气孔形态具有重要的作用。
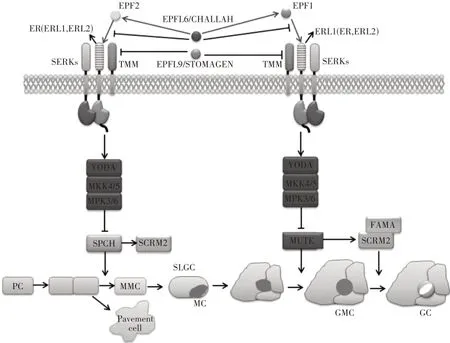
图2 ERECTA调控气孔发育模式图Figure 2 Pattern diagram of ERECTA regulates stomatal development
在拟南芥中,一部分表皮原细胞(protoderm cell)形成了拟分生组织母细胞(meristemoid mother cells,MMC),之后MMC 不对称分裂,产生两个具有不同特征的子细胞:一个拟分生组织细胞(meristemoid)和一个气孔系基础细胞(stomatal lineage ground cells,SLGC),这一过程由转录因子SPCH(speechless)调控[25]。拟分生组织细胞反复经历不对称分裂以进行自我更新和扩张。当拟分生组织继续分化时,细胞形状从三角形变形为圆形,其特征变为保护母细胞(guard mother cell,GMC),这一过程受转录因子MUTE 调控,抑制拟分生组织细胞分化同时驱动细胞转向GMC[26]。最后,GMC进行对称分裂形成一对保卫细胞(guard cell,GC)从而形成气孔,FAMA 可终止前体细胞继续增殖并促使保卫细胞母细胞对称分裂形成保卫细胞,MUTE 部分通过直接调节细胞周期蛋白CYCD5;1基因和其转录抑制因子FAMA的表达来确保GMC 对称分裂形成GC[27]。而SLGC则分化为扁平细胞。
在这些过程中,ERfs负向调控细胞分化为MMC,且ER、ERL1和ERL2存在功能冗余,ER起其主要作用,因为对比er、erl1和erl2的突变体,仅在er突变体中观察到不对称细胞分裂数量增加。在erl1 erl2突变体中,分生组织过早分化为GMC,这说明ERL1和ERL2在之后对于维持分生组织的增殖潜能、防止它们分化为保卫母细胞中的过程中很重要[28]。除了抑制细胞分化转变外,这3 种受体对于MMC 和SLGC 中不对称细胞分裂的方向也很重要,确保气孔不会彼此相邻形成。3种ERfs似乎在细胞极性的调节中起冗余作用,因为仅在三重突变体er erl1 erl2中观察到气孔簇的形成[28]。
ERfs的配体EPF1和EPF2已被证明与ERfs在蛋白水平有直接相互作用,EPF1和EPF2在表皮中表达,根据突变体和过表达系的表型证明它们可以激活ERfs。EPF2在早期表皮发育过程中表达,它会抑制MMC 的分化[29]。EPF1在分生组织、GMC 和年轻保卫细胞中的表达更晚一些,EPF1抑制分生组织向GMC 的分化并引导不对称细胞分裂。EPF1和EPF2在气孔发育中的不同作用并不能归因于他们不同的表达时间和表达模式,因为启动子交换试验表明这些配体在功能上是不同的[27,30]。从早期气孔系细胞(MMC 和分生组织)分泌的EPF2肽被邻近原皮细胞中由ER、TMM 和SERK 组成的受体复合体感知,从而抑制原皮细胞转化为MMC,ERL1 和ERL2 也作为次要但重要的因素参与此步骤,与ER 一起发挥冗余作用。叶肉细胞分泌的EPFL9/STOMAGEN与ERfs 竞争性结合EPF2,从而阻断EPF2 信号传导。EPF2 受体复合物激活的MAPK 级联反应模块使SPCH 蛋白不稳定,阻止细胞分化为MMC[31]。后期气孔系细胞(晚期分生组织和GMC)分泌的EPF1 被邻近分生组织中由ERL1、TMM 和SERK 组成的受体复合体感知,确保了分生组织不会在现有气孔旁边产生气孔。ER 和ERL2也作为次要但重要的因素参与此步骤,与ERL1 一起发挥冗余作用。EPFL9/STOMAGEN 竞争性结合EPF1,使EPF1无法激活ERfs。EPFL6/CHALLAH(CHAL)也属于EPFs家族,是TMM 的抑制子。尽管对拟南芥中ER调控气孔形成的信号通路研究已比较深入,但在其他物种中,这一机制还未完全明确,例如TMM 和SERK 在这一过程中,与ERfs以共受体的形式发挥作用,且对于气孔正确的分化是十分重要的,但这2 个基因在许多物种中并没有同源基因,还有待进一步的研究。
3 ER调控花形态和花序结构
开花植物的花序结构差异很大,对植物繁殖成功率和作物产量有很大影响。ERfs除了在气孔发育中的作用外,对于植物形态发生也十分重要。对ER突变体的分析中可以明显看出,ERfs参与地上器官顶端-基部和近端轴的生长调节。由于节间和花柄的伸长减少,er突变导致矮化和花序紧凑[17]。
ER可以调控花器官的形态,功能丧失型突变体clv3-2有4 个心皮,而er clv3-2双突变体和er clv3-2 jba-1d-/+三突变体分别有5 个和8 个心皮。这表明ER、CLV3和HD-III ZIP通路参与心皮形成,但尚不清楚这些通路是如何互相作用的[32-33]。大多数花器官是从变态的叶发育而来的,ER可以通过控制花瓣细胞增殖来调节花瓣的形状和大小,有研究者推测ER可能是控制不同植物花器官形态差异的主要因素。ERfs对雄蕊发育的影响是广泛的,鉴于er erl1 erl2花中的雄蕊数量显着减少,表明它们的启动必须需要ERfs参与[4]。
已有研究证明,EPFL4,也称为CHALLAH-LIKE2(CLL2),和EPFL6 通过与ER 结合冗余调节花序生长,因为epfl4 epfl6双突变体显示出与er突变体几乎一致紧凑花序[3,34]。此外,由YDA、MKK4/5和MPK3/6组成的MAPK激酶级联在花序调节和气孔模式中充当ER的下游信号[5],表明与调控气孔的形成类似,在调控花序形成的过程中信号传递需要相同的模块。而与调控气孔形成的过程不同的是,EPF1/2和EPFL4/6对TMM的依赖不同:EPF1/2 需要TMM 来激活ERfs,而EPFL4/6 不需要[34]。EPFL4/6的鉴定及其表达模式的分析发现这是一种促进花序生长的新型细胞间通讯,在发育的花序茎中,EPFL4/6在内皮层中特异性表达,另一方面,在韧皮部和木质部组织以及茎的表皮中检测到ER表达。此前的研究证实了在er突变体中,特异性地在木质部和表皮表达ER均未挽救er的花序表型,而在韧皮部特异性表达ER则可以挽救短花柄表型,表明了韧皮部ER 活性是调控花序结构的关键。这些结果表明从内皮分泌的EPFL4/6被韧皮部细胞中的ER感知,并且韧皮部细胞中激活的ER信号促进花序组织的生长。
ER与染色质重塑复合物SWR1 在花序结构控制中具有相互作用,SWR1 通过促进PACLOBUTRAZOL RESISTANCE(PRE)基因家族的表达与ER 协同调节花序结构。研究发现SWR1是将H2A.Z组蛋白变体掺入整个PRE1基因家族的核小体所必需的,而ER 通过调节核小体动力学来控制PRE1基因家族的表达[35-36]。HOMOLOG OF BEE2 INTERACTING WITH IBH1(HBI1)位于PRE的下游调控花柄伸长,pre突变体中HBI1表达量显著降低,PRE 可以激活HBI1的表达。而HBI1与油菜素类固醇(BR)生物合成基因CYP85A2和一系列生长素相关基因AUXIN RESPONSE FACTOR 3(ARF3)的启动子结合,并促进它们的表达。反过来,ARF3也可以与生长素信号基因以及CYP85A2结合以激活它们的表达并促进花梗伸长[36]。SWR1 与ER-MAPK 协同促进PRE基因表达,SWR1-PRE-HBI1 模块位于ER-MAPK 模块的下游以调节花梗伸长,而BR 和生长素信号由SWR1-PREHBI1模块控制。然而,MAPK 级联如何调控PRE还仍然未知,这一过程中是否还存在其他的配体以及ER的共受体一同调控花序结构也还有待研究。
4 ER信号通路调控植物茎的发育
ER在韧皮部的表达可以调控植株高度,相比ERfs的其他基因,ER对植物株高的影响最为明显,以ER突变为遗传资源也逐渐应用在作物的矮化育种中。
节间缩短是ER突变体最明显的表型之一,对多种ER突变体的分析表明ER在大部分生长期促进器官伸长,但它不会改变总的生长期。虽然erl1和erl2突变本身不影响植物形态发生,但在er突变体中,它们增强了茎的伸长缺陷,er erl1 erl2突变体表型最强,是重度矮化[4]。ER调控植物茎的伸长也受EPF/EPFL 的调节,内皮层表达的EPFL4/6 可被ER 和ERL1 感知,以保持原形成层和茎的伸长。然而,虽然有功能的配体,但调节植株高度却与调控气孔发育并不是相同的机制和信号通路,SPCH和MUTE均未在内部组织中以显著水平表达,在TMM 的突变体中可以明显观察到气孔数量和气孔发育的差异,但株高却没有明显变化,这也表明,MAPK 级联作为ER 的下游在不同调控通路中识别的底物可能是不同的。通过不同的启动子连接ER使之特异性的在不同部位表达,结果表明了ER在表皮和木质部的表达都无法挽救er矮化和花柄紧凑的表型,只有在韧皮部的表达可以使之恢复株高和花序结构[3]。
通常植株高度的调控多与植物激素有关,ER也参与了多种激素的调控,例如生长素,细胞分裂素,油菜素内酯以及赤霉素。在以往的报道中,ER信号通路可以影响生长素合成和信号基因的表达,上文中我们提到HBI1作为ER-MAKP 模块的下游可以与BR 合成基因CYP85A2的启动子和生长素信号相关基因ARF3结合,以促进它们的表达并调节花柄伸长,由于ER调控株高和花柄都是在韧皮部表达,因此ARF3也被认为是ER下游通过调控生长素而调控株高的靶基因。而在更早的研究中,就发现了过表达YUCCA5可以挽救er的矮化表型,而er突变体并不会影响内源性生长素含量,但可以响应YUCCA5导致的生长素水平升高,暗示了YUCCA5可能在ER的下游起作用调节茎的伸长[37]。而通过甜瓜中的ER突变体则发现ER 可以直接与生长素转运蛋白PIN2结合,而突变后的蛋白则不能,这一结果则表明,ER可能通过PIN调节生长素的运输而控制株高[38]。
也有研究报道了ER与赤霉素信号通路基因SHI和SPY存在某种调控关系,er突变增强了GA 不敏感突变体shi的短茎表型[39],GA负调节因子SPINDLY(SPY)突变体的高表型被er抑制[40]。而最近的研究表明赤霉素通过DELLA 蛋白与KNOX 转录因子家族的KNAT1/BREVIPEDICELLUS(BP)相互作用调节木质部纤维分化[41],在茎的伸长和增粗都有一定作用,DELLA 可以削弱KNAT1/BP 对结合目标基因顺式元件的能力从而损害对目标基因启动子的识别,进而负调控KNAT1/BP 的下游基因[41]。BP 正向调控NAC SECONDARY WALL THICKENING PROMOTING FACTOR 1(NST1)和NST3的表达从而调控木质部纤维分化[42]。LRR-RLK EVERSHED(EVR),也称为SUPPRESSOR OF BIR-1(SOBIR1)通过防止早熟的木质部纤维形成来调节次生生长,KNAT1/BP 对SOBIR1/EVR表达具有负调节作用,SOBIR1/EVR与ER都是次生生长中重要的调节基因,他们在蛋白水平直接互作[43],但同时沉默2 个基因的表型要远远强于单突变体的表型,这表明他们并不是简单的上下游关系,而是协同调控木质部的分化。然而,SOBIR1/EVR与ER是如何共同调控这一过程的还不明确,是否类似共受体的关系有相同的下游模块?ER 调节NST1和NST3依赖赤霉素途径,ER 是否通过下游基因调控了赤霉素的合成或者通过生长素和BR途径导致了与赤霉素信号串扰?
细胞分裂素(CK)积累型突变体ckx3 ckx5比野生型形成更长的花梗和果实,这与er表型相反,另一方面ckx3 ckx5也表现出茎粗和SAM增大[44],这分别与er和er erl1 erl2的表型相似。也有报道称,er erl1 erl2的SAM对CK 反应增强[45]。尽管这些观察在一定程度上存在争议,但可能的假设是ER 信号以2 种方式缓冲CK 反应:它可能阻止CK反应减弱,也可能抑制过多的CK反应,这取决于发育背景。
植物茎和其他组织的伸长可能是多种激素协同发挥作用的结果,而ER也似乎参与了多种激素的调控,在不同的物种中,ER在不同部位表达,是否通过不同激素的信号通路调控茎的纵向发育?复杂的激素调控网络之间也存在着信号串扰,而ER是否在这些网络的交叉中起调控作用也需要进一步的研究。
5 ER调节茎尖分生组织的大小和叶原基的启动
近年来研究者们注意到ER在调控茎尖分生组织大小中的作用,茎尖分生组织(shoot apical meristem,SAM)有2个主要功能:一是作为几乎所有地上器官分化的原始细胞;二是作为长期的干细胞库。在SAM 发育过程中,SAM各个区间的细胞增殖率存在显著差异,这也决定了后续叶和芽的形成[46]。有机体的复杂性是通过不同细胞类型之间的特异性和不同的分化来实现的,SAM 的正常形态是保证植株得以正常生长的重要因素之一,ER及其配体EPFL通过横向的限制WUSCHEL(WUS)的表达来调控SAM的大小[47]。
SAM 在植物的整个生命周期中都会产生新的器官。当圆顶形SAM 中央区域的干细胞缓慢分裂时,它们的部分子代细胞会横向移位到周边区域,并从底部移位到肋区。外围和肋区的细胞迅速分裂、分化并结合形成叶、花和茎。尽管细胞不断分裂,但由于细胞增殖和并入新器官的紧密平衡,SAM 大小在整个发育过程中保持稳定。WUS/CLAVATA(CLV)负反馈回路是SAM 尺寸调节的核心,它的功能可以正常发挥取决于WUS和CLV3的准确空间表达[48]。CLV3编码一个小分泌肽,在中央区域表达并被多个定位于质膜的受体感知。在中心区,WUS直接与CLV3的启动子结合并激活其表达,而CLV3激活的信号则抑制WUS表达,形成一个调节反馈回路。ERfs在SAM 以及发育中的叶和花原基中强烈表达。由于这些受体在SAM 中功能冗余,其功能直到通过对er erl1 erl2突变体的分析才变得明显。与野生型相比,三重突变体的分生组织更宽更平,此外,在er erl1和erl2中,叶片起始减少且叶序不规则[49]。虽然CLV-WUS模块调节中心区的细胞分裂,但er erl1 erl2中SAM的大小增加是由细胞数量增加和径向细胞扩张增加引起的。此外,与er erl1 erl2相比clv3突变体分生组织大小的增加与叶起始的增加有关。将拟南芥中截短的ER(AtΔKinase)转入番茄中抑制ERfs信号,也减少了番茄中的叶片数量[13]。
由ERfs 和EPFL 配体组成的信号通路可以限制SAM 宽度并促进叶片启动。ERfs在整个SAM 中表达,SAM中的ERfs 活性受4 个配体控制:EPFL1、EPFL2、EPFL4 和EPFL6,它们在SAM 的外围表达[50]。在拟南芥中的遗传分析证明,ERfs和CLV3协同调节SAM的大小,并且WUS对ERfs基因具有上位性。EPFL-ERfs信号抑制SAM外围WUS和CLV3的表达,将它们限制在中心,表明在ER调控下干细胞沿径向轴定位的分子机制[47]。分生组织的双重性取决于细胞行为与各种细胞间通讯的紧密协调,在SAM 的外围区域,器官原基的出现取决于生长素信号,ERfs 信号是调节SAM 组织的另一种途径[51]。尽管已经发现了ER 以及其上游EPF/EPFL 对WUS和CLV3横向表达限制的作用,但似乎这一新的通路以某种方式与WUS/CLV3负反馈通路存在交叉,这一机制还有待明确,ER调控WUS和CLV3的下游靶基因也有待进一步的研究。
6 展望
ERfs在植物生长发育的很多过程都发挥了重要功能,EPF/EPFL-ER 模块处于生长发育各个信号通路的较为上游位置。尽管ER在许多物种都已被鉴定,但对ER功能的研究仍集中在模式作物拟南芥中,ER的很多功能以及作用机制也还未明确,例如:ER在调控不同的生长过程中,通过组织特意性的表达不同的配体被ER 感知后进而激活下游通路,这些过程中的配体还未完全明确,这些配体都在哪些组织中以及何时表达也只有少部分被报道。从前人的这些研究中也可以看出ER调控生长的许多过程离不开植物激素,这些不同的信号通路之间可能存在信号串扰,但作为不同途径交叉点的关键基因也鲜有报道。此外,其他物种中ER功能及作用机制的研究相对较少,拟南芥中已明确的一些共受体及配体在其他物种中并没有同源基因,这意味着ER在其他物种中的作用机制可能是有别于拟南芥的。研究ERfs调控相关发育过程、各种环境线索以及其配体与ERfs的作用机制将有助于解析植物生长发育的密码。

