VAVs基因家族在肝癌中的表达及临床意义
蔡慧欣,项思博,杨文军
温州医科大学附属第一医院 肝胆胰外科,浙江 温州 325000
肝癌是当今世界上最常见的消化道恶性肿瘤之一,根据2020年全球癌症统计报告,全球肝癌新发病例超90万例,死亡病例超80万例,分别占所有癌症新发病例和死亡病例的4.7%和8.3%[1],是人类死于癌症的第三大常见原因。早期肝癌通常采用根治性治疗,包括切除、移植和消融,但由于肝癌的高复发率,5年生存率仍旧较低[2]。并且肝癌的多灶性进展和早期远处转移使大多数肝癌患者错过了外科治疗最佳时机,且晚期肝癌治疗方案有限。因此,阐明肝癌复发转移的分子机制,寻找有效的靶点对提高肝癌患者预后生存时间至关重要。
Rho GTP酶作为分子开关,调节各种细胞过程且调节的活动范围广泛,因此Rho GTPase信号的异常被认为与许多恶性肿瘤有关。Rho GTP酶循环于GDP和GTP之间,VAVs作为一个特定的GDP/GTP核苷酸交换因子,严格受酪氨酸磷酸化的调控。其家族中包括VAV1、VAV2、VAV3基因,分别位于人染色体中的19p13.3、9q34.2、1p13.3[3]。VAV1基因编码的蛋白主要作用于调整细胞骨架,以及调控T、B淋巴细胞的功能,VAV2基因主要参与多种转录过程,VAV3基因编码的蛋白结合Rho蛋白家族的成员而发挥作用。近些年来,大量的研究证明了VAVs基因在恶性肿瘤发生发展过程中的重要性,也对VAVs基因在肿瘤中的表达模式有了充分的认识,但确切功能和作用机制仍存在许多未知[4-6]。其在肝癌中的表达与功能尚未进行研究。本研究基于肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)数据库,分析VAVs家族基因表达对肝癌诊断和预后的价值,以期为肝癌的临床诊断治疗提供新的靶点。
1 资料和方法
1.1 数据库资料
从TCGA数据库(http://portal.gdc.cancer.gov)下载关于肝细胞癌(hepatocellular carcinoma,HCC)患者VAVs RNASeq-HTSeq-Counts测序数据及相关临床病理和预后资料,合并后共有374 例HCC肿瘤样本和50 例癌旁组织样本。剔除临床或生存资料缺失的肿瘤样本后最终各基因分别纳入342 例HCC肿瘤样本和50例癌旁组织样本。按VAVs mRNA表达量的中位值(VAV1 中位值=0.74,VAV2 中位值=13.48525,VAV3中位值=0.32105),分别将按各基因纳入的342例HCC患者分为高表达组(n=171)与低表达组(n=171)。
1.2 病例资料
对来自温州医科大学附属第一医院肝胆胰外科实验室20个肝癌组织标本和20个癌旁组织样本进行VAVs mRNA免疫组化染色,观察VAVs蛋白在HCC患者癌组织和癌旁组织中的表达差异。
1.3 列线图的构建及验证
筛选出阳性作用基因VAV2并通过R语言中的RMS包将VAV2的表达水平、性别、年龄、T、N、M、临床分期及病理分级重新建立预后模型,并可视化为预测未来1、2、3年存活率的列线图。对照该列线图,每例HCC患者可以根据自身临床病理特征获得相应的评分,再将每位HCC患者各临床病理特征对应的分数相加,最终得到总的风险评分。我们可以根据最终分数,获得相应1 年、2 年、3 年的预后风险,为监测HCC的复发或进展提供指导[7]。使用一致性指数(concordance index,C-index)、校准曲线(calibration curve)对生成的列线图进行测试和评估,以确定其区分度[8-9]和一致性[10]。
1.4 统计学分析
采用R语言R-4.0.3软件处理数据并进行统计学分析。计量资料不符合正态分布,采用M(P25,P75)表示,组间比较采用Wilcoxon检验,计数资料采用χ2检验。采用Kaplan-Meier法绘制患者生存曲线。HCC患者临床病理特征和预后的关系采用单因素及多因素Cox回归分析。P<0.05为差异具有统计学意义。
2 结果
2.1 VAVs mRNA及蛋白在肝癌及癌旁组织中的表达情况
对TCGA数据库资料分析显示,肝癌组织和癌旁组织中VAV1、VAV2、VAV3 mRNA表达量散点图见图1,其中VAV2 mRNA表达水平比其癌旁组织高[13.48525(2.5748,55.3636)vs10.31165(6.7191,17.386),Z=4.577,P<0.0001]。我中心肝癌样本的免疫组化结果显示,与癌旁组织相比,VAV2蛋白质在肝癌组织中的表达增加,见图2。

图1 TCGA数据库中VAVs mRNA在肝癌组织与癌旁组织中的表达

图2 本中心肝癌样本VAVs蛋白(棕黄色)在肝癌组织和癌旁组织中的表达(免疫组化,×400)
2.2 HCC患者临床病理特征与VAVs mRNA表达的关系
VAV2、VAV3 mRNA高表达与低表达HCC患者性别、临床分期有统计学差异(P<0.05),女性中VAV2 及VAV3 mRNA高表达的比例显著高于男性,肝癌临床分期Ⅲ期患者中VAV2 mRNA高表达的比例显著高于Ⅰ、Ⅱ、Ⅳ期。VAVs mRNA高表达与低表达HCC患者在年龄、生存状态、病理分级、T分期、N分期、M分期差异无统计学意义(P>0.05),详见表1。

表1 HCC患者VAV2 mRNA表达与临床病理特征的关系(例)
VAV2 mRNA在性别、不同肝癌临床分期、T分期HCC患者肝癌组织的表达量差异有统计学意义(P<0.05),Ⅲ期中VAV2表达高于Ⅱ、Ⅳ分期[17.27(4.64,51.14)vs13.86(2.57,37.31)vs10.98(6.28,22.73)](图3A),女性VAV2 mRNA表达高于男性 [17.40(2.57,55.36)vs14.41(4.57,43.25)](图3B),T3 期中VAV2 mRNA表达高于T2 期[15.98(4.64,43.25)vs13.66(2.57,37.31](图3C)。
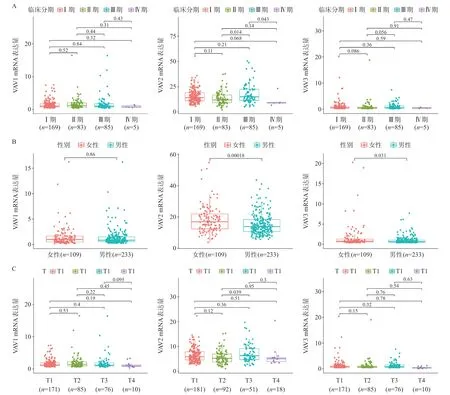
图3 VAVs mRNA在不同临床分期(A)、性别(B)、T分期(C)表达量比较
2.3 VAV2 mRNA表达与预后模型
Kaplan-Meier分析显示,VAV2 mRNA高表达的患者中位生存期明显短于低表达患者(P=0.014,图4B)。对HCC患者的年龄、性别、临床分期、肿瘤分级 及VAVs mRNA表达量对预后的影响进行单因素Cox回归分析,结果表明,T分期、肝癌临床分期以及VAV2 mRNA表达量对HCC患者预后存在显著影响,见表2。进一步多因素回归分析结果表明,肝癌临床分期(HR=1.626,95%CI1.083-2.442,P<0.05)及VAV2 mRNA表达量(HR=1.031,95%CI1.009-1.054,P< 0.05)是HCC患者预后的独立危险因素。VAV2 mRNA表达水平越高提示肝癌不良预后的可能性越大。

表2 HCC患者总生存率的单因素和多因素Cox回归分析

图4 TCGA数据集中VAV1(A)、VAV2(B)、VAV3(C)mRNA的Kaplan-Meier生存曲线
2.4 列线图及验证结果
根据对HCC患者的年龄、性别、肝癌临床分期、VAVs mRNA构建列线图(图5),该列线图C指数为0.731,大于0.7,表明该列线图数据集的区分度较好。1年、2年、3年ROC曲线下面积分别为0.772、0.683、0.650(图6A),另外从校准曲线图可见,HCC患者的第1 年总生存率的实际观测值与预测值具有较好的一致性,图中灰线表示预测值=实际值,表明该列线图的准确度良好(图6B)。

图5 基于VAV2 mRNA建立肝癌生存预后列线图
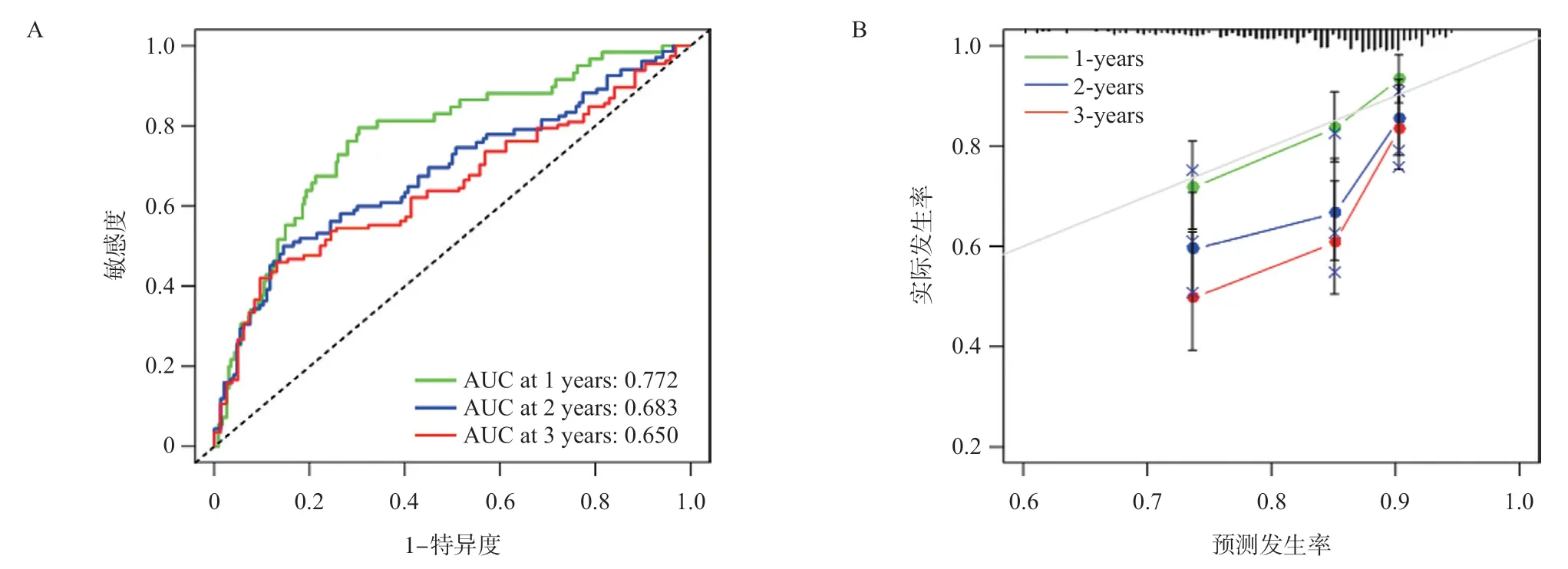
图6 VAV2 mRNA相关性的HCC患者的ROC曲线(A)和校准曲线(B)
3 讨论
原发性肝癌作为我国一种高发并且危害性较大的恶性肿瘤,其发生发展是一个多步骤、多途径的过程。如果患者在早期诊断为肝癌,通过手术干预如肝部分切除或肝移植可得到有效治疗,中位5年生存率约为70%[11-13]。但是术后5年复发率较高,为40%~70%,并且复发后的中位5 年生存率只有20%~35%[14-15]。当前的现状是,大多数肝癌在晚期确诊,而晚期肝癌的治疗往往只能是控制病情,患者的生活质量往往较差。
Rho GTP酶途径参与了广泛的细胞增殖、细胞存活和凋亡过程,并且在许多组织中调节免疫反应、血管生成和神经发生的细胞特异性。因此,这些通路的改变参与了许多相关的病理过程,包括恶性转化和癌症进展[16-17]。Rho鸟嘌呤核苷酸交换因子(Rho GEF)通过催化GTP与GDP的交换促进Rho GTP酶活性的GTP结合状态的形成。Rho GTP酶的交换因子有两类:典型的DBL相关交换因子[18]和非典型的Dock家族交换因子[19]。DBL家族主要构成部分为Pleckstrin同源(PH)结构域以及200个氨基酸组成的DBL同源(DH)结构域。水解域具有GEF催化活性,而PH域参与细胞内对水解域的靶向作用[20]。DH域和PH域负责催化Rho蛋白中的GDP-GTP交换反应。当受到刺激时,许多DBL家族的GEF被蛋白激酶磷酸化以促进其激活,代表性的例子是VAV[21]。
VAVs家族基因是一组由酪氨酸激酶调节的基因,其主要是在细胞调节中以鸟嘌呤核苷酸交换因子(guanosine nucleotic exchange factors,GEFs)发挥作用。VAVs蛋白的生物学活性受磷酸化依赖的构象变化控制。因此,在非刺激细胞中,非磷酸化的VAVs蛋白以一种自身抑制的构象不活跃,但当位于ac、zf和csh3 区域的特定酪氨酸残基被跨膜或胞质蛋白酪氨酸激酶(Ptk)磷酸化后,这种自抑制结构就会向“开放”和活跃的方向转变[22]。因此,VAVs蛋白可以表现出各种催化依赖和独立的生物反应,这对神经、心血管和免疫系统的动态平衡至关重要[23]。这些功能也被称为“规范活动”,代表了VAV GEFs家族中常见的和公认的特征。
最近,有研究表明,VAVs在人类癌症中高度表达,并与各种恶性肿瘤包括乳腺癌、胃癌、食管癌的发生、发展和转移有关。Wang等[24]研究发现,miR-195抑制VAV2在肝癌细胞中的表达,从而抑制HCC的血管生成及转移。这间接证实了VAV2 在促进肝细胞癌的进展中发挥了作用,但VAV2与肝细胞癌之间存在关联,其细节仍需要进一步的实验研究。
本研究探讨了VAVs mRNA在肝癌中的表达及意义,发现VAV2 mRNA及蛋白质在肝癌组织中的表达高于癌旁组织。而VAV1 和VAV3 mRNA和蛋白质水平在肝癌及癌旁组织中表达差异无统计学意义。探究HCC患者的临床病理特征与VAVs mRNA表达之间的关系,发现VAV3 高表达与性别有相关性(P<0.05),VAV2高表达与性别(P<0.001)、肝癌临床分期(P<0.05)有显著的相关性,而VAV1表达与患者临床病理特征无显著相关性。且临床分期Ⅲ期比Ⅱ期和Ⅳ期、女性比男性、T3分期比T2分期,VAV2 的表达升高,这对肝癌有一定的诊断价值。VAV2 mRNA高表达的肝癌患者总生存率低于VAV2 mRNA低表达肝癌患者,VAV2 mRNA高表达与肝癌患者预后不良有关,而VAV1 mRNA和VAV3 mRNA高、低表达组总体生存率差异无统计学意义。肝癌临床分期以及VAV2 mRNA的表达量是肝癌患者预后的独立危险因素,在此基础上构建的肝癌预后预测模型的C指数为0.731,1 年、2 年、3 年ROC曲线下面积分别为0.772、0.683、0.650,区分度较好且具有较好的一致性,具有一定的临床使用价值。因此VAVs家族中VAV2可作为生物标志物来识别高危的HCC患者,并可能成为HCC一个新的治疗靶点和预后监测指标。

