心肌细胞肥大时线粒体三磷酸腺苷敏感钾通道和线粒体自噬的变化
程晓蔚,朱庆磊
(1解放军医学院,北京 100853;2中国人民解放军总医院第六医学中心心血管病医学部心血管病研究所,北京 100853)
心肌细胞肥大是指心脏在受到刺激时发生的适应性改变,包括生理性和病理性两种类型。细胞肥大是一种对外界刺激的适应性反应,但病理性肥大一般会进展为心力衰竭,是心脏疾病向心力衰竭进展的必然过程[1]。心肌细胞肥大伴随着质的变化,即基因表达的改变,引起代谢、收缩力和心肌细胞存活的改变。不同类型的心肌细胞肥大受到不同的细胞信号通路的调节。研究表明,细胞代谢、增殖,非编码RNA,免疫反应,翻译调节和表观遗传修饰等,对心肌细胞肥大有积极或消极的调节作用[2]。然而,目前关于心肌细胞肥大的发病机制还未完全阐明,在临床上缺乏有效的治疗手段,因此,探索病理性心肌细胞肥大发生的潜在机制,寻找新的药物作用靶点,改善病理性心肌细胞肥大具有重要意义。本研究通过异丙肾上腺素诱导心肌细胞肥大[3-5],研究其线粒体自噬水平和线粒体三磷酸腺苷(adenosine triphosphate, ATP)敏感钾通道Kir6.1的变化规律,为病理性心肌细胞肥大提供新的防治思路。
1 材料与方法
1.1 试剂及仪器
异丙肾上腺素(isoprenaline, ISO)购于Sigma;进口胎牛血清购于Bovogen Biologicals;细胞高糖培养基、Ⅱ型胶原酶和胰蛋白酶购于Gibco;大鼠氨基末端脑钠肽前体(N-terminal pro brain natriuretic peptide, NT-proBNP)酶联免疫吸附测定试剂盒,购于生工生物工程(上海)股份有限公司;RNA提取试剂Trizol购于美国Invitrogen;反转录试剂盒iScript cDNA Synthesis Kit、iTaq Universal SYBR Green Supermix购于美国Bio-Rad;引物由生工生物工程(上海)股份有限公司合成;RIPA细胞裂解液、蛋白磷酸酶抑制剂混合物、BCA蛋白定量试剂盒购于北京索莱宝科技有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3, LC3)抗体购于Abcam;FUN14结构域蛋白1(FUN14 domain-containing protein 1, FUNDC1)抗体购于Cell Signaling Technology;内向整流钾通道6.1(inward rectifyimg potassium channel 6.1, Kir6.1)抗体购于武汉三鹰生物科技有限公司;超敏化学发光试剂盒购于上海碧云天生物技术有限公司。
二氧化碳细胞培养箱,美国Thermo公司;酶标仪Spark10M,瑞士Tecan公司;Nano Drop 2000,美国Thermo公司;聚合酶链式反应扩增仪,美国ABI;CFX96TM Real-time PCR仪及蛋白电泳系统,美国Bio-Rad;全自动化学发光图像分析系统5200,上海Tanon。
1.2 原代心肌细胞培养
选取出生后24h的新生大鼠12只,酒精浸泡消毒后,开胸取出心脏组织,置于预冷的D-hanks液中清洗3次,注意把心脏中残留血液全部清除。用剪刀将心脏组织剪碎,加入5ml 0.08%的胰蛋白酶,置于恒温水浴锅中,37℃消化5 min后,弃掉上清液。在剩余组织中加入6~7ml 0.08%的Ⅱ型胶原酶,37℃水浴消化5min,小心吸取上清液,加入含有10%胎牛血清的高糖培养基中中和消化酶,重复消化5~6次,直至组织块消失。将组织消化液经过细胞筛过滤,滤除未消化的组织块,收集细胞悬液分装于离心管中,800转/min,离心5min,弃上清液,用含有10%胎牛血清的高糖培养基重悬细胞,采用差速贴壁法去除成纤维细胞和内皮细胞。将未贴壁的细胞悬液取出,再次800转/min离心10min,弃上清液,使用新配置的10%胎牛血清高糖培养基再次重悬细胞。调整细胞密度为1×106个/ml,接种在6孔板中,每孔2ml,置于37℃、5% CO2的细胞培养箱中培养。24h后更换培养基。按照实验需要在培养48h后施加处理因素。
1.3 实验分组及药物干预
原代心肌细胞培养48h后将细胞随机分为2组。对照组细胞加含10%胎牛血清的高糖培养基培养,模型组细胞在含10%胎牛血清的高糖培养基中加入ISO 140μmol/L处理48h。
1.4 酶联免疫吸附法检测心肌细胞培养上清液NT-proBNP浓度
造模结束后,将细胞培养基移至无菌离心管,在4℃条件下离心(离心力1000g)20min,除去杂质及细胞碎片,取上清液。按照大鼠NT-proBNP酶联免疫吸附测定试剂盒使用说明书,检测心肌细胞培养上清液NT-proBNP浓度。
1.5 实时荧光定量聚合酶链式反应检测心肌细胞目的基因mRNA表达
心肌细胞用预冷的PBS缓冲液洗涤后,加入1ml Trizol,置于冰上裂解20min,用细胞刮板收集细胞,提取总RNA。取1μg总RNA进行逆转录,最后实时荧光定量聚合酶链式反应检测肥大基因心房钠尿肽(atrial natriuretic peptide,ANP)、脑利钠肽(brain natriuretic peptide,BNP)和β-肌球蛋白重链(β-myosin heavy chain,β-MHC)以及内向整流钾通道6.1(inward rectifyimg potassium channel 6.1, Kir6.1)和自噬相关基因8(autophagyrelatedgene8,Atg8)的mRNA水平。18S rRNA作为内参基因(Forward: TTGATTAAGTCCCTGCCCTTTGT; Reverse:CGATCCGAGGGCCTAACTA),定量数据采用对比Ct法计算。实验中涉及的引物序列,详见表1。

表1 qRT-PCR所用引物
1.6 蛋白免疫印迹法检测蛋白表达
心肌细胞用预冷的PBS缓冲液洗涤后,加入RIPA裂解液置于冰上裂解30min,用细胞刮板收集细胞,提取细胞总蛋白。BCA法测量蛋白浓度,取20μg总蛋白行12% 聚丙烯酰胺凝胶电泳分离,经过转膜封闭后放入一抗稀释液中4℃ 孵育过夜,一抗稀释比分别为Kir6.1(1∶1000),FUNDC1(1∶1000),LC3(1∶500),GAPDH(1∶2000)。洗膜后,室温孵育辣根过氧化物酶标记的二抗(1∶8000) 1h,采用超敏化学发光试剂盒进行曝光分析。目的蛋白表达水平=目的蛋白灰度值/内参GAPDH灰度值。
1.7 统计学处理
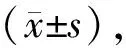
2 结 果
2.1 ISO处理对心肌细胞培养上清液NT-proBNP的影响
酶联免疫吸附法检测显示,与对照组相比,模型组心肌细胞培养上清液NT-proBNP浓度明显升高[(1699.43±407.01)和(808.68±91.46)pg/ml,P<0.05]。
2.2 ISO处理对心肌细胞ANP mRNA、BNP mRNA和β-MHC mRNA表达的影响
实时荧光定量聚合酶链式反应检测显示,与对照组相比,模型组肥大相关基因ANP、BNP和β-MHC基因表达量明显增加(P<0.05;图1)。
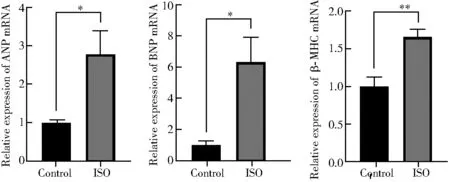
图1 ISO处理对大鼠乳鼠原代心肌细胞ANP mRNA、BNP mRNA和β-MHC mRNA表达的影响Figure 1 Effects of ISO treatment on expression of ANP mRNA, BNP mRNA and β-MHC mRNA in neonatal rat cardiomyocytesANP: atrial natriuretic peptide; BNP: brain natriuretic peptide; β-MHC: β-myosin heavy chain; ISO: isoprenaline. Compared with control group, *P<0.05, **P<0.01.
2.3 ISO处理对心肌细胞钾通道Kir6.1 mRNA和自噬相关基因Atg8 mRNA表达的影响
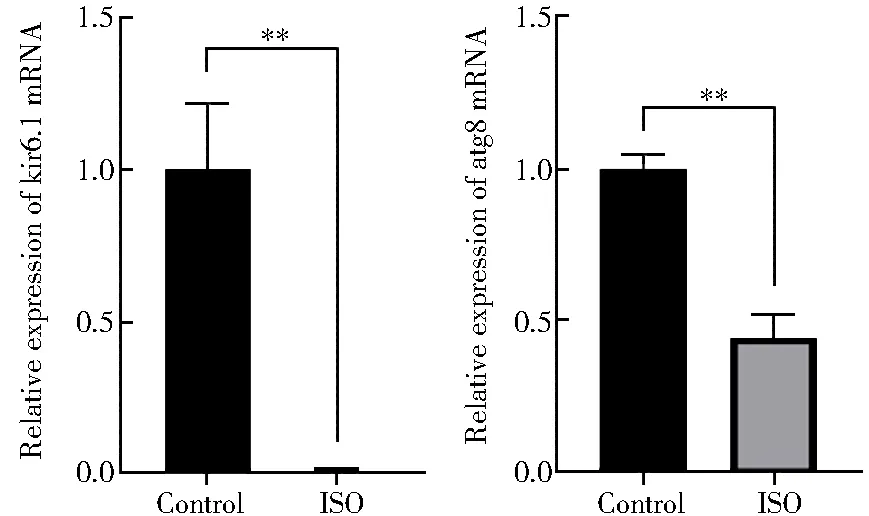
图2 ISO处理对大鼠乳鼠原代心肌细胞Kir6.1和Atg8基因mRNA表达的影响Figure 2 Effects of ISO treatment on expression of Kir6.1 mRNA and Atg8 mRNA in neonatal rat cardiomyocytesKir6.1: inward rectifyimg potassium channel 6.1; Atg8: autophagy related gene 8.ISO: isoprenaline. Compared withcontrol group, *P<0.05, **P<0.01.
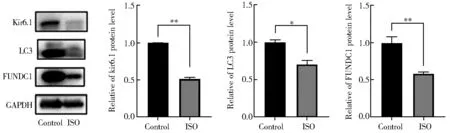
图3 ISO处理对大鼠乳鼠原代心肌细胞Kir6.1、LC3和FUNDC1蛋白表达的影响Figure 3 Effects of ISO treatment on expression of Kir6.1, LC3 and FUNDC1 protein in neonatal rat cardiomyocytesKir6.1: inward rectifyimg potassium channel 6.1; LC3: microtubule-associated protein 1 light chain 3; FUNDC1: FUN14 domain-containing protein 1; GAPDH: glyceraldehyde-3-phosphate dehydrogenase; ISO: isoprenaline. Compared with control group, *P<0.05, **P<0.01.
实时荧光定量聚合酶链式反应检测显示,与对照组相比,模型组钾通道Kir6.1和自噬相关基因Atg8的mRNA表达显著降低(P<0.05;图2)。
2.4 ISO处理对心肌细胞Kir6.1基因的蛋白表达和线粒体自噬相关蛋白LC3和FUNDC1表达的影响
蛋白免疫印迹法检测显示,与对照组相比,模型组线粒体ATP敏感钾通道蛋白Kir6.1和线粒体自噬相关蛋白LC3,FUNDC1表达明显降低(P<0.05;图3)。
3 讨 论
心肌细胞肥大是心肌细胞长期、过度负荷引起的一种适应性病理变化,如果病因长久不能被消除,就会发展为心力衰竭[1]。ISO作为β受体激动剂,能够使心脏收缩力增强,过量或长期使用可导致心肌耗氧量增加、负荷加重,从而引起心肌细胞肥大[3-5]。心肌肥大主要表现为心肌细胞体积增大、表面积增加、总蛋白合成增加、肥大相关胚胎基因(在胚胎期表达而在出生后低表达或不表达)重新被激活表达。本研究结果显示,与对照组比较,模型组的心肌细胞培养上清液NT-proBNP浓度明显升高,心肌肥大相关胚胎基因ANP mRNA ,BNP mRNA 和β-MHC mRNA表达上调,表明ISO诱导心肌细胞肥大模型构建成功。
众所周知,线粒体是真核生物进行氧化代谢的部位,是维持机体生命活动的关键细胞器。因此,线粒体功能出现异常,将会影响到基础生命活动,出现多种病理生理学表现。在心肌细胞肥大的过程中,线粒体受到多种因素的影响导致代谢功能障碍[6,7]。线粒体ATP敏感钾通道是位于线粒体内膜上的内向整流钾通道,主要是由Kir6.1通道亚基和磺酰脲受体调节亚基构成,在维持线粒体膜电位、减轻钙离子超载、改善缺血再灌注损伤、抑制氧化应激和细胞凋亡中发挥着重要作用[8,9]。在本研究中,心肌细胞肥大时线粒体ATP敏感钾通道Kir6.1表达降低,影响线粒体功能代谢。开放线粒体ATP敏感钾通道可能通过提高线粒体膜电位、改善细胞能量代谢、减少心衰标志物表达,从而起到抑制心肌肥厚的作用[10,11]。
线粒体功能障碍与心血管疾病有关,消除功能失调的线粒体对维持细胞功能至关重要[12]。线粒体自噬对于清除有缺陷的线粒体是必不可少的,但如果不严格控制,可能导致细胞损伤和死亡。调控细胞线粒体自噬程度将成为控制疾病发展的关键因素。心脏应激适度诱导线粒体自噬有助于清除受损和功能失调的线粒体,可以防止细胞凋亡的启动而最终导致的心力衰竭氧化损伤。线粒体自噬的调节在各种心血管疾病中具有有害和(或)有益的结果[13,14]。FUNDC1是一种新型的线粒体自噬受体蛋白,位于线粒体外膜上,包含3个跨膜结构域,其中暴露于细胞质的N端含有一段典型的LC3相互作用区。在哺乳动物细胞中FUNDC1通过与LC3相互作用介导损伤线粒体的选择性清除,从而保护心肌细胞线粒体,维持细胞稳态[15-17]。本研究发现心肌细胞肥大时LC3和FUNDC1表达降低,线粒体自噬水平下降。适度诱导线粒体自噬清除受损和功能失调的线粒体,可以阻止心肌细胞肥大,改善心脏功能。
综上,本研究发现ISO诱导心肌细胞肥大时线粒体ATP敏感钾通道Kir6.1和线粒体自噬水平均明显降低,线粒体ATP敏感钾通道Kir6.1和线粒体自噬在心肌细胞肥大时发挥重要作用。同时提示二者之间可能存在联系,然而其中的调节机制还有待进一步深入探讨研究。

