老年脑膜瘤病人术前睡眠状况调查及其影响因素分析
王娟 郝佩 胡蕾 崔苗苗 戴舒惠 王珍珍 张美霞
脑膜瘤是临床最常见的颅内良性肿瘤,据报道,其发病率大约为8/10万,且发病率随年龄增长而增加,特别是65岁以上病人,发病率显著升高[1]。虽然大多数脑膜瘤生长缓慢,症状轻且预后好,但老年人身体机能普遍下降,疾病耐受能力减弱,因此许多在年轻人群中被忽视的症状对老年脑膜瘤病人影响很大,其中就包括疾病相关的睡眠障碍(sleep disturbance,SD)。SD不仅损害机体免疫系统,还能够引起一系列神经精神症状,包括抑郁、焦虑等,从而影响整个脑膜瘤治疗过程的决策和实施,最终降低病人治疗效果[2-3]。目前针对老年脑膜瘤人群中SD发生率及影响因素的临床数据十分匮乏。因此,本研究拟通过回顾性分析老年脑膜瘤病人的人口学特征、临床信息以及相关自我报告量表评分与病人睡眠质量评分的关系,探讨该人群中SD的发生情况以及影响因素,为提高老年脑膜瘤病人的整体治疗水平提供临床依据。
1 资料与方法
1.1 研究对象 选取空军军医大学第一附属医院神经外科三病区2020年1~12月连续收治的老年脑膜瘤病人作为研究对象。纳入标准:(1)接受手术治疗且病理学诊断为脑膜瘤;(2)年龄 ≥65岁。排除标准:(1)存在严重的肝肾、血液系统、心血管系统疾病,既往诊断为SD或合并其他严重影响病人日常活动和生活质量的疾病;(2)患有精神疾病或认知功能障碍、不能配合调查者。本研究符合2013版《赫尔辛基宣言》相关要求,并获医院伦理委员会批准(KY20191067-F-1)。所有病人(或家属)均签署知情同意书。
1.2 资料收集
1.2.1 人口学特征及临床资料:(1)收集人口学资料,包括年龄、性别、BMI、居住地、婚姻状态、教育程度、医疗保险、吸烟饮酒史以及是否进行日常锻炼(平均每天散步、慢跑或其他有氧运动≥30 min)。(2)收集临床资料,包括诊断到入院时间、基础疾病、首发症状、卡氏评分(Karnofsky Performance Status,KPS)、肿瘤直径(影像学CT或MRI最大直径)、肿瘤位置或WHO分级等。
1.2.2 自我报告量表:采用匹兹堡睡眠质量指数量表(Pittsburgh Sleep Quality Index, PSQI)[4]评估病人睡眠质量,该量表总分范围为0~21分,≥8分为SD。采用数字疼痛评分量表(Numerical Rating Scale,NRS)[5]评估过去1周内病人主观疼痛程度,评分范围为0~10分,0分为完全无痛,分数越高,主观疼痛感受越重。采用医院用焦虑抑郁量表(Hospital Anxiety and Depression Scale,HADS)[6]评估病人焦虑和抑郁状态,该量表包含焦虑(HADS-A)和抑郁(HADS-D)模块,每个模块的分数范围为0~21分。采用多维度疲劳量表(Multidimensional Fatigue Inventory-20, MFI-20)[7]评估病人疲劳程度,该量表总分范围为20~100分,分数愈高,疲劳程度愈强。
1.2.3 自我报告量表的质量控制:根据国内外既往文献选择具有明确适用范围的量表进行评估;所有量表采集者均经过标准化培训,采用统一的量表格式、用语以及在规定的时间范围(手术前24 h内)对病人进行自我报告量表的调查、指导和收集;确保量表由本人独立或在其监护人帮助下完成;如出现对题目不理解或其他争议时,确保现场作出解释;完成量表后现场核对资料,发现空缺立即填补。
2 结果
2.1 病人一般资料情况 本研究共纳入老年脑膜瘤病人76例,其中5例病人未能按要求完成相关自我报告量表,故从本研究中剔除,其余71例病人纳入分析,其中男19例(26.8%),女52例(73.2%);年龄65~84岁,平均(73.6±6.1)岁。BMI 为23.7±2.9,KPS评分为(88.6±5.2)分,脑膜瘤最大直径为(4.1±1.2)cm,WHO分级Ⅰ级63例(88.7%),Ⅱ级8例(11.3%);此外,首发症状中,56.3%(40例)为头痛、恶心等颅内高压症状,5.6%(4例)为癫痫,28.2%(20例)为神经功能障碍,其余9.9%(7例)为其他症状。
2.2 不同睡眠质量分组间的单因素分析 根据PQSI总分进行分组:SD组34例,睡眠良好组37例。单因素分析显示,2组BMI、锻炼情况、NRS评分、KPS评分、MFI-20评分、HADS-A评分及HADS-D评分比较,差异均具有统计学意义(P<0.05或P<0.01)。见表1。
表1 不同睡眠质量老年脑膜瘤病人组间资料比较
2.3 影响老年脑膜瘤病人SD的多因素Logistic回归分析 为了尽可能避免遗漏潜在的影响因素,我们将单因素分析中P<0.10的因素纳入多因素Logistic回归模型中分析,结果显示,愈高的NRS评分、HADS-A评分、MFI-20评分以及愈低的KPS评分是老年脑膜瘤病人发生SD的独立危险因素(P<0.05)。见表2。
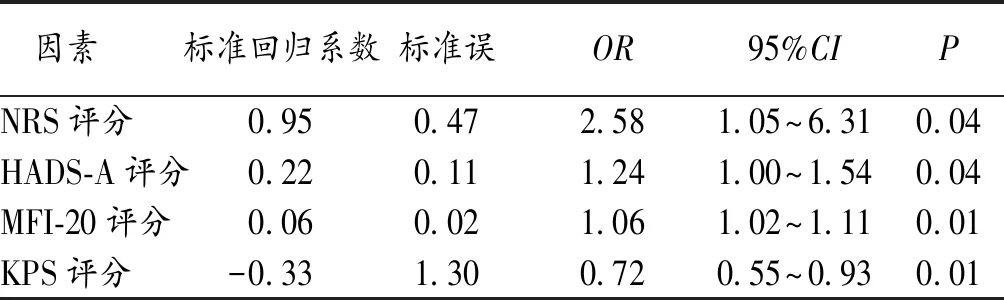
表2 老年脑膜瘤病人SD的多因素Logistic回归分析
3 讨论
SD是脑膜瘤病人十分常见的伴发症状。约40%的病人在得知脑膜瘤诊断后会出现不同程度的SD,显著高于普通健康人群(15%~20%)[8]。然而,在临床诊疗和护理过程中,该问题的重要性常常被忽视。睡眠是一项基本但精细的生理过程,其调控机制和影响因素十分复杂,与免疫系统功能、心理健康、认知功能和生活质量密切相关[9]。因此,充分了解老年脑膜瘤伴发SD病人的临床特征以及影响因素具有十分重要的意义。本研究发现:近50%的老年脑膜瘤病人会出现SD;NRS评分、MFI-20评分、HADS-A评分和KPS评分与SD发生密切相关,是影响老年脑膜瘤病人SD的独立风险因素。
3.1 疼痛 约60%的脑膜瘤病人会出现头痛症状,但其程度往往较轻,这与脑膜瘤生长缓慢的特性有关[10]。理论上老年肿瘤病人更易受到疼痛症状的困扰,但由于老年人伴发病症多、认知功能下降、社会经历丰富等特点,其对疼痛的主观评估往往较低,从而导致老年病人疼痛常被忽略。本研究发现,老年脑膜瘤病人的NRS评分普遍较低,即主观疼痛程度较轻,这符合老年肿瘤病人的疼痛特点。然而,在老年脑膜瘤病人中, NRS评分即使发生轻微的提升,也显著影响睡眠质量,这提示在治疗老年脑膜瘤病人时,必须更加重视其主观疼痛感受的变化,即使轻微的主观疼痛变化也需要做出相应的处理。
3.2 疲劳 疲劳亦是脑膜瘤病人众多非特异性症状中的一项,其表现为主观感受上的疲惫并缺乏活力,不能因休息而轻易得到改善[2]。虽然目前关于老年肿瘤病人疲劳程度与临床决策之间关系的数据十分有限,但不难想象老年人群更易受到疲劳症状的影响[11]。MFI-20量表可以从身体、心理和精神3个维度反映受试者的疲劳程度,是一种可靠有效的疲劳评估工具[7]。本研究结果显示,老年脑膜瘤病人的疲劳程度是SD的重要危险因素。因此控制老年病人的疲劳感受可能有助于改善SD[12]。近期,欧洲肿瘤内科学会(ESMO)发布的癌症相关疲劳指南建议,医护人员宜尽早通过宣教、体育锻炼、心理社会干预等方式应对老年肿瘤病人疲劳症状,不推荐使用药物干预[13]。
3.3 焦虑 在接受手术治疗的脑肿瘤病人中,焦虑和抑郁的发生较为普遍,而脑膜瘤病人相对于其他脑肿瘤病人,似乎存在程度更高的焦虑和抑郁。特别是对于老年人群,脑膜瘤的诊断无疑是巨大的精神刺激,往往导致强烈的心理应激。老年人对肿瘤性疾病认知的缺失更增强了这种刺激。本研究中,发生SD的老年病人的HADS焦虑和抑郁评分均显著高于睡眠良好组,进一步分析确定焦虑评分是SD的独立风险因素。实际上,老年病人的焦虑症状和SD是相互影响的,即焦虑会影响睡眠质量,而睡眠质量下降则进一步加重焦虑症状,这种恶性循环极大地影响病人的治疗效果和生存质量[2]。在肿瘤病人,特别是良性肿瘤病人中,有相当程度的焦虑是来自对疾病和治疗过程的未知[14]。因此,医护人员应当加强疾病教育,适时地采用药物或非药物干预措施控制病人的焦虑症状。
3.4 身体功能状态 功能状态的持续下降是老年人群重要的身体特征之一,愈差的功能状态意味着病人应对各种治疗措施的依从性和耐受性下降,因此愈容易放弃治疗[15-16]。本研究发现,较低的KPS评分是老年病人SD发生的独立危险因素。虽然入院的老年病人很难在短期内改善其身体功能状态,但详细的功能评估有助于我们预判SD的发生,并提醒医护人员在治疗和护理过程中,针对性的对功能状态较差的病人进行SD相关教育,以达到改善老年病人睡眠质量的目的。
综上,老年脑膜瘤病人SD发生的危险因素包括身体功能状态、焦虑、疼痛及疲劳等,详细评估和早期干预这些危险因素对改善老年脑膜瘤病人睡眠质量,提高整体治疗效果具有重要意义。

