花生油脂合成相关酰基转移酶基因的研究进展
沈悦 沈一 刘永惠 梁满 张旭尧 陈志德
摘要:花生是重要的油料作物和经济作物,我国花生年产量居世界第一,居国内油料作物首位,其总产的50%以上均用于榨油。囿于国内粮油争地矛盾和不断增长的油脂消费需求等因素,提高油料作物含油量对保障我国食用油脂安全具有重要的战略意义。花生种子油脂的主要成分为三酰甘油(TAG),其合成受到多个限速酶基因的协同调控,这些基因的时空表达特性、脂肪酸底物选择性和非生物胁迫响应等机制与油脂积累密切相关,最终影响油籽的产量和品质形成。植物油脂合成是涉及多个亚细胞区室、多条合成途径调控的复杂代谢网络,本文在总结植物油脂区室化合成步骤的基础上,对花生油脂的功能特性以及花生油脂合成途径中相关关键酰基转移酶的作用机制和研究现状进行归纳阐述,并提出存在的问题和建议,为花生油脂性状的精准鉴定和遗传育种提供参考。
关键词:花生;油脂合成途径;三酰甘油;酰基转移酶
中图分类号:S565.201 文献标志码:A
文章编号:1002-1302(2023)05-0065-06
花生(Arachis hypogaea L.)别称落花生,豆科植物,异源四倍体(AABB,2n=4x=40),为近缘二倍体野生种蔓花生(Arachis duranensis)和Arachis ipaensis单一杂交后经染色体自然加倍驯化而来[1]。花生是我国主要的油料作物和经济作物之一,其种植面积长期居于国内油料作物第二、总产第一水平,在保障我国食用油脂安全方面具有重要的战略地位[2]。花生籽仁富含超過50%的粗脂肪,不饱和脂肪酸含量占比80%以上,是优质食用植物油的重要原料[3-4]。近年我国国产食用植物油自给率仅在1/3左右[5],而花生进出口贸易自2019年开始呈净进口态势[6],其国际市场竞争力已然面临巨大挑战。因此,囿于国内粮油争地和农业供给侧结构现状,以市场需求为驱动力,如何提高花生油脂含量和品质,高效、定向培育耐储存油用型的花生新品种成为当前花生育种的重要目标之一。
植物油脂属于甘油脂类中性贮藏脂,通常以三酰甘油(triacylglycerol,TAG)的形式广泛存在于种子、花粉和一些肉质果(如油棕榈、橄榄等)组织中,常见用于食品、饲料和工业等。植物中存在多条油脂合成独立途径,其中包括简单的依赖酰基辅酶A的Kennedy途径(从头合成DAG/TAG)和复杂的不依赖酰基辅酶A的PC途径(PC衍生的DAG/TAG),这2条途径的选择偏好及TAG合成相对通量存在一定的种间差异和组织特异性[7-9]。因此,阐明植物油脂生物合成途径及其关键酶基因的遗传学研究进展,对花生油脂性状的功能鉴定和育种利用具有重要意义。
1 植物油脂生物合成途径
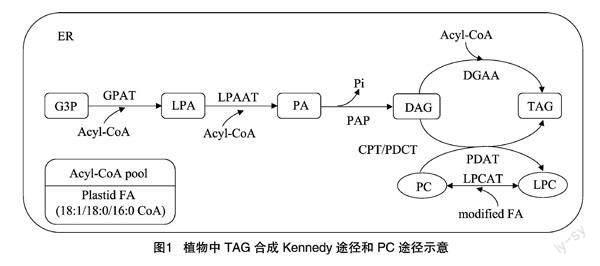
植物油脂合成是一个涉及多个亚细胞区室、多条合成途径协同完成的生化反应代谢网络,通常分为3个阶段:首先,在质体中进行脂肪酸的从头合成、去饱和,并被外运到细胞质;其次,在内质网中进行脂肪酸修饰,然后通过Kennedy途径(或PC途径)组装TAG(图1);最后TAG在油体(或脂滴)中稳定储存。基于植物油脂代谢网络的复杂性,质体输出脂肪酸的相对通量、脂肪酸链的延长、酰基编辑、脂肪酸修饰以及TAG组装酶的有效通量等都会影响组织TAG积累及其脂肪酸组成多样性[10]。
1.1 脂肪酸从头合成途径
脂肪酸(fatty acid,FA)从头合成以糖酵解途径产生的丙酮酸为前体,经丙酮酸脱氢酶(pyruvatedehydrogenase,PDH)和乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACCase)脱氢、羧化,生成的丙二酰辅酶A在脂肪酸合酶(fatty acid synthase,FAS)催化下在酰基载体蛋白(acyl carrier protein,ACP)上进行酰基链的组装,每循环延长2个碳链,经7个循环反应生成饱和的16:0-ACP,随后被酮酰-ACP合成酶Ⅱ(ketoacyl-ACP synthase,KAS)延长C16酰基链生成饱和18:0-ACP,再被硬脂酰-ACP脱饱和酶(stearoyl-ACP desaturase,SAD)去饱和生成18:1-ACP。2种脂肪酸硫酯酶(fatty acid thioesterase,FATA/FATB)分别水解上述不饱和/饱和中间产物,释放游离FAs(18:1Δ9>[KG-*2]>16:0>18:0)[9,11-12]。
3种游离FAs被长链酰基辅酶A合成酶(long-chain acyl-CoA synthetase,LACS)转化为酰基辅酶A(acyl-coenzyme A,Acyl-CoA),并被脂肪酸外运蛋白(fatty acid export,FAX)输出质体,生成Acyl-CoA库(18:1-CoA、18:0-CoA和16:0-CoA)用于下游脂肪酸链延长、修饰和TAG组装等过程[13-14]。不难看出,脂肪酸合成存在多个限速步骤,该途径决定了碳链的长度(最多18个)以及植物油中饱和脂肪酸的水平。
1.2 Kennedy途径(DAG/TAG从头合成)
以甘油-3-磷酸(glycerol-3-phosphate,G3P)为酰基受体、Acyl-CoA为酰基供体,经酰基辅酶A:甘油-3-磷酸酰基转移酶(acyl-CoA:glycerol-3-phosphate acyltransferase,GPAT)和酰基辅酶A:溶血磷脂酸酰基转移酶(acyl-CoA:lysophosphatidic acid acyltransferase,LPAAT)在G3P的sn-1和sn-2位进行2次顺序酰化生成磷脂酸(phosphatidic acid,PA),PA经磷脂酸磷酸酶(phosphatidic acid phosphatase,PAP)水解去除磷酸盐,生成的二酰甘油(diacylglycerol,DAG)经酰基辅酶A:二酰甘油酰基转移酶(acyl-CoA:diacylglycerol acyltransferase,DGAT)在底物DAG的sn-3位进行第3次酰化生成TAG[8,11],这种G3P与Acyl-CoA经3次顺序酰化生成从头DAG/TAG的过程被称为Kennedy途径。除了直接利用质体输出的Acyl-CoA,从头合成DAG/TAG合成途径还可以利用细胞质和内质网中延长到≥20个碳的Acyl-CoA。
1.3 PC途径(PC衍生的DAG/TAG合成)
磷脂酰胆碱(phosphatidylcholine,PC)既是用于FA修饰的位点,也是用于TAG合成的新DAG底物的中间体,表明PC衍生的DAG/TAG途径是增加TAG中不饱和或独特(unusual)脂肪酸的一种重要方式。PC从头合成需要产生2次DAG:首先从头合成DAG,随后转化为PC,最后释放新的DAG。这一过程中从头DAG被导入PC后先进行FA修饰,再从PC释放含有修饰FA的DAG,因此,不难发现从头合成的DAG和PC衍生的DAG之间是明显不同的分子类型。共存在3种酶促途径合成PC衍生的DAG:(1)利用CDP-胆碱:二酰甘油胆碱磷酸转移酶(CDP-choline:DAG cholinephosphotransferase,CPT)反向介导PC和DAG相互转化[12];(2)利用磷脂酰胆碱:二酰甘油胆碱磷酸转移酶(phosphatidylcholine:diacylglycerol cholinephosphotransferase,PDCT)介导PC和DAG相互转化[15];(3)基于脂肪酶介导的途径,如磷脂酶C(phospholipase C,PLC)或PLD/PAP催化水解PC生成DAG[16]。
1.4 酰基编辑
酰基编辑是一个去酰化-再酰化循环反应,该循环始于PC释放酰基,通过酰基辅酶A:溶血磷脂酰胆碱酰基转移酶(acyl-CoA:lyso-phosphatidylcholine acyltransferase,LPCAT)的反向反应生成溶血磷脂酰胆碱(lyso-PC/LPC),LPCAT再重新酯化LPC生成PC完成循环[17]。酰基编辑本身不影响PC和TAG净积累,它允许PC和Acyl-CoA库之间完成快速的酰基交换,可以源源不断地为从头合成DAG/TAG提供PC修饰的新生FAs。
2 花生油脂功能特性
花生油脂具有特异的脂肪酸组成,主要包括棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)、亚油酸(C18:2)、亚麻酸(C18:3)、花生酸(C20:0)、花生烯酸(C20:1)、山嵛酸(C22:0)、二十四碳烷酸(C24:0)等长链脂肪酸,其中油酸相对含量最高(34%~68%),亚油酸次之(19%~43%),总不饱和脂肪酸含量超过80%。油酸具有较好的热稳定性和抗氧化性,提高油酸含量利于促进花生油脂及相关加工产品的耐储藏性。在对人体血管稳态保健方面,油酸可以靶向降低低密度脂蛋白胆固醇,亚油酸作为人体必需脂肪酸,也能够降低人体总胆固醇、预防高血压和动脉粥样硬化,但因其不饱和程度较高极易氧化酸败[18]。含油率和油亚比是评估花生油脂供给能力和品质价值的重要指标。有关研究表明,花生含油量每提高1%,相当于产量提高2%,油脂加工利润相应提高7%[19-20];油酸、亚油酸含量遗传主要受加性效应控制,并且两者之间存在显著负相关[21];另外,花生含油量与油酸、亚油酸含量之间不存在显著相关性[22-23],这些结论有效支撑了当前育种工作者对于专用型花生品种(如高油兼高油酸)定向培育的可行性。
3 三酰甘油合成相关酰基转移酶研究进展
3.1 甘油-3-磷酸酰基转移酶(GPAT)
GPAT主要催化Acyl-CoA上的酰基向G3P羟基位转移,生成溶血磷脂酸(lyso-phosphatidic acid,LPA)。G3P作为合成TAG的碳链骨架,存在3个脂肪酸结合位点sn-1、sn-2和sn-3。迄今发现10个拟南芥GPAT同系物,其中GPAT1-8为陆生植物特有的sn-2-GPAT,主要参与角质、软木脂等极性甘油脂合成,暂无证据表明与油脂合成相关[24-25];GPAT9与动物脂肪合成基因GPAT3/4高度同源,作为内质网定位的sn-1位双功能酶基因直接参与植物膜脂和TAG的生物合成[26]。此外,質体定位的ATS1可利用acyl-ACP为酰基供体催化G3P的sn-1位脂酰化,可能与植物耐寒应答机制相关[27-28]。花生组织qRT-PCR时空表达分析结果显示,AhGAPT1、AhGAPT2、AhGAPT6、AhGAPT8和AhATS1主要在叶片和花中的表达量较高,AhGAPT3和AhGPAT5主要在花生种子发育初期下胚轴中表达量较高,AhGPAT9主要在茎、花和种子中表达并且种子表达量与种子油脂积累速率呈正相关,这些基因均可能参与(或部分参与)了植物对低温、高盐、脱落酸(ABA)等的非生物胁迫应答[29-31]。比较发现,AtGPAT9和AhGPAT9具有高度的序列相似性,过表达AtGPAT9导致拟南芥种子质量、面积和含油量均上调,并且atgpat9突变体呈雌雄配子体纯合致死表型;过表达AhGPAT9也导致转基因花生种子含油量显著增加,沉默表达株系中表现为降低,不难看出AhGPAT9在植物油脂合成中与AtGPAT9一样具有相似的功能。此外,AhGPAT9等位基因多态性高油位点杂交组合也为花生高油育种提供了新思路[31-32]。
3.2 溶血磷脂酸酰基转移酶(LPAAT)
LPAAT(或LPAT)负责催化LPA和Acyl-CoA酯化生成磷脂酸(PA)。PA是膜脂、信号和贮存脂类生物合成的关键中间体,LPAAT通过调控LPA在不同组织中转化为不同PA来调控生物体细胞功能。根据系统发育和底物选择性分为4个亚组,包括LPAAT1、LPAAT2/3(A-class LPAAT)、LPAATB(B-class LPAAT)和LPAAT4/5。目前报道了5个拟南芥LPAAT同系物,质体定位的AtLPAAT1能够在各组织中广泛表达,该基因对酰基底物的选择性更倾向于16:0-CoA,功能缺失突变体中质体PA合成被阻断,导致纯合突变株种子的胚胎在心形—鱼雷阶段停止发育而死亡[33-34]。LPAAT2/3亚组对酰基底物的选择性更倾向于18:1-CoA,内质网定位的AtLPAT2也能够在各组织中广泛表达,突变后导致雌配子体败育;AtLPAT3主要在花粉中表达且活性高于AtLPAT2,两者存在一定的功能冗余[35]。LPAATB亚组在底物选择性上倾向于中链脂肪酰基(12:0~16:0-CoA),拟南芥中暂无相关报道。LPAAT4/5亚组进化上与动物AGPAT8接近,AtLPAT4和AtLPAT5能在拟南芥各组织中广泛表达但丰度较低[35],并且这2个基因存在不同的转录本(TAIR),功能未知,表明植物PA合成的复杂程度远超出目前的认知。
花生组织qRT-PCR时空表达分析结果显示,AhLPAAT2主要在花生种子中高丰度表达,AhLPAAT4、AhLPAAT5、AhLPAAT6等3个基因在花中的转录丰度高于其他组织,4个基因的转录水平受非生物胁迫(低温、盐、干旱和ABA)差异诱导[36]。AhLPAT2定位于内质网,其种子表达量与籽仁油脂积累速率变化一致,高油品种的AhLPAT2种子表达量始终高于低油品种;拟南芥中过表达AhLPAT2能够促进组织内脂肪酸从头合成、TAG组装、蔗糖代谢和糖酵解途径相关几个关键基因的诱导表达,导致转基因株系种子的含油量、粒质量均显著增加[37-38]。AhLPAT4定位于细胞质,该基因在花生种子的不同发育阶段的表达量与油脂积累速率不一致[39]。不难看出,花生AhLPAATs家族成员在组织和亚细胞中的表达存在明显的时空差异性,意味着其参与了体内多种脂代谢功能,它们对油脂合成及其组分多样性的贡献有待进一步研究。
3.3 二酰甘油酰基转移酶(DGAT)
DGAT是催化Acyl-CoA依赖的TAG从头合成途径的最后一步限速酶,系统发育进化分析划为4类:DGAT1、DGAT2、可溶性DGAT以及细菌WS/DGAT,其中DGAT1和DGAT2在真核生物中广泛存在。目前,AtDGAT1是唯一被证实与拟南芥种子TAG合成和积累直接相关的,该基因功能缺失后能导致种子含油量减少20%~40%,某种程度上也表明TAG合成存在其他途径的补偿机制;同时,AtDGAT1还能介导植物对低温胁迫的应答[40-42]。拟南芥中AtDGAT2可能不编码功能性酶,因为突变体遗传研究发现该基因与AtDGAT1不存在功能上的互补或冗余关系[41]。尽管如此,人们还是发现了一些产生富含独特FAs的含油植物DGAT2,如蓖麻、油桐和铁皮草,它们分别产生富含蓖麻油酸(12-OH 18:1 cisΔ9)、油麻酸(18:3 cisΔ9、transΔ11、transΔ13)和白醋酸(12-环氧、cisΔ9十八碳烯酸)的TAG[43];此外,油棕EgDGAT2和椰子CoDGAT2具有对棕榈酸(C16:1)和油酸(C18:1)的底物偏好,它们的过表达拟南芥种子中脂肪酸含量均发生了显著差异变化[44-45]。这些研究结果均有力支撑了DGAT2在植物TAG生物合成中对独特FAs的选择偏好与TAG积累的积极贡献。
花生AhDGAT1存在多个剪接变体,它们表现出不同的组织特异性表达模式,其中AhDGAT1.1过表达拟南芥种子的脂肪酸含量显著提高[46]。AhGPAT2能够在花生组织中广泛表达,叶片和花中相对较高,酵母功能互补和烟草异源过表达结果均证明了该基因能够改变或提高FAs含量,同时也改变了各种内源脂代谢基因的转录水平[47]。人们在花生中还鉴定得到一个仅在未成熟种子(子叶)特异表达的AhDGAT3,该基因与DGAT1和DGAT2均不同源,属于可溶性DGAT酶,能够促进重组大肠杆菌中TAG的积累,并且优先选择18:1-CoA为酰基供体[48-49]。与其他已知植物相比,花生AhDGATs家族进化出了独特的功能特性,对这些家族成员的遗传多样性、底物选择性以及生理活性等进行深入研究,可能有助于筛选高油兼具优异脂肪酸配比的油脂性状。
3.4 磷脂:二酰甘油酰基转移酶(PDAT)
不依赖Acyl-CoA的TAG合成是以DAG为酰基受体、磷脂为酰基供体进行的,该途径利用磷脂:二酰甘油酰基转移酶(phospholipid:diacylglycerol acyltransferase,PDAT)催化酰基从PC的sn-2位转移到DAG的sn-3位生成TAG[50]。拟南芥中已鉴定出6个PDAT同系物,其中PDAT1在植物中占大部分PDAT活性。PDAT1可能不是擬南芥TAG合成和积累的直接贡献因素,研究发现单一过表达或敲除AtPDAT1均没有观察到种子TAG和FA含量发生明显变化[51-52];另外,AtPDAT1可能与花粉发育相关,atdgat1-1/atpdat1-2基因型双突变能导致不育花粉内缺乏可见油体,种子含油量减少70%~80%,这就表明AtPDAT1和AtDGAT1对花粉活力和种子发育存在功能重叠,并且在TAG合成中PDAT途径和DGAT途径可能具有协同作用[41]。
不同植物的PDAT表达方式差异明显,活性研究表明,该酶可能在多不饱和或独特FAs的积累中发挥重要作用[50]。向日葵HaPDATs主要在种子发育后期表达,其中HaPDAT1c能够恢复酵母突变体H1246细胞TAG的生物合成能力[53]。油菜BnPDAT1基因表达和种子TAG含量变化没有明显的直接关系,但高含油品系中的表达丰度显著高于低含油品系[54]。花生全基因组生物信息学分析研究显示,AhPDATs家族包含17个成员,系统进化上分为5个亚组,这些基因的组织时空表达模式差异明显,并且存在丰富的可变剪接基因型[55]。目前已分离获得AhPDAT1和AhPDAT2,荧光定量结果显示AhPDAT1在花生种子中表达量最高,AhPDAT2在花生下胚轴中表达量最高,2个基因分别在果针入土后60 d和36 d的表达量远高于其余各时期,此外基因表达受干旱、高盐、低温等9类非生物胁迫诱导,暗示了AhPDATs对花生油脂合成和抗逆的正面调控作用[56]。
4 展望
大量遗传分析研究表明,花生油脂合成是受多基因控制的数量性状遗传,单一改变某个基因的表达水平很难精准调控最终的油脂含量及其组分。随着不同物种脂代谢的深入研究,人们对花生油脂合成中区室化途径的相对贡献以及关键限速酶基因的鉴定也有了积极的进展,但是主要集中在相关基因家族的克隆、表达和生物学功能初探,TAG合成网络的多基因调控关系依然不明确。另外,单一的Kennedy途径对花生TAG合成的贡献率如何,PC在多大程度上参与了超长链饱和脂肪酸或其他未在内质网中修饰的脂肪酸的酰基转移,以及TAG合成中每一步酯化反应对酰基通量的需求等,这些问题的解决有助于更全面地了解花生油脂合成及其脂肪酸组成的机制。囿于技术限制和安全风险,目前通过基因工程手段来改良花生优异性状还无法大规模实现。尽管如此,随着人们对花生油脂代谢不断深入了解,对于今后花生油脂性状的精准鉴定和创新利用具有重要意义。
參考文献:
[1]Seijo J G,Lavia G I,Fernández A,et al. Physical mapping of the 5S and 18S-25S rRNA genes by FISH as evidence that Arachis duranensis and A. ipaensis are the wild diploid progenitors of A. hypogaea (Leguminosae)[J]. American Journal of Botany,2004,91(9):1294-1303.
[2]廖伯寿,殷 艳,马 霓. 中国油料作物产业发展回顾与展望[J]. 农学学报,2018,8(1):107-112.
[3]Janila P,Nigam S N,Pandey M K,et al. Groundnut improvement:use of genetic and genomic tools[J]. Frontiers in Plant Science,2013,4:23.
[4]Jung S,Swift D,Sengoku E,et al. The high oleate trait in the cultivated peanut (Arachis hypogaea L.). Ⅰ. Isolation and characterization of two genes encoding microsomal oleoyl-PC desaturases[J]. Molecular & General Genetics,2000,263(5):796-805.
[5]赵春江,李 瑾,冯 献. 面向2035年智慧农业发展战略研究[J]. 中国工程科学,2021,23(4):1-9.
[6]Food and Agriculture Organization of the United Nations. FAOSTAT Database:2019—2020[EB/OL]. [2022-11-20]. https://www.fao.org/faostat.
[7]Bates P D,Browse J. The significance of different diacylgycerol synthesis pathways on plant oil composition and bioengineering[J]. Frontiers in Plant Science,2012,3:147.
[8]Bates P D,Stymne S,Ohlrogge J. Biochemical pathways in seed oil synthesis[J]. Current Opinion in Plant Biology,2013,16(3):358-364.
[9]Xu C C,Shanklin J. Triacylglycerol metabolism,function,and accumulation in plant vegetative tissues[J]. Annual Review of Plant Biology,2016,67(1):179-206.
[10]Bates P D. Understanding the control of acyl flux through the lipid metabolic network of plant oil biosynthesis[J]. Molecular and Cell Biology of Lipids,2016,1861(9):1214-1225.
[11]Chapman K D,Ohlrogge J B. Compartmentation of triacylglycerol accumulation in plants[J]. The Journal of Biological Chemistry,2012,287(4):2288-2294.
[12]Li-Beisson Y,Shorrosh B,Beisson F,et al. Acyl-lipid metabolism[J]. The Arabidopsis Book,2013,11:e0161.
[13]Chen G Q,Woodfield H K,Pan X,et al. Acyl-trafficking during plant oil accumulation[J]. Lipids,2015,50(11):1057-1068.
[14]Li N N,Gügel I L,Giavalisco P,et al. FAX1,a novel membrane protein mediating plastid fatty acid export[J]. PLoS Biology,2015,13(2):e1002053.
[15]Lu C F,Xin Z G,Ren Z H,et al. An enzyme regulating triacylglycerol composition is encoded by the ROD1 gene of Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(44):18837-18842.
[16]Lee J,Welti R,Schapaugh W T,et al. Phospholipid and triacylglycerol profiles modified by PLD suppression in soybean seed[J]. Plant Biotechnology Journal,2011,9(3):359-372.
[17]Stymne S,Stobart A K. Evidence for the reversibility of the acyl-CoA:lysophosphatidylcholine acyltransferase in microsomal preparations from developing safflower (Carthamus tinctorius L.) cotyledons and ratliver[J]. Biochemical Journal,1984,223(2):305-314.
[18]禹山林. 中国花生遗传育种学[M]. 上海:上海科学技术出版社,2011:29-33.
[19]廖伯寿. 中国花生油脂产业竞争力浅析[J]. 花生学报,2003,32(增刊1):11-15.
[20]姜慧芳,任小平,王圣玉,等. 野生花生高油基因资源的发掘与鉴定[J]. 中国油料作物学报,2010,32(1):30-34.
[21]万勇善,谭 忠,范 晖,等. 花生脂肪酸组分的遗传效应研究[J]. 中国油料作物学报,2002,24(1):27-29.
[22]姜慧芳,段乃雄. 花生油脂品质及含油量、油酸和亚油酸含量间的相关分析[J]. 花生科技,1993(2):5-6.
[23]Nepote V,Olmedo R H,Mestrallet M G,et al. A study of the relationships among consumer acceptance,oxidation chemical indicators,and sensory attributes in high-oleic and normal peanuts[J]. Journal of Food Science,2009,74(1):1-8.
[24]Chen X,Snyder C L,Truksa M,et al. sn-Glycerol-3-phosphate acyltransferases in plants[J]. Plant Signaling & Behavior,2011,6(11):1695-1699.
[25]Yang W L,Simpson J P,Li-Beisson Y,et al. A land-plant-specific glycerol-3-phosphate acyltransferase family in Arabidopsis:substrate specificity,sn-2 preference,and evolution[J]. Plant Physiology,2012,160(2):638-652.[HJ1.7mm]
[26]Singer S D,Chen G Q,Mietkiewska E,et al. Arabidopsis GPAT9 contributes to synthesis of intracellular glycerolipids but not surface lipids[J]. Journal of Experimental Botany,2016,67(15):4627-4638.
[27]Payá-Milans M,Venegas-Calerón M,Salas J J,et al. Cloning,heterologous expression and biochemical characterization of plastidial sn- glycerol-3-phosphate acyltransferase from Helianthus annuus[J]. Phytochemistry,2015,111:27-36.
[28]Sun S K,Yang N N,Chen L J,et al. Characterization of LpGPAT gene in Lilium pensylvanicum and response to cold stress[J]. BioMed Research International,2015,2015:792819.
[29]Chi X,Yang Q,Pan L,et al. Isolation and expression analysis of glycerol-3-phosphate acyltransferase genes from peanuts (Arachis hypogaea L.)[J]. Grasasy Aceites,2015,66(3):e093.
[30]郝翠翠,梁成偉,石 蕾,等. 花生甘油-3-磷酸酰基转移酶(GPAT)基因的克隆及表达分析[J]. 花生学报,2018,47(1):1-10.
[31]Lv Y Y,Zhang X R,Luo L,et al. Characterization of glycerol-3-phosphate acyltransferase 9 (AhGPAT9) genes,their allelic polymorphism and association with oil content in peanut (Arachis hypogaea L.)[J]. Scientific Reports,2020,10(1):14648.
[32]Shockey J,Regmi A,Cotton K,et al. Identification of Arabidopsis GPAT9 (At5g60620) as an essential gene involved in triacylglycerol biosynthesis[J]. Plant Physiology,2016,170(1):163-179.
[33]Krbes A P,Kulcheski F R,Margis R,et al. Molecular evolution of the lysophosphatidic acid acyltransferase (LPAAT) gene family[J]. Molecular Phylogenetics and Evolution,2016,96:55-69.
[34]Kim H U,Huang A H C. Plastid lysophosphatidyl acyltransferase is essential for embryo development in Arabidopsis[J]. Plant Physiology,2004,134(3):1206-1216.
[35]Kim H U,Li Y H,Huang A H C. Ubiquitous and endoplasmic reticulum-located lysophosphatidyl acyltransferase,LPAT2,is essential for female but not male gametophyte development in Arabidopsis[J]. The Plant Cell,2005,17(4):1073-1089.
[36]Chi X Y,Dong F,Yang Q L,et al. Expression and characterization of lysophosphatidyl acyltransferase genes from peanut (Arachis hypogaea L.)[J]. Research on Crops,2014,15(1):141-153.
[37]Chen S L,Huang J Q,Lei Y,et al. Cloning and expression analysis of lysophosphatidic acid acyltransferase (LPAT) encoding gene in peanut[J]. Acta Agronomica Sinica,2012,38(2):245-255.
[38]Chen S L,Lei Y,Xu X,et al. The peanut (Arachis hypogaea L.) gene AhLPAT2 increases the lipid content of transgenic Arabidopsis seeds[J]. PLoS One,2017,10(8):e0136170.
[39]Chen S L,Huang J Q,Lei Y,et al. Identification and characterization of a gene encoding a putative lysophosphatidyl acyltransferase from Arachis hypogaea[J]. Journal of Biosciences,2012,37(6):1029-1039.
[40]Jako C,Kumar A,Wei Y,et al. Seed-specific over-expression of an Arabidopsis cDNA encoding a diacylglycerol acyltransferase enhances seed oil content and seed weight[J]. Plant Physiology,2001,126(2):861-874.
[41]Zhang M,Fan J L,Taylor D C,et al. DGAT1 and PDAT1 acyltransferases have overlapping functions in Arabidopsis triacylglycerol biosynthesis and are essential for normal pollen and seed development[J]. The Plant cell,2009,21(12):3885-3901.
[42]Tan W J,Yang Y C,Zhou Y,et al. Diacylglycerol acyltransferase and diacylglycerol kinase modulate triacylglycerol and phosphatidic acid production in the plant response to freezing stress[J]. Plant Physiology,2018,177(3):1303-1318.
[43]Liu Q,Siloto R M P,Lehner R,et al. Acyl-CoA:diacylglycerol acyltransferase:molecular biology,biochemistry and biotechnology[J]. Progress in Lipid Research,2012,51(4):350-377.
[44]Jin Y H,Yuan Y J,Gao L C,et al. Characterization and functional analysis of a type 2 diacylglycerol acyltransferase (DGAT2) gene from oil palm (Elaeis guineensis Jacq.) mesocarp in Saccharomyces cerevisiae and transgenic Arabidopsis thaliana[J]. Frontiers in Plant Science,2017,8:1791.
[45]Zheng Y S,Jin Y H,Yuan Y J,et al. Identification and function analysis of a type 2 diacylglycerol acyltransferase (DGAT2) from the endosperm of coconut (Cocos nucifera L.)[J]. Gene,2019,702:75-82.
[46]Zheng L,Shockey J,Guo F,et al. Discovery of a new mechanism for regulation of plant triacylglycerol metabolism:the peanut diacylglycerol acyltransferase-1 gene family transcriptome is highly enriched in alternative splicing variants[J]. Journal of Plant Physiology,2017,219:62-70.
[47]Zheng L,Shockey J,Bian F,et al. Variant amino acid residues alter the enzyme activity of peanut type 2 diacylglycerol acyltransferases[J]. Frontiers in Plant Science,2017,8:1751.
[48]Saha S,Enugutti B,Rajakumari S,et al. Cytosolic triacylglycerol biosynthetic pathway in oilseeds. Molecular cloning and expression of peanut cytosolic diacylglycerol acyltransferase[J]. Plant Physiology,2006,141(4):1533-1543.
[49]Chi X Y,Hu R B,Zhang X W,et al. Cloning and functional analysis of three diacylglycerol acyltransferase genes from peanut (Arachis hypogaea L.)[J]. PLoS One,2017,9(9):e105834.
[50]Dahlqvist A,Stahl U,Lenman M,et al. Phospholipid:diacylglycerol acyltransferase:an enzyme that catalyzes the acyl-CoA-independent formation of triacylglycerol in yeast and plants[J]. Proceedings of the National Academy of Sciences of the United States of America,2000,97(12):6487-6492.
[51]Stahl U,Carlsson A S,Lenman M,et al. Cloning and functional characterization of a phospholipid:diacylglycerol acyltransferase from Arabidopsis[J]. Plant Physiology,2004,135(3):1324-1335.
[52]Mhaske V,Beldjilali K,Ohlrogge J,et al. Isolation and characterization of an Arabidopsis thaliana knockout line for phospholipid:diacylglycerol transacylase gene (At5g13640)[J]. Plant Physiology and Biochemistry,2005,43(4):413-417.
[53]张 程,董帅飞,朱 艺,等. 向日葵PDAT基因家族鉴定及其对油脂积累和非生物胁迫的响应[J]. 植物生理学报,2022,58(5):844-856.
[54]谭太龙,冯 韬,罗海燕,等. 甘蓝型油菜磷脂二酰甘油酰基轉移酶(BnPDAT1)表达特性研究[J]. 华北农学报,2019,34(1):12-18.
[55]田海莹,单 雷,李新国,等. 花生PDAT基因家族的全基因组生物信息学分析[J]. 花生学报,2018,47(3):1-7.
[56]徐 赫,潘丽娟,陈 娜,等. 磷脂二酰甘油酰基转移酶(PDAT)基因的克隆与表达分析[J]. 花生学报,2018,47(4):33-40.
收稿日期:2022-12-20
基金项目:国家自然科学基金(编号:31701461);江苏省农业科技自主创新资金[编号:CX(20)3121];江苏省种业振兴“揭榜挂帅”项目[编号:JBGS(2021)062];国家现代农业产业技术体系建设专项(编号:CARS-13)。
作者简介:沈 悦(1986—),女,江苏宜兴人,博士,助理研究员,主要从事花生遗传育种与分子生物学研究。E-mail:syjaas@163.com。
通信作者:陈志德,博士,研究员,主要从事花生资源与遗传育种研究。E-mail:chen701865@aliyun.com。

