KIF22 在肾透明细胞癌中的表达及临床相关性研究
张春锋,李长建,刘沛,吴春磊
(1.新乡医学院第一附属医院泌尿外科,卫辉 453100;2.新乡医学院第三附属医院泌尿外科,新乡 453000)
肾细胞癌(renal cell carcinoma,RCC)在全世界范围内每年导致超过330 000 例被诊断的病例与大约140 000 例死亡病例,并且近数十年来,其发生率一直在不断增加。仅仅是在2018 年,全美新确诊的肾脏癌症患者就超过65 340 人,而与肾癌有关的死亡人数也达到了14 970 人[1]。在肾细胞癌的患者中,男性患者的数量是女性的1.5~2.0 倍,而高发年龄范围是60~70 岁[2]。肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是肾细胞癌中最常见的一种亚型,占到了75%~80%[3]。早期ccRCC 的治愈率高,5年以上生存率达90%以上[4]。与此相反,晚期远处移患者的5 年生存率则下降到了12%[5]。但是,近几年来,随着研究的不断深入和认知水平的提高,人们对该疾病的治疗近年来取得了重大进展。
Kinesin 家族蛋白是基于微管的马达蛋白家族。Aiken 等[6]首次报道了巨乌贼轴突中的Kinesin 家族蛋白。随后,在不同的生物组织中均发现kinesin 蛋白,如哺乳动物神经细胞、海胆卵和果蝇细胞[7-8]。Kinesin 家族成员22(Kinesin family member 22,KIF22)能够与微管和染色体结合,从而运输细胞器、蛋白质和mRNA[8]。KIF22 蛋白已被报道影响多种肿瘤的发生、发展,如乳腺癌、肺癌、前列腺癌等,并与这些肿瘤的不良预后密切相关[9-14]。然而,针对ccRCC 而言,KIF22 在其中的表达水平和作用仍有待进一步研究。本研究主要探究ccRCC 组织中KIF22 蛋白的表达,从而为在ccRCC 的治疗寻找新的靶点。
1 材料和方法
1.1 生信分析 应用GEPIA 在线数据库和pro teinatlas 在线数据库提取KIF22 在不同器官癌症组织中的表达(http://gepia.cancer-pku.cn/detail.php?gene=KIF22;https://www.proteinatlas.org/EN SG00000079616-KIF22/pathology),并对其生物信息进行分析。利用这些数据库信息分析ccRCC 的表达差异以及这种表达差异与疾病预后的关系,并利用Kaplan-Meier 曲线比较生存期。
1.2 组织收集 为了探索KIF22 与ccRCC 发生、发展之间的潜在关系,本研究从接受手术治疗的患者中收集了77 例ccRCC 组织及其对应的癌旁组织。本研究收集我院从2012 年1 月—2018 年12 月的ccRCC 手术患者的肿瘤组织和癌旁组织。这些标本的来源中有男性44 例,女性33 例,年龄40~74 岁,平均52.6 岁,其中肿瘤病理高中分化40例,低分化37 例。选择诊断为ccRCC,无全身广泛远处转移,并无手术切除禁忌且有手术切除适应症的患者,术后均经病理证实为ccRCC。排除标准:有病理证实并非ccRCC 或存在第2 种原发肿瘤或存在全身广泛转移或全身情况存在手术切除禁忌等。
1.3 免疫组化实验 将肿瘤组织用10%的中性缓冲福尔马林固定24 h 后进行石蜡包埋,之后将石蜡包埋的组织切片在75℃加热30 min 后用二甲苯溶液浸泡10 min,再放入100%、95%、85%和75%乙醇中各5 min。随后进行免疫组织化学染色。免疫组织化学检测方法主要根据免疫组织化学检测规范(Cell Signaling Technology,Danvers,Massachusetts,USA)。将切片标本在PBS 缓冲液中洗涤2 次,每次2 min,在柠檬酸盐缓冲液中进行抗原修复并用3%H2O2灭活内源性过氧化物酶后,将切片用2%牛丝氨酸白蛋白在PBS 中浸泡20 min,并与抗KIF22 抗体(thermo fisher scientific,Waltham,MA,USA,1∶200)一起孵化,在4℃环境下过夜。
次日,将切片室温放置1 h,用PBS 缓冲液洗涤2 次,每次2 min。室温下辣根过氧化物酶标记二抗(Sanying,China,1∶1 000)孵育1 h,用二氨基苯胺(DAB,Cell Signaling Technology,Pudong,Shanghai,China)洗涤染色5 min,最后用中性树胶封片后在显微镜(Nikon,Tokyo,Japan)下观察。
本研究进一步根据染色面积和染色强度对KIF22 表达进行评分。无颜色为0 分,浅黄色为1分,棕色为2 分,深棕色为3 分。每个视野下0 分是阴性,1~4 分是弱阳性,5~8 分是阳性,9~12 分是强阳性。在本研究中,本研究将KIF22 的阳性表达分为低表达(阴性和弱阳性)和高表达(阳性和强阳性)。结果用双盲法判断。
1.4 统计学处理 数据采用SPSS 22.0 软件(SPSS Inc,IBM Corp,Armonk,NY)进行分析,并通过χ2检验比较临床特征与蛋白表达之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 KIF22 在多种肿瘤组织中表达上调研究显示,KIF22 在不同的肿瘤组织中的表达上调,且与肿瘤的预后密切相关。本研究利用proteinatlas 数据库和GEPIA 在线数据库对来自不同组织器官的肿瘤细胞中的KIF22 表达情况进行研究。
在proteinatlas 数据库之中,本研究选取了包括肾癌在内的17 种不同类型的肿瘤加入到了此次生物信息学分析之中,根据肿瘤基因组ALTAS(TCGA)的数据库分析其中KIF22 基因的RNA 表达。结果显示,KIF22 基因的RNA 表达水平出现明显较高者,且RNA 表达的特异性较低(图1)。

图1 KIF22 基因的RNA 表达在多种癌细胞中呈低特异性Fig 1 The RNA expression of KIF22 gene shows low specificity in a variety of cancer cells
而在GEPIA 数据库中,本研究选取包括肾癌在内的20 种肿瘤结果显示有大部分肿瘤细胞KIF22表达水平较高。在甲状腺癌、结肠癌和头颈部肿瘤的肿瘤细胞中,KIF22 表达较高。然而,在淋巴瘤、子宫内膜癌与肺癌等中KIF22 表达较低,皮肤癌中KIF22 不表达。肾癌中KIF22 的表达水平不高,但依然具有一定的提示价值(图2)。
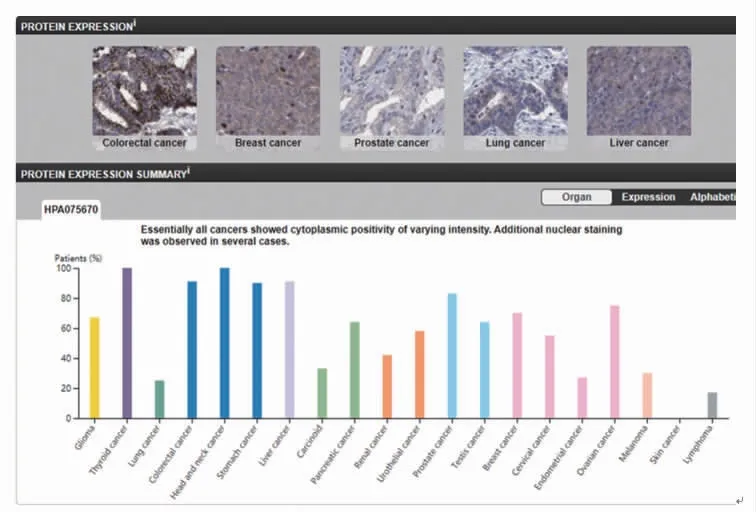
图2 KIF22 基因在不同肿瘤组织中的表达上调Fig 2 The expression of KIF22 gene was up-regulated in different tumor tissues
2.2 KIF22 的表达与ccRCC 患者不良预后相关 本研究利用GEPIA 数据库对KIF22 与ccRCC 患者预后进行了Kaplan-Meier 生存分析,发现KIF22 的表达水平与患者的预后不良相关。在研究KIF22 高表达患者的疾病总生存期时,选择GEPIA数据库516 例患者,高表达与低表达患者各258 例,研究结果显示KIF22 高表达的患者总生存期低于低表达的患者(P=0.012,图3)。而在研究无病生存期时,收录的患者数为517 例,高表达患者52 例,低表达患者465例,结果为KIF22 高表达患者的无病生存期显著低于KIF22 低表达的患者(P=0.047,图3)。
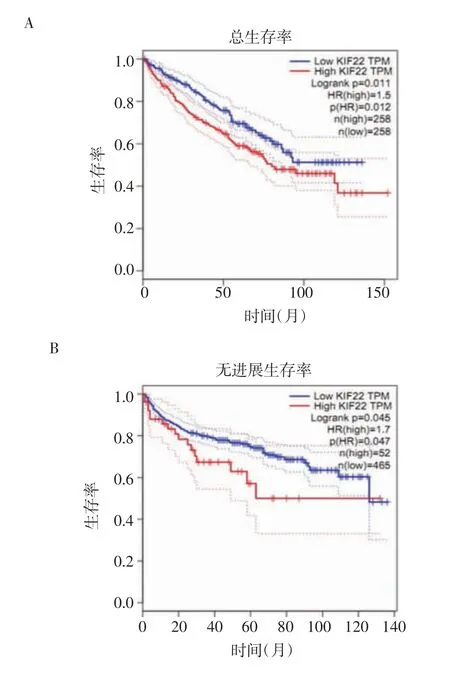
图3 KIF22高表达及低表达患者的疾病总生存期和无进展生存期比较Fig 3 Overall disease survival and disease free survival in patients with high and low expression of KIF22
2.3 KIF22 在ccRCC 中高表达 本研究首先通过对ccRCC 肿瘤样本中的KIF22 进行免疫组化染色,发现KIF22 主要位于ccRCC 组织的细胞核中(图4A)。而根据染色结果发现,与肿瘤组织相比,KIF22在癌旁组织中的表达较低(图4B)。

图4 免疫组化检测KIF22 在ccRCC 患者肿瘤样本中的表达水平Fig 4 The expression level of KIF22 in tumor samples of renal clear cell carcinoma was determined by immunohistochemistry
2.4 KIF22 的表达与ccRCC 患者的临床特征相关性 本研究进一步对于KIF22 的染色强度进行评分,并由此分析了KIF22 高、低表达患者的临床病理特征差异。数据显示,ccRCC 中KIF22 的表达与ccRCC 肿瘤直径(P=0.010)具有显著相关性,但KIF22 的表达与其他临床特征,如患者年龄、性别、肿瘤分化程度等特征无显著相关性(表1)。

表1 77 例ccRCC 患者的KIF22 表达和临床病理特征的关系Tab 1 Correlation between KIF22 expression and clinicopathologic features in 77 patients with renal clear cell carcinoma
3 讨论
目前ccRCC 的治疗主要以手术为主。尽管医学技术在不断提高,但其实总体治疗效果仍不尽如人意。行根治性肾切除术的患者仍有30%~40%复发[15]。且虽然无转移患者的5 年生存率可较高,但有转移的晚期患者的预后明显较差[4-5]。这一结果的部分原因是缺乏可用的治疗靶点。因此,ccRCC 靶向化疗药物的选择非常重要。
此前广泛的研究证明,KIF22 是一种马达蛋白,能够调控多种重要的细胞过程,如细胞分裂、细胞迁移中的物质运输与重新分布、纤毛发生等[16]。这种马达蛋白基于微管的功能可能直接对于肿瘤细胞的增殖、迁移及侵袭等产生重要影响。也有报道证实KIF22 可对多种信号通路产生影响,比如其受SIAH-1 调控[13]。另外,KIF22 与微管结合,而微管在受体转运中起重要作用,这些受体即包括EGFR[17-18]。KIF22 调控微管稳定性,上调EGFR 信号通路,刺激细胞分裂,进一步对肿瘤细胞的异常增殖产生影响[19]。而且此前文献报道,KIF22 还能够参与纺锤体的形成及有丝分裂过程中的染色体运动,这暗示其可能也会通过影响ccRCC 细胞分裂而影响其发展。
研究显示,KIF22 参与肿瘤的发生、发展[13]。在Yu 等[9]的报道中提及,抑制KIF22 能够抑制肿瘤细胞的有丝分裂,进而使得肿瘤细胞的增殖能力降低。他们同时发现KIF22 在多种肿瘤组织中均有高表达。为了进一步研究KIF22 与肿瘤发生的关系,他们在癌基因数据库中分析几种肿瘤中的KIF22表达,证实KIF22 在卵巢癌、肺癌和宫颈癌中有高表达[9]。Zhang 等[14]检测62 个原发性乳腺癌组织和成对邻近正常组织中KIF22 表达水平,结果显示,与邻近组织相比,肿瘤组织KIF22 的表达均显著上调。而本研究同样发现KIF22 在多种肿瘤中出现表达上调的情况,且进一步研究发现,表达上调与ccRCC 患者的不良预后有关,提示KIF22 可能参与了ccRCC 的发生和发展,也提示KIF22 可以作为ccRCC 新的治疗靶点。
在生信分析中本研究发现了KIF22 在ccRCC中的高表达,KIF22 与ccRCC 患者的预后相关。而在接下来的研究中,本研究收集了77 个ccRCC 组织和邻近正常组织标本检测KIF22 的表达水平,其结果为KIF22 在ccRCC 组织中高表达。之后,本研究又通过结合患者临床信息分析肿瘤组织中KIF22的表达水平,发现KIF22 的表达水平与ccRCC 肿瘤组织直径存在一定联系。先前Liu 等[20]的研究也报道,KIF22 在肿瘤的生长中发挥了重要作用。Pike 等[19]研究表明,KIF22 的下调会显著抑制肿瘤细胞的增殖,从而进一步抑制相关肿瘤的发展。而本研究的研究数据表明,KIF22 参与了ccRCC 的发生、发展的调控过程。
综上所述,本研究主要发现了KIF22 在ccRCC细胞中显著高表达,并与患者的不良预后紧密相关。KIF22 与肿瘤直径、患者的不良预后显著相关。所以,KIF22 基因可能在ccRCC 的发生、发展中起到了不可忽略的作用。
然而,本研究中存在了一定的局限。首先,本研究预后分析使用的数据库为公共数据库,而非本研究单位组建。其次,本研究的实验样本较少,缺乏多中心大样本研究的实验数据支持。再次,本研究在KIF22 的作用机制上研究较浅,在ccRCC 中的表达水平和作用仍有待进一步研究。
——水芹主要害虫识别与为害症状

