Ce0.8Cu0.2O2 氧载体耦合S-1 分子筛对化学链反应性能的影响
侯凯源 ,王禹皓 ,蒋丽红 ,范浩熙 ,郑燕娥,2,*
(1. 昆明理工大学 化学工程学院, 云南 昆明 650093;2. 昆明理工大学 复杂有色金属资源清洁利用国家重点实验室, 云南 昆明 650093;3. 昆明理工大学 冶金与能源工程学院, 云南 昆明 650093)
在过去的几十年中,由于全球人口的增长 ,世界对能源的需求显著增加,然而能源的很大一部分仍然由石油、天然气和煤炭组成的化石燃料来满足[1]。化石燃料的使用导致温室气体(主要是CO2)排放激增。CO2减排已经成为各个国家在治理环境问题的重中之重,制约着社会和经济的发展[2]。因此,有必要开发一种高效的技术,将CO2转化为有价值的化学品 。
近年来,化学链甲烷重整制合成气的工艺得到了众多研究学者的关注。该技术主要分为两个反应阶段进行,不仅可以获得理想比例的合成气(2H2+ CO),而且反应条件较为温和且不需要配备复杂的气体分离装置,是一种前景广阔的甲烷制合成气技术[3]。此外,该技术第二阶段(氧化阶段)以空气、水蒸气、CO2等作为氧化剂,为第一阶段中被还原的氧载体MeOx-δ提供氧源。该技术主要包含以下两个步骤:
这一反应流程的关键在于金属氧载体的储放氧能力。目前的研究发现,在氧载体中添加贵金属可以有效地提高反应活性,但是贵金属的高昂价格并不适合用于工业生产,而低成本的过渡金属氧化物可以有效地解决这一问题[4-13]。在多价金属氧化物体系中,多价金属的掺入以及掺杂金属离子半径的不兼容性必然导致晶体结构的改变或晶格畸变,从而发生表面氧化还原性能、酸碱度、氧迁移率的改善[14,15]。CeO2具有较高的储氧能力,是一种很有前景的储氧材料,研究发现,Cu 离子的掺杂可以改变铈基氧化物的催化性能。Ce 有两种常见价态,分别是Ce3+和Ce4+,氧的储存和释放通过两种价态之间的相互转换得以实现[16]。而Cu 离子比较稳定的价态有 + 1 和 + 2价,Cu2+/Cu+电子对的加入,进一步提高了氧载体的氧迁移效率和储放氧性能[17-20]。之后尝试在铈铜氧载体中引入了全硅分子筛(S-1 分子筛),发现具有高比表面积和微孔孔道的S-1 分子筛的加入可以提高Ce0.8Cu0.2O2/S-1 复合氧载体的比表面积、表面活性氧浓度以及反应活性[21]。
分子筛具有较高的比表面积,常常作为活性组分的载体。相比于其他类型的分子筛, S-1 由于骨架中铝原子缺失,几乎没有酸性,其作为载体材料避免了分子筛酸碱性对反应性能的干扰。由于Si 元素在分子结构中呈现四价稳定形态,所以具有较高的化学稳定性和热稳定性。考虑将S-1 分子筛与铈基氧载体进行功能耦合,构筑出新型的Ce0.8Cu0.2O2/S-1 复合氧载体,并应用到化学链重整反应中,S-1 分子筛的引入在化学链领域中尚属首次。
本研究采用机械混合法分别将不同质量的S-1 分子筛与Ce0.8Cu0.2O2氧载体混合。系统研究S-1 分子筛与Ce0.8Cu0.2O2氧载体的配比在甲烷化学链重整反应中的影响,同时使用一系列表征技术对样品的形貌与微观结构进行表征,最终通过恒温反应、redox 循环反应等技术对系列样品的反应性能和循环稳定性进行全面的判断。
1 实验部分
1.1 材 料
六水合硝酸铈(Ce(NO3)3·6H2O,分析纯),三水合硝酸铜(Cu(NO3)2·3H2O,分析纯),柠檬酸(C6H8O7·H2O,分析纯)均由阿拉丁试剂有限公司提供;四丙基氢氧化铵(C12H29NO,50%)由国药集团化学试剂有限公司提供;正硅酸四乙酯((C2H5)4SiO4,分析纯),由上海泰坦科技股份有限公司提供;氮气,纯度>99.999%, 5% CH4/N2混合气,10% CO2/N2混合气,纯度>99.99%,均由梅塞尔格里斯海姆(昆明)气体产品有限公司提供。
1.2 分析测试仪器
X 射线衍射光谱分析(XRD),仪器型号X'Pert3Powder。X 射线光电子能谱分析(XPS),仪器型号ESCALAB 250Xi。比表面积测试(BET),仪器型号NOVA 4200e。扫描电子显微镜(SEM),仪器型号Zeiss,Gemini300。透射电子显微镜(TEM),仪器型号Talos F200X G2。GASBOARD-3100 型气体分析仪。
1.3 氧载体的制备
采用溶胶凝胶法制备Ce0.8Cu0.2O2氧载体,按照一定物质的量比计算并称取Ce(NO3)3·6H2O、Cu(NO3)2·3H2O 和C6H8O7·H2O,加入适量去离子水配制成前驱体溶液。然后将其放置于水浴锅中剧烈搅拌,直到产物成胶状。之后,将胶状产物放入烘箱干燥24 h 获得前驱体。最后把前驱体放入马弗炉中焙烧,制得所需氧载体。
1.4 分子筛的制备
利用微波合成法制备S-1 分子筛。按照一定的物质的量比称量四丙基氢氧化铵与去离子水混合,在室温(25 ℃)水浴中搅拌并缓慢滴加正硅酸乙酯,滴加结束后持续搅拌至溶液澄清。之后,将搅拌后的液体转移到微波反应器中,反应生成白色沉淀物。经过多次离心洗涤后,将产物放入烘箱中干燥,得到前驱体置于马弗炉中焙烧,制得S-1 分子筛。
1.5 氧载体耦合分子筛样品制备
通过机械混合法按照1.6∶0.1、1.6∶0.2、1.6∶0.3、1.6∶0.4 的质量比分别制备Ce0.8Cu0.2O2/xg S-1(x=0.1、0.2、0.3、0.4)氧载体。按比例称取所需的氧载体和分子筛,将两种样品在玛瑙研钵中研磨混合均匀,然后压片、造粒,筛选出尺寸为20-40 目的颗粒以作备用。
1.6 氧载体活性评估
氧载体的活性评价实验在固定床反应设备上进行,主要有进气系统、反应系统和检测系统,如图1 所示。进气系统通过阀门控制气瓶开关,转子流量计控制气速。反应系统采用GLS-1100 型管式炉(来自合肥科晶材料技术有限公司)进行温度控制,氧载体放置于内径为8 mm 的石英管反应器中部。检测系统通过气体分析仪对尾气中各气体含量进行在线检测。
2 结果与讨论
图2为S-1 分子筛、Ce0.8Cu0.2O2氧载体和引入不同比例S-1 分子筛的Ce0.8Cu0.2O2氧载体的XRD谱图和氮气吸附-脱附等温曲线。由图2 可知,CeO2的谱峰位于28.7 °、33.5 °、47.8 °、56.7 °、59.3 °、69.8 °、77.1 °和79.2 °八个位置,表现出明显的立方萤石型结构。在35.5 °、38.7 °、48.8 °的谱峰归属于CuO 的特征衍射峰,能看出峰的强度很弱,这是因为一部分Cu 离子进入了CeO2晶格中形成Ce-Cu-O 固溶体或CuO 在CeO2的表面以无定形状态分散[22]。

图2 氧载体的XRD 谱图(a)和新鲜氧载体的氮气吸附-脱附等温曲线(b)Figure 2 XRD patterns (a) of oxygen carriers and nitrogen adsorption-desorption (b) isotherms of oxygen carriers
随着S-1 分子筛引入比例的提高,S-1 分子筛的谱峰逐渐显现并增强,与纯Ce0.8Cu0.2O2样品相比,S-1 分子筛修饰后的Ce0.8Cu0.2O2氧载体衍射角度并未发生明显的位移,说明Ce0.8Cu0.2O2氧载体的晶体结构未发生明显改变[23]。
图2(b)显示了Ce0.8Cu0.2O2样品以及引入不同比例S-1 分子筛的Ce0.8Cu0.2O2样品的氮气吸附-脱附等温曲线。由图2(b)可知,所有样品的吸附-脱附等温曲线都属于Ⅳ型等温线,属于介孔结构。在0.4-1.0 的压力下,出现了H3 滞后环,说明孔道是由片状物堆积出的楔形孔。表1列出了各样品的平均孔径、比表面积和孔容。随着S-1 分子筛的增加,孔容没有出现明显变化,孔径由28.38 nm降低为6.62 nm,而比表面积明显增加,由15.44 m2/g增大至79.00 m2/g,这表明S-1 分子筛的加入有助于增大复合氧载体的比表面积,一般来说,组分相同的情况下,复合氧载体的比表面积越大,活性组分分散越好,催化活性越高[24]。
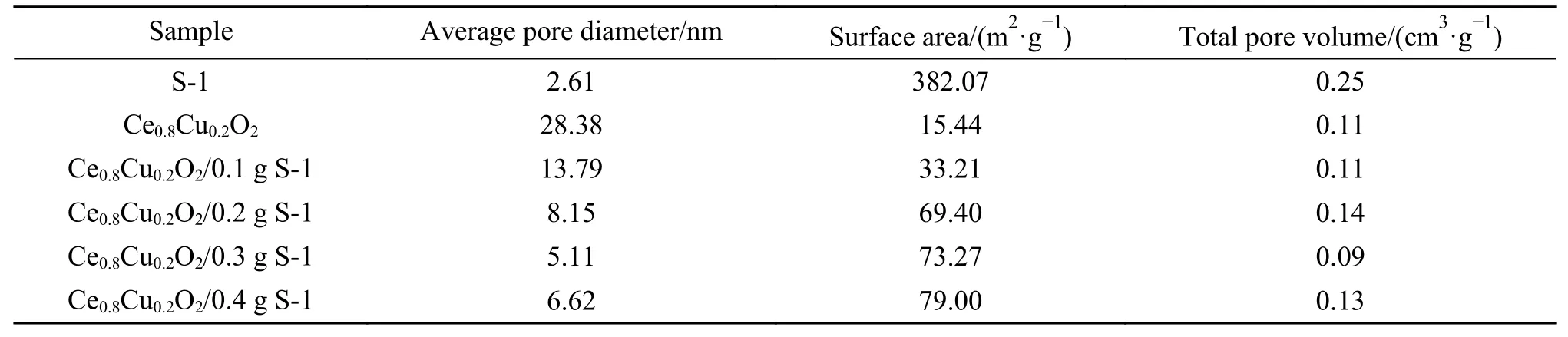
表1 Ce0.8Cu0.2O2 样品和耦合不同比例S-1 分子筛的Ce0.8Cu0.2O2 样品的平均孔径、比表面积和孔容Table 1 Average pore diameter, BET surface area and total pore volume of Ce0.8Cu0.2O2 samples and Ce0.8Cu0.2O2 samples coupled with different proportions of S-1 zeolites
为了研究各样品表面的元素价态及含量进行了XPS 表征,如图3 所示。在图3 中,Ce0.8Cu0.2O2、Ce0.8Cu0.2O2/0.2 g S-1 和Ce0.8Cu0.2O2/0.3 g S-1 氧载体的O 1s谱图都有三个峰,即结合能位于532.70、530.59 eV 的峰分别为表面氧或表面吸附氧(Oads),标记为OⅠ和OⅡ;位于529.21 eV 的峰被看作晶格氧(Olatt),标记为OⅢ[25,26]。根据表2 的XPS 特性参数可以看出,S-1 分子筛主要以表面吸附氧为主,因此,加入分子筛后复合氧载体表面的吸附氧物种增多。

表2 样品的XPS 特性参数Table 2 XPS characteristic parameters of sample

图3 Ce0.8Cu0.2O2(a)、Ce0.8Cu0.2O2/0.2 g S-1(b)、Ce0.8Cu0.2O2/0.3 g S-1(c)新鲜氧载体和S-1 的XPS 谱图Figure 3 XPS spectra of Ce0.8Cu0.2O2 (a), Ce0.8Cu0.2O2/0.2 g S-1 (b), Ce0.8Cu0.2O2/0.3g S-1 (c) fresh oxygen carriers and S-1
图3(b)显示了Cu 2p的XPS 谱图,由六个特征峰组成,属于Cu 2p1/2和Cu 2p2/3两个轨道。其中,标记为w和w'的特征峰属于强卫星峰,代表了Cu2+的存在。而标记为p和q的特征峰对应于Cu+,标记为p'和q'的特征峰对应于Cu2+[27]。Cu 的价态分布情况列于表2 中,Ce0.8Cu0.2O2/0.2g S-1 样品的Cu+含量较高,Cu+有助于在CeO2的表面形成氧空位[28],因此,虽然Ce0.8Cu0.2O2/0.2g S-1 复合氧载体的分子筛含量较低,但是其表面吸附氧物种却较高(Oads/ Olatt为2.58),这与其表面含有较多的氧空位有关。然而,表面氧越多,则晶格氧越少,不利于化学链反应的进行,这是由于化学链反应中参与甲烷部分氧化反应的主要是晶格氧。
图3(c)中Ce 3d的XPS 谱图,共由八个峰组成,分别是归属于Ce 3d5/2轨道的v、v'、v''、v'''代表的峰和归属于Ce 3d3/2轨道的u、u'、u''、u''代表的峰。其中,u'和v'可以归属为Ce3+,u、u''、u'''和v、v''、v'''则归属为Ce4+。由表2 可见,Ce0.8Cu0.2O2/0.3 g S-1 样品的Ce3+/Ce4+比值较大,Ce3+在甲烷化学链重整反应中有利于氧空位的形成,从而提高氧迁移率。S-1 分子筛的引入量对峰的位置影响不大,证明S-1 分子筛加入并不会改变氧载体的结构。
通过SEM 技术可以研究氧载体的表面形貌特征,图4 为S-1 分子筛和Ce0.8Cu0.2O2/0.3 g S-1 氧载体的SEM 照片。由图4((a1)、(a2))可以看出,S-1分子筛形状类似六方柱形,分子筛表面较为光滑,尺寸均匀。在图4((b1)、(b2))中,耦合S-1 分子筛的Ce0.8Cu0.2O2氧载体的纳米颗粒可以较好地分散在分子筛表面。分子筛的介入导致样品比表面积较大,氧载体颗粒和分子筛因为堆积产生更多介孔,这与BET 表征相符合。

图4 S-1 分子筛((a1),(a2))以及Ce0.8Cu0.2O2/0.3 g S-1 氧载体((b1),(b2))的SEM 照片Figure 4 SEM images of S-1 ((a1), (a2)) and Ce0.8Cu0.2O2/0.3 g S-1 ((b1), (b2)) oxygen carrier
图5显示了Ce0.8Cu0.2O2氧载体耦合0.3 g S-1分子筛后的透射电镜图。从图5 可以看出,S-1 分子筛表面有一些氧载体颗粒,这些颗粒分散在S-1分子筛表面,抑制了颗粒在高温过程中发生团聚及烧结。由图5(d)可以看出氧载体颗粒的晶格条纹规律排列,结晶度较高。

图5 Ce0.8Cu0.2O2/0.3 g S-1 氧载体的TEM 照片Figure 5 TEM images of Ce0.8Cu0.2O2/0.3 g S-1 oxygen carrier
图6显示了耦合不同比例的S-1 分子筛的Ce0.8Cu0.2O2氧载体和纯S-1 的CH4-TPR 谱图。从图6 可以看出,反应过程分为两个不同的阶段。在400 ℃后CO2的含量开始上升,这是氧载体表面的氧物种将CH4完全氧化产生CO2和H2O。随着反应温度的上升,CO2含量逐渐下降,说明表面氧消耗殆尽。此时,H2和CO 的含量快速上升,这是因为氧载体内部的晶格氧迁移到表面,与CH4发生了部分氧化反应。当温度达到850 ℃时,H2和CO 产量相对较高,且此时的积炭含量最少。

图6 Ce0.8Cu0.2O2 (a)、Ce0.8Cu0.2O2/0.1 g S-1 (b)、Ce0.8Cu0.2O2/0.2 g S-1 (c)、Ce0.8Cu0.2O2/0.3 g S-1 (d)和Ce0.8Cu0.2O2/0.4 g S-1 (e)氧载体和S-1(f)的CH4-TPR 谱图Figure 6 CH4-TPR profiles of Ce0.8Cu0.2O2 (a), Ce0.8Cu0.2O2/0.1 g S-1 (b), Ce0.8Cu0.2O2/0.2 g S-1 (c), Ce0.8Cu0.2O2/0.3 g S-1 (d) and Ce0.8Cu0.2O2/0.4 g S-1 (e) oxygen carriers and S-1(f)
图7 显示了耦合不同比例S-1 分子筛的Ce0.8Cu0.2O2氧载体的CO2-TPO 谱图。由图7 可知,在反应温度350 ℃时,CO 含量开始上升,这表明,氧载体在CO2中获得氧原子,对自身进行补氧。反应温度升至500 ℃后,CO 含量开始下降,表明氧载体内部的氧物种补充完毕。Ce0.8Cu0.2O2/0.4 g S-1 样品的CO 含量最低,表明其储氧性能较差,S-1 分子筛的比例过大不利于晶格氧的恢复。而Ce0.8Cu0.2O2/0.2 g S-1 氧载体在所有样品中储氧性能以及氧恢复能力较好。以上结果表明,引入合适比例的S-1 分子筛有利于改善Ce0.8Cu0.2O2氧载体在CO2气氛下的氧再生能力。

图7 Ce0.8Cu0.2O2 (a)、Ce0.8Cu0.2O2/0.1 g S-1 (b)、Ce0.8Cu0.2O2/0.2 g S-1 (c)、Ce0.8Cu0.2O2/0.3 g S-1 (d)和Ce0.8Cu0.2O2/0.4 g S-1 (e)氧载体的CO2-TPO 谱图Figure 7 CO2-TPO curves of Ce0.8Cu0.2O2 (a), Ce0.8Cu0.2O2/0.1 g S-1 (b), Ce0.8Cu0.2O2/0.2 g S-1 (c),Ce0.8Cu0.2O2/0.3 g S-1 (d) and Ce0.8Cu0.2O2/0.4 g S-1 (e) oxygen carriers
2.1 化学链重整反应性能研究
2.1.1 CH4 部分氧化反应分析
图8为引入不同比例S-1 分子筛的Ce0.8Cu0.2O2氧载体在850 ℃下甲烷部分氧化反应中的各气体含量变化。整个反应过程持续20 min,在反应初始阶段就有CO2生成,是由于表面氧物种拥有较高的活性,导致CH4完全氧化。当表面氧物种被逐渐消耗后,氧载体内部活性较低的晶格氧将CH4部分氧化为CO 和H2。显而易见,S-1 分子筛的引入极大地提升了甲烷部分氧化反应的合成气(CO 和H2)产量,这表明,S-1 分子筛的加入对促进晶格氧的迁移速率进而提高氧载体反应活性起到了积极作用。表3 为各样品在850 ℃下甲烷部分氧化反应中的气体含量。由表3 可知,随着分子筛添加量的增加CO 产率在S-1 添加量为0.3 g时达到最高值,而CH4转化率一直在上升,当S-1添加量为0.4 g 时CO 产率下降但是CH4转化率上升,这说明发生CH4裂解。Ce0.8Cu0.2O2/0.3 g S-1氧载体拥有较高的CH4转化率,而且CH4裂解程度较低,积炭较少。
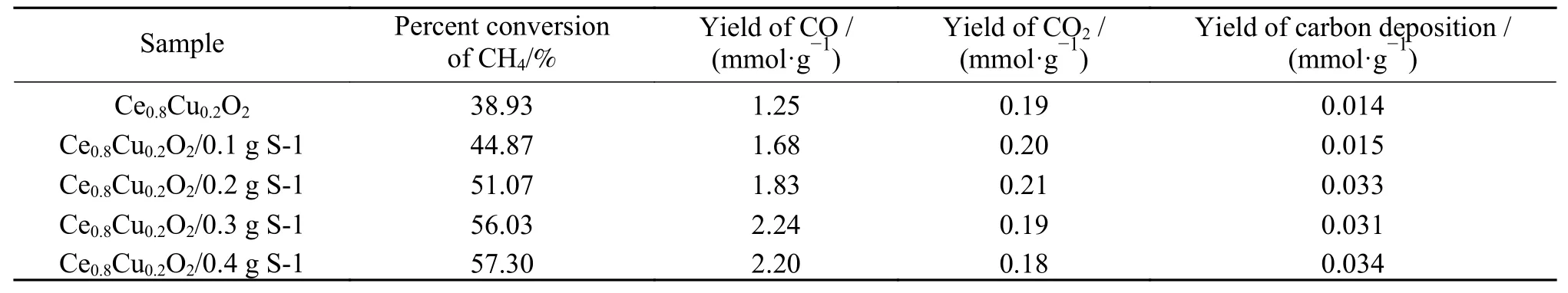
表3 样品在850 ℃下甲烷部分氧化反应中的气体含量Table 3 Gas content of sample in the CH4 partial oxidation reactions at 850 ℃
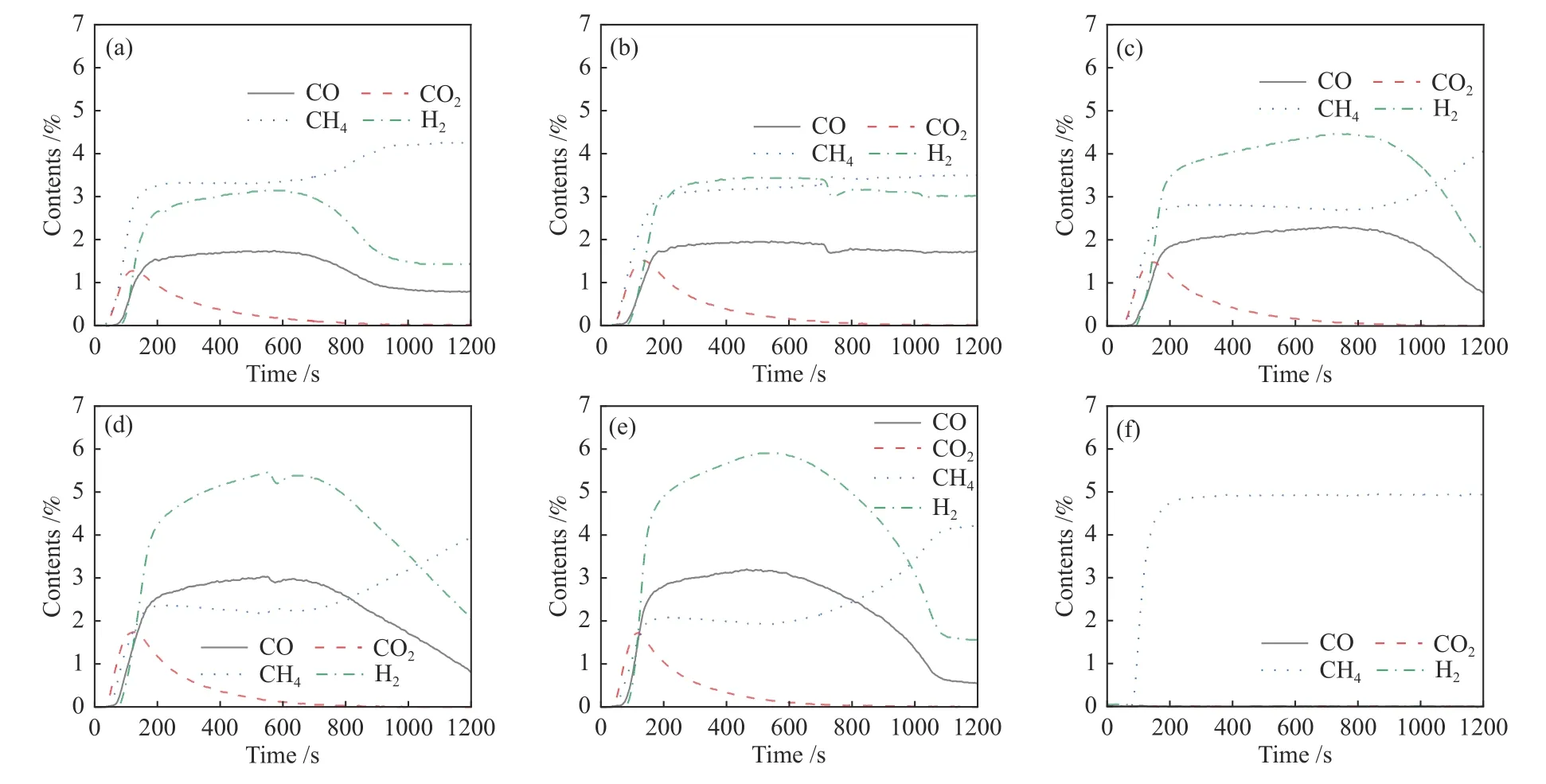
图8 Ce0.8Cu0.2O2 (a)、Ce0.8Cu0.2O2/0.1 g S-1 (b)、Ce0.8Cu0.2O2/0.2 g S-1 (c)、Ce0.8Cu0.2O2/0.3 g S-1 (d)和Ce0.8Cu0.2O2/0.4 g S-1(e)氧载体和S-1(f)在850 ℃下甲烷部分氧化反应中气体含量的变化Figure 8 Gas content change curve of Ce0.8Cu0.2O2 (a), Ce0.8Cu0.2O2/0.1 g S-1 (b), Ce0.8Cu0.2O2/0.2 g S-1 (c), Ce0.8Cu0.2O2/0.3 g S-1 (d),Ce0.8Cu0.2O2/0.4 g S-1 (e) oxygen carriers and S-1 (f) in the CH4 partial oxidation reactions at 850 ℃
2.1.2 CO2 还原反应分析
在850 ℃下CO2还原反应中的CO 和CO2含量变化如图9 所示。在甲烷部分氧化反应消耗的氧物种可以通过此反应进行补充。从图9 中可以看出,反应开始后CO 含量快速上升,一段时间后,开始下降直至为0,这归因于氧载体内的氧物种逐渐恢复。由表4 数据可明显地看出五个样品中Ce0.8Cu0.2O2/0.3 g S-1 样品的CO 含量最高,这一方面归因于氧物种在CH4氧化反应中的大量消耗;另一方面,可能是样品表面少量的积炭转化为CO(CO2+ C→2CO),这有利于样品的循环稳定性。上述结果显示,不同比例S-1 分子筛耦合Ce0.8Cu0.2O2氧载体反应性能差异非常显著,表明S-1 分子筛的引入量是影响氧载体性能的重要因素。

表4 样品在850 ℃下CO2 还原反应中的气体含量Table 4 Gas content of samples in CO2 reduction reaction at 850 ℃
2.2 Redox 循环性能研究
图10为掺杂不同质量S-1 分子筛的Ce0.8Cu0.2O2氧载体在20 次氧化还原循环中CO2、CO 和H2气体含量的变化。从图10 可以看出,与甲烷恒温反应类似,每次循环中CH4被氧载体内的氧物种先后转化为CO2、H2和CO。S-1 分子筛的加入对氧载体的CH4部分氧化反应提升明显,但随着循环次数的增加,各气体产量开始下降。图10 可以看出,CH4转化率随着循环反应的进行而下降,Ce0.8Cu0.2O2/0.3 g S-1 样品的CH4转化率明显高于Ce0.8Cu0.2O2/0.2 g S-1 样品。对比表5 中数据可知,Ce0.8Cu0.2O2/0.3 g S-1 复合氧载体相较于另外两个样品具有更稳定的积炭产率和氧再生性能,Ce0.8Cu0.2O2/0.2 g S-1 复合氧载体尽管在前期表现出优秀的性能,但是随着redox 反应循环的进行,其稳定性迅速下降。Ce0.8Cu0.2O2/0.3 g S-1 氧载体比Ce0.8Cu0.2O2/0.2 g S-1 氧载体拥有更高的反应性能与CH4转化率、更好的循环稳定性和良好的抗积炭能力[29]。

表5 样品在850 ℃时20 次循环过程得失氧量与积炭量变化Table 5 Amount of oxygen gained and lost during the 20 cycles at 850 ℃ and the amount of carbon deposition variated
各样品在20 次氧化还原循环反应中CO 和CO2含量变化如图10 所示。通过CO2还原反应可以对还原后的氧载体进行补氧,CO2提供一个氧原子转化为CO。Ce0.8Cu0.2O2/0.3 g S-1 样品在CO2还原反应中的得氧量比Ce0.8Cu0.2O2/0.2 g S-1 样品要高,在20 次循环后,Ce0.8Cu0.2O2/0.3 g S-1 样品仍有较高的得氧量,这表明Ce0.8Cu0.2O2/0.3 g S-1 样品在20 次redox 循环反应中拥有良好的氧再生性能和循环稳定性。
2.3 循环后氧载体的表征
图11为Ce0.8Cu0.2O2、Ce0.8Cu0.2O2/0.2 g S-1 和Ce0.8Cu0.2O2/0.3 g S-1 氧载体经过20 次redox 循环后的XRD 谱图。从图11 可以看出,循环后的所有样品都具有CeO2的立方萤石结构,相对于新鲜样品,循环后样品的特征峰表现的更加尖锐,这归因于结晶度的增加[30]。
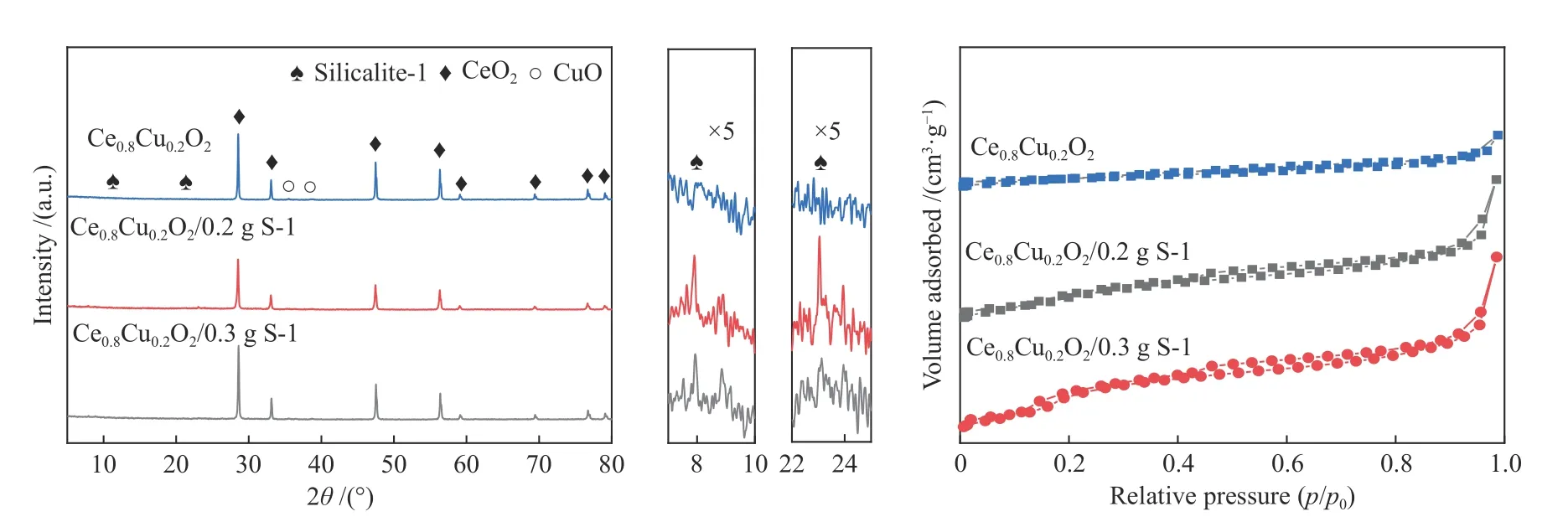
图11 经历20 次redox 循环后的Ce0.8Cu0.2O2、Ce0.8Cu0.2O2/0.2 g S-1 和Ce0.8Cu0.2O2/0.3 g S-1 氧载体的XRD 谱图和氮气吸附-脱附等温曲线Figure 11 XRD patterns and nitrogen adsorption-desorption isotherms of Ce0.8Cu0.2O2、Ce0.8Cu0.2O2/0.2 g S-1 and Ce0.8Cu0.2O2/0.3 g S-1 oxygen carriers after 20 redox cycles
氮气吸附-脱附等温曲线显示了Ce0.8Cu0.2O2、Ce0.8Cu0.2O2/0.2 g S-1 和Ce0.8Cu0.2O2/0.3 g S-1 氧载体在20 次redox 循环后的氮气吸附-脱附等温曲线。由图11 可知,循环后Ce0.8Cu0.2O2/0.3 g S-1 样品的介孔数量多于Ce0.8Cu0.2O2/0.2 g S-1 和Ce0.8Cu0.2O2样品。平均孔径、比表面积和孔容列于表6。各样品经过20 次循环后,各项参数都出现了下降,Ce0.8Cu0.2O2样品的比表面积和孔容分别由15.44 m2/g 和0.11 cm3/g降至3.01 m2/g 和0.008 cm3/g,Ce0.8Cu0.2O2/0.2 g S-1样品的比表面积和孔容分别由69.40 m2/g 和0.14 cm3/g 降至33.944 m2/g 和0.03 cm3/g。Ce0.8Cu0.2O2/0.3 g S-1 样品的比表面积和孔容分别由73.27 m2/g和0.09 cm3/g 降至51.50 m2/g 和0.04 cm3/g,下降幅度比Ce0.8Cu0.2O2/0.2 g S-1 和Ce0.8Cu0.2O2样品低,表明,Ce0.8Cu0.2O2/0.3 g S-1 氧载体的结构稳定性更好。
3 结 论
本研究主要探究了S-1 分子筛与Ce0.8Cu0.2O2氧载体不同的配比对氧载体本身的物化特性和反应性能等方面的影响。结果显示,0.3 g S-1 分子筛添加量为最佳比例。S-1 分子筛加入并不会改变Ce0.8Cu0.2O2氧载体的晶体结构,并且S-1 分子筛的加入将复合氧载体样品的比表面积从15.44 m2/g提高至73.27 m2/g,分子筛的孔道结构有利于气体的扩散,加快了气体的反应速率,提高了反应的转化率,同时还提高了氧载体的热稳定性和结构稳定性。添加了0.3 g S-1 分子筛的复合氧载体CH4转化率由38.93%提升至56.03%,CO2还原过程中CO 产率由1.18 mmol/g 增加至2.16 mmol/g,氧载体的反应活性得到了增强,抗积炭性能也得到了提升。综上,当S-1 分子筛添加量为0.3 g 时,Ce0.8Cu0.2O2/0.3 g S-1 复合氧载体表现出最优异的反应性能、循环稳定性以及抗积炭能力。

