真实世界回顾性分析免疫新辅助治疗在肺癌中的应用价值
方园 符萌 谢旺 操乐杰 章俊强
原发性肺癌是世界范围内发病率第二,死亡率最高的恶性肿瘤(18%)[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占原发性肺癌的80%~85%。在新诊断的NSCLC中,约20%~25%的患者可行手术治疗[2]。国家癌症数据库(national cancer database , NCDB)和国际肺癌研究协会(International Association for the Study of Lung Cancer ,IASLC)数据显示IA1期的五年生存率为92%,ⅢB期的五年生存率下降至26%,如何延长患者生存时间,改善生活质量,仍是探索的焦点。随着免疫治疗进入晚期肺癌的一线治疗,多项Ⅱ、Ⅲ期研究提出免疫新辅助治疗可显著改善病理缓解率及生存率[3]。本文回顾性的分析了中国科学技术大学附属第一医院进行免疫联合化疗以及化疗新辅助的患者的相关信息,旨在探究新辅助免疫治疗用于可切除非小细胞肺癌的有效性以及可行性。
资料与方法
一、临床资料
回顾性分析2020年1月1日至2022年6月1日,入住中国科学技术大学附属第一医院,经MDT(由呼吸与危重症医学科、放疗科、肺与纵隔外科、医学影像科组成),拟行免疫联合化疗新辅助治疗的ⅡA-ⅢB期患者33例(分为观察组),以及选取同时间段行化疗新辅助的患者25例(分为对照组)。肿瘤分期依据美国癌症联合会(American Joint Committee on Cancer,AJCC)TNM系统(第 8 版)进行,病理组织学分类依据2021年世界卫生组织肺癌诊断标准进行,具体资料(见表1)。本研究经医院伦理委员会审核并批准(2022-RE-406)。
1 入选标准
①年龄≥18岁且≤80岁,一般身体状况良好,PS评分 0~1分。②活检病理组织分型为非小细胞肺癌。③病理类型为腺癌的患者需行基因检测证实无EGFR、 ALK、ROS1 驱动基因阳性。④术前肿瘤评估为可手术,或有潜在可手术机会。⑤无远处转移。⑥入组前未接受过诸如放化疗、中医中药等其它抗肿瘤治疗。⑦无合并其它严重脏器疾病。
2 排除标准
①不能耐受或拒绝接受≥2周期的免疫检查点抑制剂或化疗的患者。②患有活动性自身免疫性疾病或既往有自身免疫性疾病史(如间质性肺炎、系统性红斑狼疮、血管炎等)。③患有免疫功能缺陷,如人类免疫缺陷病毒感染、活动性乙型肝炎、丙型肝炎等。④其它未根治的恶性肿瘤。⑤严重肝脏、肾脏、心脏等功能异常。
二、治疗方法
观察组在行抗肿瘤治疗前需完善血常规、肝肾功能、甲状腺功能、抗核抗体十六项、心肌酶学检测。对照组行抗肿瘤治疗前需完善血常规、肝肾功能、免疫组检测。对照组鳞癌患者采用注射用白蛋白结合型紫杉醇(260 mg/m2,静脉滴注,21天为1个周期)或紫杉醇(175mg/m2, 静脉滴注,21天为1个周期)联合卡铂(AUC为5mg/mL/min,75 mg/m2,静脉滴注,21天为1个周期);非鳞癌患者采用培美曲塞(500mg/m2静脉滴注,21天为1个周期)联合卡铂(AUC为5mg/mL/min,75 mg/m2,静脉滴注,21天为1个周期)。观察组在对照组基础上,联合应用ICIs,因是真实世界的回顾性研究,免疫治疗药物的类型较多,均为PD-1单抗,替雷利珠单抗(200mg/次,静脉滴注,21天为1个周期)、帕博利珠单抗(200mg/次,静脉滴注,21天为1个周期)、特瑞普利单抗(240mg/次,静脉滴注,21天为1个周期)、信迪利单抗(200mg/次,静脉滴注,21天为1个周期,具体(见表2)。治疗≥2个周期后进行手术。

表2 不同PD-1单抗疗效对比
三、评估方法
两组患者在免疫联合化疗或化疗前行胸部增强CT检查,依据第八版TNM系统进行肿瘤分期,在进行≥2周期静脉应用抗肿瘤治疗后复查胸部增强CT,进行影像学疗效评估,评估方法依据实体瘤评价标准 1.1 版(response evaluation criteria in solid tumour 1.1, RECIST 1.1)[4],将评价结果分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)、疾病进展(progressive disease, PD)。以及进一步进行客观缓解率(ORR)、疾病控制率(DCR)分析。
手术切除标本的病理学评估依据中国非小细胞肺癌新辅助治疗疗效病理评估专家共识[5],结果分为显著病理缓解(major pathological response,MPR)和完全病理缓解(pathologic complete response,pCR)。 MPR:是指新辅助治疗后瘤床内的残存活肿瘤细胞的百分比<10% ,无论淋巴结内有无活肿瘤细胞残存。pCR:是指新辅助治疗后瘤床内和淋巴结内均无残存活肿瘤细胞。总病理缓解率 =(MPR例数 +pCR 例数)/总例数×100%。
四、统计学方法
采用SPSS 22.0统计学软件进行数据处理,计数资料以例(%)表示, 组间比较采用χ2检验。 对影响的pCR相关因素行单因素分析, 单因素分析采用χ2检验,P<0.05为差异有统计学意义
结 果
33例观察组和25例对照组的年龄、性别、肿瘤分期的一般临床资料分析差异无统计学意义(详见表1)。观察组中实际行手术的患者27例(81.8%),对照组中实际行手术的患者19例(76.0%)。在影像学疗效评估中,观察组的PR以及ORR率均优于对照组,差异有统计学意义(P<0.05)(详见表3)。不同的PD-1单抗获得的具体影像学疗效(详见表2)。结果表明新辅助免疫联合化疗较单纯的新辅助化疗相比,可以获得较好的影像学缓解。
观察组33例患者中,有6例(18.2%)未行手术治疗,其中2例(6.1%)新辅助治疗后,肿瘤未缩小到预期效果,无法行R0切除,1例(3.0%)出现Ⅲ-Ⅳ免疫相关性肝功能损害,1例(3.0%)阻塞性肺炎控制欠佳,2名(6.1%)患者家属拒绝手术。对照组25例患者中,有6例(24.0%)未行手术治疗,2例(8.0%)化疗后病情进展,转为放疗,2例(8.0%)化疗后肿瘤未缩小到预期效果,无法行R0切除,2例(8.0%)患者家属因经济,高龄等因素拒绝手术。经统计,58例患者中共有46例进行了手术,手术率79.3%,其中观察组27例(手术率81.8%),对照组19例(手术率76.0%)。
手术治疗的患者中,观察组pCR率为44.4%,明显优于对照组(P<0.05),差异有统计学意义,MPR率为18.5%,高于对照组,没有统计学意义(P>0.05)。具体(见表4)。
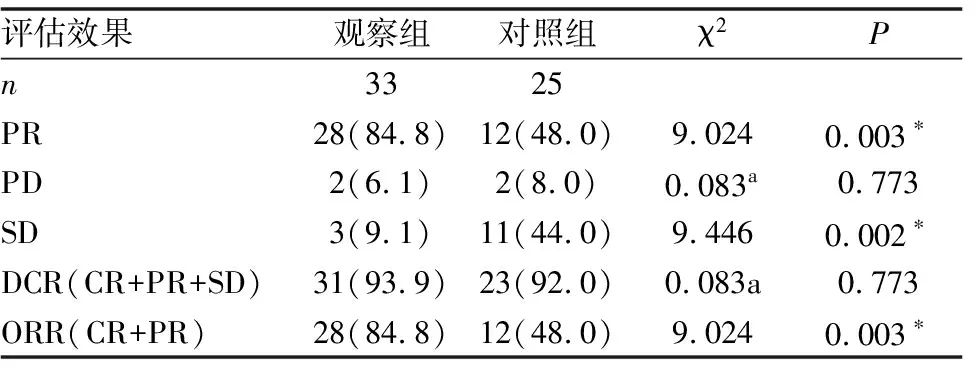
表3 58例患者影像学疗效对比[n(%)]

表4 46例手术患者病理学疗效对比[n(%)]
单因素分析显示,新辅助治疗方案以及接受治疗的周期与pCR有关,病理类型、年龄、性别、吸烟史、肿瘤分期等与pCR无相关性,差异无统计学意义(P>0.05)(详见表5)。将接受免疫联合化疗新辅助治疗的周期分为2周期、3周期以及大于3周期,其中接受3周期治疗的患者有8例达到pCR,占所有pCR患者的66.7%(8/12)。具体(见表5)。
33例行免疫联合化疗的新辅助患者中,将出现的免疫相关不良反应具体列举(见表6),其中仅有1例因严重的免疫相关肝功能损害而停止手术,其中免疫相关不良反应发生率为39.4%(13/33)。
讨 论
MDT通过对疾病多维度的讨论和分析从而给肿瘤患者带来更大的收益[11]。本研究中进行免疫联合化疗的新辅助患者均经MDT讨论,从而给出患者最优的治疗方案。
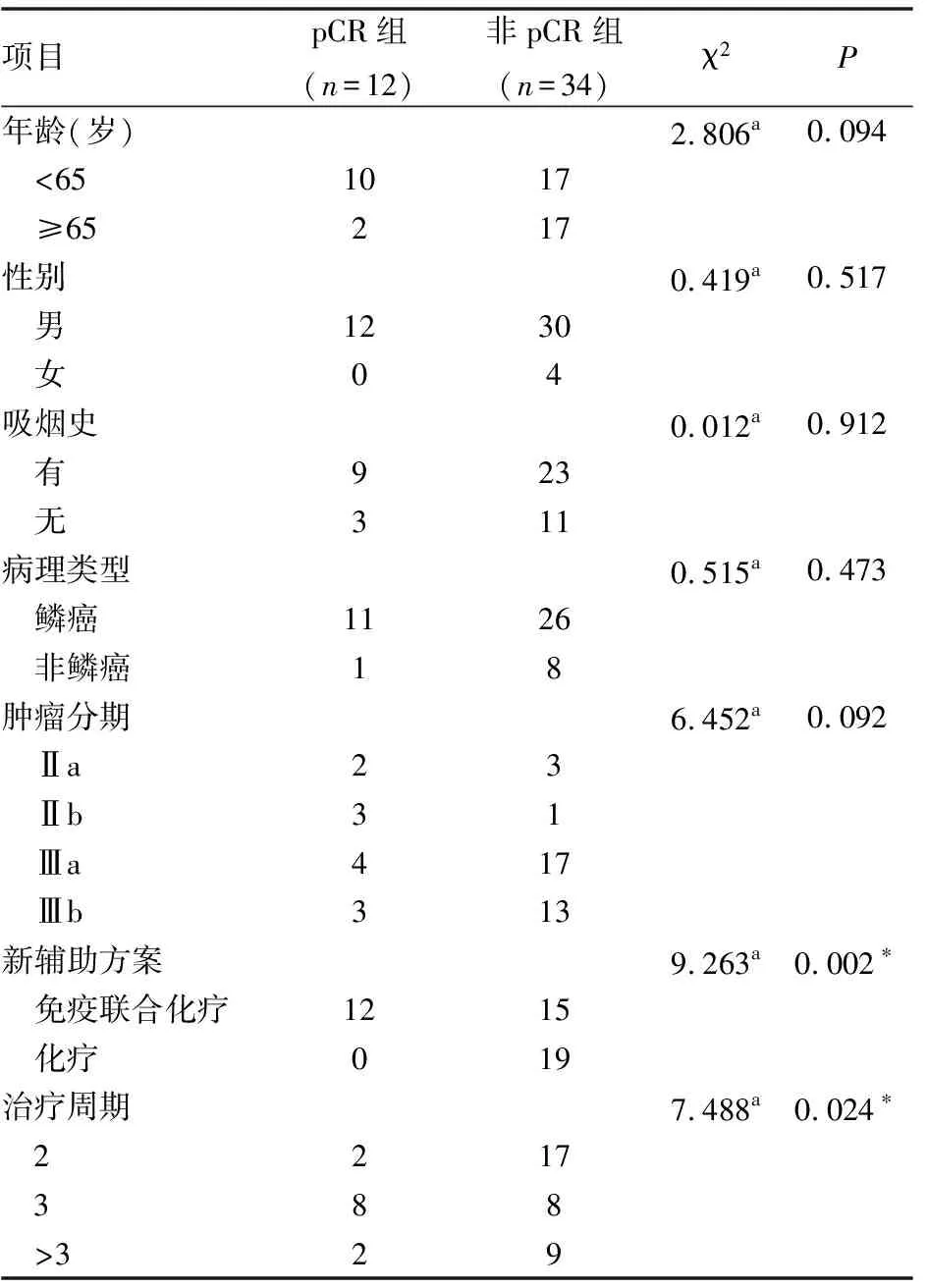
表5 单因素分析影响pCR的因素

表6 免疫相关不良反应[n(%)]
目前多项Ⅰ期、Ⅱ期、Ⅲ期临床实验聚焦于单药免疫、免疫联合化疗、免疫联合免疫的新辅助治疗。其中,PD-1纳武利尤单抗联合化疗的Ⅱ期NADIM研究显示,41例最终接受手术的患者MPR为83%, pCR为63%[6]。PD-L1阿特利珠单抗联合化疗的Ⅱ期NCT02716038研究显示,26例行手术切除的患者MPR为50%, pCR为21.4%[7]。今年4月公布的PD-1纳武利尤单抗联合化疗的全球首个Ⅲ期肺癌新辅助治疗的(Checkmate-816)主要研究显示,中位无事件生存期(event-free survival,EFS)为31.6月,pCR率24.1%。[3]国内开展的Ⅰ期临床研究ChiCTR-OIC-17013726结果显示,信迪利单抗单药新辅助免疫MPR率40.5%, pCR为16.2%[8]。对比化疗新辅助免疫联合化疗疗效更佳,且病理缓解率更高。本文的pCR率略高于目前公布的相关结果,可能因为本研究入组非随机筛选入组,观察组的病例为MDT讨论病例,可能存在筛选偏倚。
病理学的完全缓解是否可以完全转化为总生存期的获益,IONESCO研究是首个报道NSCLC病理缓解程度与总生存期(overall survival, OS)[9]的研究,病理缓解状态与患者生存期的相关性有待进一步探索。
术前新辅助治疗可以降分期,较长的治疗时间可能使不良反应增加从而推迟手术甚至导致无法手术,较短的治疗周期可能无法达到预期疗效。目前关于接受几周期术前新辅助治疗,尚无统一定论。新辅助单药免疫治疗的研究均采用2周期的治疗,新辅助免疫治疗联合化疗的研究一般采用3个治疗周期[2][6][7],少部分实验最长可达4个周期。本研究显示在12例pCR的患者中,有8例接受了3周期的化疗联合免疫治疗,占所有pCR患者的66.7%(8/12),是影响pCR的独立危险因素。因此建议可切除的NSCLC术前接受3周期的免疫联合化疗的新辅助治疗。
目前,尚未发现可以有效预测新辅助免疫治疗疗效的生物标志物。小样本研究显示肿瘤细胞相关的生物标记物PD-L1表达水平和肿瘤突变负荷(tumor mutation burden, TMB)在新辅助免疫治疗中具有一定程度的价值[10]。目前中国肺癌免疫治疗的专家共识暂不推荐TMB用于预测免疫新辅助治疗疗效[12]。是否可以将影响化疗新辅助疗效的相关因素例如TNF-α和 IL-6等纳入免疫新辅助中疗效分析中,有待前瞻性研究进一步探索[13]。
结合目前的Ⅱ~Ⅲ期的部分临床研究项目,免疫新辅助治疗中所有级别和≥3级的免疫相关不良反应发生率分别为23%~57%和4.5%~13%[14],本研究33例患者中,出现13例(39.4%)免疫相关不良反应,仅有1例(3.0%)因Ⅲ~Ⅳ级的免疫相关肝功能损害导致无法手术,总体来说新辅助免疫治疗相对安全。
本文系回顾性研究,因部分临床数据不完善,无法将PD-L1、CD4+、CD8+淋巴细胞等因素纳入进一步的分析,期待更多的前瞻性研究探索影响pCR以及总生存期的相关因素。

