聚苯乙烯微塑料对球形棕囊藻生长的影响
张荣灿 ,覃仙玲 ,李煜铭 ,陆家昌 ,雷 富 ,庄军莲 ,赖俊翔,许铭本
(1.广西科学院广西海洋科学院/广西近海海洋环境科学重点实验室/广西海洋天然产物与组合生物合成化学重点实验室,广西 南宁 530007;2.北部湾海洋产业研究院,广西 防城港 538000)
海洋塑料污染是一个全球性问题。全球每年向海洋中排放大量塑料垃圾,这些塑料垃圾逐渐被分解为毫米、微米级的塑料颗粒。微塑料一般指直径小于5 mm 的塑料颗粒[1]。海洋环境中的微塑料对海洋浮游植物产生不利影响,可吸附藻细胞或附着在藻细胞上、抑制光合作用[2-4],使藻细胞生长、生产受抑制[5-7];还有对藻细胞造成物理损伤[8]等负面作用。聚苯乙烯(Polystyrene,PS)塑料在水产养殖和外卖包装盒中的应用广泛,其内部化学结构稳定,不易降解,为海洋环境中最常见塑料污染之一[9]。聚苯乙烯微塑料会抑制东海原甲藻(Prorocentrum donghaiense)在稳定期和衰退期的生长[10]。聚苯乙烯纳米微塑料对杜氏藻(Dunaliella tertiolecta)的生长有长期毒性[11]。高浓度(250 mg·L-1)、小粒径(0.05 μm)聚苯乙烯微塑料对盐生杜氏藻(Dunaliella salina)光合作用的抑制作用更强[5]。
微藻是海洋食物链底端的生产者,是全球氧气的主要来源,对于维持海洋生态系统的稳定性有重要作用[12]。棕囊藻属(Phaeocystis)广泛分布于从热带到两极的广大海区,可因近海富营养化而引发大规模有害赤潮。近年来,球形棕囊藻(Phaeocystisglobosa)赤潮的暴发规模和持续时间明显增加,对海洋生态系统造成严重影响。本研究在聚苯乙烯微塑料存在条件下,分析球形棕囊藻单细胞数量、群体数量和形态等的生理响应,探讨聚苯乙烯微塑料对其生长和生活史形态转化的影响,为全面深入了解球形棕囊藻形成种群优势提供基础资料,为海洋生态系统保护提供科学依据,也为微塑料的生态环境效应研究提供参考。
1 材料与方法
1.1 材料
球形棕囊藻采自广西北部湾海域,经实验室分离、纯化后保存于4 ℃冰箱。
小粒径聚苯乙烯塑料微球(直径0.1、1.0 μm)、大粒径聚苯乙烯塑料微球(直径10.0、100.0、1 000.0 μm),购自天津市倍思乐色谱技术开发中心。
1.2 实验方法
1.2.1 球形棕囊藻的培养 以f/2培养基[13]为培养介质。取棕囊藻藻液(单细胞样品),过10 μm筛绢,加入培养基中,藻单细胞初始密度为2 000 mL-1。再加入直径分别为0.1、1.0、10.0、100.0、1 000.0 μm 的聚苯乙烯塑料微球,起始质量浓度均为1 mg·L-1。培养基、藻液及塑料微球的总体积为800 mL。对照组不加聚苯乙烯塑料微球,培养基及藻液的总体积为800 mL。各组均设置3 个平行组。置于培养箱中扩大培养30 d,培养条件为温度20°C,盐度30,照度2 000 lx,光暗比为12 h∶12 h。每3 d取样1次。
1.2.2 球形棕囊藻生长变化分析 取1 mL藻液置于24 孔培养板中,在倒置显微镜下进行球形棕囊藻游离单细胞、囊体细胞计数,统计游离单细胞、囊体数量,测量囊体直径[14-15]。计算游离单细胞及囊体的抑制率(PI,%)或增长率(PG,%)。
RPI=1-N/N0。其中,RPI为抑制率。N0为对照组棕囊藻单细胞密度或囊体数量;N为实验组球形棕囊藻单细胞密度或囊体数量。
RPG=1-N/N0。其中,RPG为增长率,N0为对照组棕囊藻囊体直径或囊体细胞密度;N为实验组球形棕囊藻囊体直径或囊体细胞密度。
1.3 统计分析
结果以平均值±标准差表示。采用SPSS 20.0软件进行数据处理和统计分析。采用单因素方差分析法进行差异显著性分析,P<0.05 时数据间有显著差异。
2 结果与分析
2.1 微塑料对球形棕囊藻游离单细胞密度的影响
由图1可见,随着培养时间的增加,对照组单细胞数量逐渐增长。培养至3 d 时,游离单细胞密度为3.55×103mL-1。随后游离单细胞密度不断增加,在30 d 达到最高值(126.75×103mL-1)。微塑料存在下,各组游离单细胞密度最高值出现在24 d(1.0 μm组)、27 d(10.0 μm 组、100.0 μm 组)及30 d(0.1 μm组、1 000.0 μm 组),表明微塑料的存在,对游离单细胞的生长周期有一定扰动。

图1 球形棕囊藻游离单细胞的生长曲线Fig.1 Growth curve of solitary cell of Phaeocystis globosa
另一方面,不同粒径微塑料存在下,在整个培养周期,实验组游离单细胞密度均显著低于对照组(P<0.05,图1),表明微塑料的存在对球形棕囊藻游离单细胞的生长有明显抑制作用。
从图2可见,在微塑料存在的条件下,游离单细胞的生长受到不同程度的抑制。对于小粒径微塑料,0.1 μm 组的抑制率最高为93.0%(12 d),最低为34.2%(6 d);1.0 μm组的抑制率最高为86.0%(15 d),最低为-2.92%(9 d)。对于大粒径微塑料,10.0 μm组的抑制率最低为49.35%(6 d),自12 d 时起,抑制率均在90%以上,最高为99.3%(18 d);100.0 μm 组的抑制率最低为33.5%(24 d),最高为95.3%(12 d);1 000.0 μm 组的抑制率最低为28.8%(6 d),最高为99.2%(21 d),且在12~27 d,其抑制率均大于90.0%。这表明大粒径微塑料总体上对球形棕囊藻游离单细胞生长的抑制作用较强。
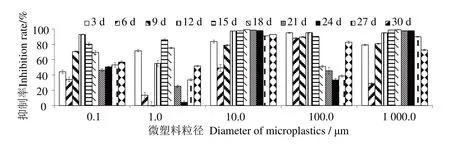
图2 不同粒径微塑料对球形棕囊藻游离单细胞生长的抑制率Fig.2 Inhibition rate of microplastics in different diameters on the growth of solitary cell of Phaeocystis globosa
2.2 微塑料对球形棕囊藻囊体数量的影响
从表1可见,培养6 d时对照组形成囊体,密度为92 mL-1,之后囊体数量逐渐增加,在15 d时囊体数量达最高值(密度为462 mL-1)。继续培养,则囊体数量又开始逐渐减少,在30 d时密度降至99 mL-1。

表1 不同粒径微塑料存在条件下球形棕囊藻囊体数量的变化Table 1 Changes in the number of colony of Phaeocystis globosa under condition of microplastics of different sizes mL-1
加入不同粒径的微塑料后,球形棕囊藻囊体出现的时间及数量变化不一致:加入小粒径(0.1、1.0 μm)微塑料后,囊体出现的时间与对照组相同(6 d);但在10.0、100.0、1 000.0 μm 大粒径微塑料存在下,囊体出现时间分别为9 d(1 mL-1)、9 d(3 mL-1)、15 d(1 mL-1),表明大粒径微塑料对球形棕囊藻囊体的形成起延迟作用。
此外,在6 d 时形成囊体后,除27 d 外,实验组囊体数量均显著少于对照组(P<0.05,表1)。0.1μm 组 及1.0 μm 组囊体 数量最 高值分别为207 mL-1、209 mL-1,为对照 组最高 值的44.76%、45.20%。而直径10.0 μm 及以上的塑料微球存在的情况下,几乎可完全抑制囊体的形成(囊体数量最高值仅为8 mL-1)。表明微塑料对球形棕囊藻囊体的形成有明显抑制作用。
从图3 可见,不同粒径微塑料对囊体数量均有抑制作用。0.1 μm 组及1.0 μm 组的抑制率,最高值分别为68.7%(9 d)和64.6%(12 d)。而在大粒径的10.0 μm组、100.0 μm组及1000.0 μm组,对囊体形成的抑制率均在94.0%以上。表明大粒径微塑料对囊体形成的抑制作用大于小粒径微塑料。

图3 不同粒径微塑料对球形棕囊藻囊体生长的抑制率Fig.3 Inhibition rate of microplastics in different particle sizes on the growth of Phaeocystis globosa colony
2.3 微塑料对球形棕囊藻囊体直径的影响
由图4可见,正常培养条件下,对照组球形棕囊藻囊体在6 d时出现,平均直径为90.72 μm。随后囊体直径随着培养时间的增加而增大,到18 d 时达到最高值(349.45 μm),之后开始减小,在30 d 时达到最低值(73.26 μm)。微塑料存在下,形成囊体后,囊体直径同样随着时间的增加而增大,但在12 d 时,0.1 μm 组、1.0 μm 组、100.0 μm 组囊体直径已大于对照组;而从18 d 开始,所有实验组囊体直径均大于对照组,实验组与对照组差异显著(P<0.05)。表明微塑料对球形棕囊藻囊体直径的增大有较强的促进作用。

图4 不同粒径微塑料存在条件下球形棕囊藻囊体直径的变化Fig.4 Changes of the diameter of Phaeocystis globosa colony under condition of microplastics of different sizes
由表2 可见,0.1 μm 组、1.0 μm 组在囊体形成初期(6~9 d)对囊体直径有抑制作用,6 d 时增长率分别为-37.7%、-38.8%,9 d时增长率分别为-11.5%、-9.8%;而从12 d 开始则变为促进囊体直径的增大,0.1 μm组增长率最高为849.1%(30 d),1.0 μm组增长率最高为898.4%(27 d)。大粒径微塑料(10.0、100.0、1 000.0 μm)组对囊体直径的作用与小粒径组类似,但在囊体形成后期,对囊体直径增大的促进作用更加明显,囊体直径增长率最高分别达到2 633.4%(30 d)、2 515.1%(27 d)及1 868.2%(27 d)。表明大粒径微塑料(10.0、100.0、1 000.0 μm)对囊体直径的影响比小粒径微塑料(0.1、1.0 μm)更加明显。

表2 不同粒径微塑料对球形棕囊藻囊体直径增长率的影响Tab粒le 径2 Effect of microplastics in different particle size on growth rate of Phaeocystis globosa colony diameter %
2.4 微塑料对球形棕囊藻囊体细胞密度的影响
在培养液内自然生长的条件下,球形棕囊藻在6 d 时产生囊体,囊体细胞密度为9.91×103mL-1,小于同时期的游离单细胞密度(17.67×103mL-1)。随着培养时间的增加,囊体细胞密度也逐渐增多,在15 d 时达到最高值(135.94×103mL-1)。随后囊体细胞密度开始减少,在30 d 时达到最低值(1.39×103mL-1)(图5)。

图5 球形棕囊藻囊体细胞的生长曲线Fig.5 Growth curve of colonial cell of Phaeocystis globosa
加入不同粒径的微塑料后,除27 d、30 d 外,实验组囊体细胞密度与对照组均差异显著(P<0.05,图5)。加入小粒径微塑料(0.1 μm、1.0 μm)后,前期(3~15 d)棕囊藻生长周期与对照组类似,囊体细胞密度逐渐增加,但从15 d 时开始,囊体细胞密度均大于对照组,且此后呈增长趋势,直至27 d 时达最高值(分别为766.63×103、826.92×103mL-1),其最高值分别为对照组最高值的564%、608%。加入大粒径的微塑料(10.0、100.0、1 000.0 μm)后,其生长周期延迟,但囊体细胞密度也呈上升趋势,在21 d 时已高于对照组,且均在24 d 时达到最高值(分别为251.84×103、281.01×103、162.18×103mL-1),最高值分别为对照组最高值的185%、207%、119%。
由表3 可见,所有实验组在囊体形成初期对囊体细胞的生长均有抑制作用,0.1、1.0、10.0、100.0、1 000.0 μm组单细胞密度增长率分别为-79.2%(6 d)、-75.8%(6 d)、-99.8%(9 d)、-99.5%(9 d)、-97.7%(15 d)。随着培养时间的增加,微塑料对囊体细胞生长的影响开始变为促进单细胞密度的增加,小粒径微塑料的影响尤为明显,至30 d,单细胞密度增长率已变为52 249.4%(0.1 μm 组)、47 666.3%(1.0 μm组)。而大粒径微塑料对单细胞密度的影响相对较小,在30 d的增长率分别为:9 026.9%(10.0 μm 组)、6 706.6%(100 μm组)、869.0%(1 000.0 μm组)。表明小粒径微塑料(0.1、1.0 μm)对囊体细胞生长的影响比大粒径微塑料(10.0、100.0、1 000.0 μm)更加明显。

表3 不同粒径微塑料对球形棕囊藻囊体细胞密度增长率的影响Table 3 Effect of microplastics in different particle size on growth rate of colonial cell density of Phaeocystis globosa %
3 讨论
3.1 微塑料对球形棕囊藻游离单细胞生长的影响
本研究中,在培养初期,微塑料抑制球形棕囊藻单细胞生长,主要原因可能是遮光效应。温度、盐度、营养盐和光照是影响球形棕囊藻生长的重要物理因素[16],在温度、盐度、营养盐一定的条件下,藻细胞的生长主要受光照限制。本研究中使用的f/2培养基由天然海水配置,含有Na+、K+、Mg2+、Ca2+、Cl-、SO42-等多种离子[17],聚苯乙烯微塑料可能会吸附这些离子而带电[18]。藻细胞壁上分布有大量羧基、胺基、羟基等带电官能团[19],带电的塑料微球通过与此类官能团相结合而吸附于细胞表面,阻碍叶绿体对光的吸收,从而产生遮光效应,抑制细胞生长。塑料微球的粒径越大,遮光效应越强,因而对球形棕囊藻单细胞生长的抑制作用越明显。
此外,有研究表明,当微塑料和藻细胞接触时,可能会堵塞藻细胞气孔,降低养分和气体交换[20],从而抑制藻的生长;小粒径的微塑料还可能通过气孔进入藻细胞内部引起细胞机械损伤,引发部分细胞器的应激反应,导致细胞代谢紊乱,从而抑制藻细胞生长。微塑料粒径越小,越易造成气孔堵塞或更易进入细胞内部,引起细胞机械损伤、降低养分和气体交换,从而对藻生长的抑制作用越强[10]。但在本研究中,大粒径的塑料微球对球形棕囊藻单细胞的生长抑制作用反而更显著,其原因可能是培养初期,遮光效应使得游离单细胞密度减少;随着培养时间的增加,因塑料微球的存在,球形棕囊藻会启动防御机制,形成较大直径的囊体来自我保护,这一过程需要大量单细胞参与,从而导致游离单细胞密度更小。
3.2 微塑料对球形棕囊藻囊体数量和囊体直径的影响
球形棕囊藻主要以囊体形态形成赤潮,由单细胞向囊体形态的转变是赤潮暴发的关键。李杰等[21]研究表明,不同温度、营养充气搅动、摄食压力、初始密度条件下囊体形成所需的游离单细胞密度不一致,但均达到104mL-1的数量级,推测球形棕囊藻囊体形成的前提是游离单细胞达到一定密度阈值,游离单细胞在高密度情况下更易形成囊体。本研究中,微塑料在培养初期抑制了球形棕囊藻游离单细胞的生长,使游离单细胞数量大幅减少,因而达到成囊所需单细胞密度的时间也有所延迟,导致形成囊体的时间滞后。大粒径微塑料对单细胞的抑制作用大于小粒径微塑料,因而囊体形成的时间更加滞后;同时,在大粒径微塑料的胁迫下,形成的囊体直径更大,需要的单细胞数量则更多,因而囊体数量更少。
本研究表明,微塑料对球形棕囊藻直径的增大有较强的促进作用,在囊体形成后期,大粒径微塑料对囊体直径增大的促进作用比小粒径微塑料更加明显。促进作用的原因和机理有待进一步研究。
3.3 微塑料对球形棕囊藻囊体细胞密度的影响
囊体是球形棕囊藻赤潮暴发期间的优势形态,游离单细胞偶有发现甚至完全消失[22-23]。本研究中,在形成囊体后,实验组中囊体细胞密度占比均远高于游离单细胞密度,与自然海区中球形棕囊藻暴发时的情形一致。杨华钊等[24]研究发现,在实验室条件下,球形棕囊藻形成囊体后,仅不到15%的细胞以囊体细胞形态存在,在实验初期和末期甚至低于5%,游离单细胞成为绝对优势形态,其原因在于室内培养的该藻缺乏摄食压力的胁迫[15],可能将用于囊体构建的能量转而投入单细胞的生长,因而非囊体成为优势形态。本研究中,微塑料通过遮光效应及细胞损伤效应抑制单细胞的生长,球形棕囊藻启动防御机制,大量单细胞团聚形成囊体,抵御外界环境胁迫,因而囊体细胞密度远高于游离单细胞密度,囊体成为优势形态,与自然海区的现象类似。
本研究中,所有实验组微塑料在囊体形成初期对囊体细胞的生长均有抑制作用,这因为微塑料可抑制囊体形成,减少囊体数量,囊体内细胞总数也随之减少,使得囊体细胞密度降低(囊体细胞密度为单位体积培养液内囊体细胞的数量)。随着培养时间的增加,微塑料对囊体细胞生长的影响变为促进囊体单细胞密度的增加。这可能源于球形棕囊藻的防御机制。形成囊体后,由于微塑料的胁迫作用,使得球形棕囊藻将能量用于囊体构建,囊体细胞快速生长,因而囊体细胞密度增加。
在囊体形成后期(自21 d 起),所有实验组的囊体细胞密度均高于对照组,小粒径微塑料组(0.1、1.0 μm)的囊体细胞密度远高于大粒径微塑料组(10.0、100.0、1 000.0 μm)。其原因在于,大粒径微塑料对于球形棕囊藻囊体数量的抑制作用较强,形成的囊体数量少,使得囊体内细胞总数少,因而囊体细胞密度小。而小粒径微塑料组囊体数量远高于大粒径微塑料组,因而其囊体细胞密度也明显更高。因此,小粒径微塑料对囊体细胞生长的影响大于大粒径微塑料。
3.4 微塑料与赤潮藻
海洋微塑料污染是全球性问题,我国南海近岸海域已普遍受到微塑料污染。吴磊石等[25]研究发现,北部湾海域表层水体中微塑料的空间分布呈现近岸高、远岸低的特征,平均丰度为(0.56 ± 1.02)m-3,与其他海湾相比处于中等水平;粒径1~2 mm的微塑料数量最多,占全部微塑料数量的30.4%;微塑料主要成分为聚苯乙烯、聚丙烯和聚乙烯,占比分别为59.8%、20.9%和17.6%。
球形棕囊藻是近年来我国南部沿海常见的赤潮藻,在微塑料污染普遍存在的北部湾海域,可能与微塑料发生大概率的相互作用。广泛分布的微塑料可能会影响藻类的生长,继而影响生态系统的稳定。因此,探究球形棕囊藻对微塑料的生理响应以及微塑料对球形棕囊藻在游离单细胞与囊体之间的生活史转换的影响,可为研究微塑料的海洋生态环境效应提供新的信息。关于微塑料与赤潮藻相互作用的研究不多。孙炎等[10]发现,10 mg·L-1粒径0.1 μm 的聚苯乙烯微塑料对我国东海海域常见的有害赤潮藻——东海原甲藻前期生长的影响为先抑制、后促进;聚苯乙烯微塑料会抑制处于稳定期和衰退期东海原甲藻的生长;微塑料粒径越小、浓度越高,抑制作用越强;浓度的抑制效应强于粒径的抑制效应。Zhao 等[26]的研究表明,纳米级微塑料对米氏凯伦藻(Karenia mikimotoi)的生长、氧化应激和细胞微观结构有严重的负面影响。李宇佳[27]研究了聚苯乙烯(PS)、聚乙烯(PE)等5 种微塑料对链状亚历山大藻(Alexandrium catanella)生长的抑制,发现微塑料对赤潮藻的毒性影响较为明显,生长抑制率为5%~40%;随着微塑料浓度的增加,对微藻生长的抑制作用均呈增长趋势。本研究中,微塑料对球形棕囊藻游离单细胞生长、囊体形成亦有抑制作用,与文献[26-27]结果一致;但本研究中大粒径微塑料对球形棕囊藻游离单细胞生长的抑制作用明显大于小粒径微塑料,而微塑料粒径对东海原甲藻生长的影响则是微塑料粒径越小,抑制作用越强。与其他赤潮藻显著不同,球形棕囊藻存在游离单细胞和囊体两种截然不同的生活形态,并可在两种形态间自由交替;其游离单细胞直径一般为3~9 μm,而囊体的直径可达毫米级别[23]。球形棕囊藻的这一特性可能是其对微塑料的响应有别于其他赤潮藻的原因,这还有待进一步研究。
4 结论
本研究探讨微塑料污染对具有异形生活史的赤潮生物——球形棕囊藻生长的影响,结果表明,聚苯乙烯塑料微球的存在,可抑制球形棕囊藻游离单细胞的生长,延迟球形棕囊藻形成囊体的时间,大幅减少囊体数量,显著增加囊体直径,增加囊体细胞密度。大粒径(10.0、100.0、1 000.0 μm)微塑料对游离单细胞的生长、囊体数量、囊体直径影响较大,而小粒径(0.1、1.0 μm)微塑料则对囊体细胞的生长起更加明显的促进作用。本研究有助于评估微塑料对海洋生态系统的影响,为微塑料的生态环境效应研究提供新视角,也为微塑料和致灾赤潮藻复合污染的生态效应以及海洋生态系统保护研究提供科学依据。

