转化人参皂苷菌株的筛选及发酵工艺优化
王丽娜,李秋阳,刘士伟,唐金鑫,刘胜楠,杨 雯,于 雷,毕云枫*
(1.吉林医药学院药学院,吉林 吉林 132013;2.吉林农业大学食品科学与工程学院,吉林 长春 130118)
人参皂苷在人参的药理和生物活性方面起着关键作用,被认为是人参的主要成分[1]。人参皂苷是由基本骨架四环甾体和连接的糖基构成,因此人参皂苷可以发生水解,去掉了部分或全部糖基,生成稀有人参皂苷,从而提高了皂苷的生物学活性[2]。达玛烷型是人参皂苷的主要成分,分为原人参二醇和原人参三醇[3]。转化后的稀有人参皂苷比原人参皂苷的药理活性更加有效[4]。通常口服人参的生物利用度存在个体差异,这取决于人体肠道细菌转化人参的能力[5-6]。因此,利用食品级菌种发酵人参,通过将主要的二醇型人参皂苷转化为更利于人体吸收消化的稀有人参皂苷,将提高人参的利用率及保健价值。
生物转化法目前已成为化合物转化领域中的热门方法,包括酶解法和微生物转化法[7-8]。微生物转化法本质是微生物与外源底物间发生酶促反应,通过酶将底物转化为目标产物。微生物在生长代谢过程中会产生一种或多种水解酶,水解人参皂苷中的糖苷键,从而获得次级人参皂苷和皂苷元[9]。大量研究表明,菌种代谢产生的β-葡萄糖苷酶起到了关键的转化作用[10-11]。因此,本研究利用常见的4种食品级发酵菌种即植物乳杆菌[12]、肠膜明串珠菌[13]、嗜热链球菌[14]和酵母菌[15],通过测定菌种产生的β-葡萄糖苷酶活性并对人参进行发酵,检测发酵后人参皂苷的转化情况,筛选转化二醇型皂苷能力较强的菌株,优化发酵工艺,达到节省时间、节约成本、实现人参皂苷的最佳转化目的。
1 材料与方法
1.1 实验材料
酿酒酵母菌、嗜热链球菌、植物乳杆菌 由本实验室保存;肠膜明串珠菌肠膜亚种 中国工业微生物菌种保藏管理中心;人参 通化市人参交易市场,经吉林农业大学中药材学院何忠梅教授鉴定为五加科植物人参;蜂蜜 辽宁蒙山蜂蜜经销处;MRS培养基、马铃薯葡萄糖水培养基、七叶苷生化培养管 青岛海博生物技术有限公司;对硝基-β-D-葡萄糖苷和对硝基苯酚 上海源叶生物科技有限公司;人参皂苷系列标准品 金盛生物科技有限公司;色谱乙腈、色谱甲醇 Fisher公司;超纯水 杭州娃哈哈集团有限公司。其他试剂均为分析纯。
FLEXARTM型高效液相色谱 美国PerkinElmer有限公司;UV-2600I/岛津型可见分光光度计 岛津企业管理(中国)有限公司;BSA224S型天平 北京赛多利斯科学仪器有限公司;HC-3018型台式高速冷冻离心机 安徽中科中佳科学仪器有限公司。
1.2 发酵菌株的活化与培养
将4种发酵菌接种于相应固体培养基中,24 h后挑取形态较好单菌粒接种于相应液体培养基中扩大培养36 h,培养基稀释菌液于同一浓度为发酵菌液。
1.3 高转化人参皂苷菌株的初筛
1.3.1产β-葡萄糖苷酶菌株的筛选
将“1.2”中培养好的4种发酵菌液接种于七叶苷生化培养管中,再加入500 μL的液体石蜡,培养24 h后观察生化管颜色变化,培养管中液体变黑色,说明接种的菌株产β-葡萄糖苷酶。
1.3.2β-葡萄糖苷酶酶活的测定
分别量取1 mmol/L的pNP标准溶液0.0、0.1、0.2、0.3、0.4、0.5、0.6 mL于10 mL容量瓶中,使用1 mmol/L NaCO2定容至刻度线。以空白管调零,在400 nm波长下测定其吸光度值。以pNP标准溶液浓度为横坐标,吸光度值为纵坐标绘制标准曲线。按照“1.2”的方法,将扩大培养后的菌液在4 ℃下以3500 r/min离心15 min,取上清液作为粗酶液。酶活测定体系中包含100 μL的粗酶液和200 μL的5 mmol/L p-NPG溶液,在37 ℃下无菌培养20 min后,加入2 mL 1 mol/L NaCO2溶液终止反应;空白对照为未加酶的0.3 mL的底物溶液。根据公式计算其酶活力:
酶活力(U)=(C×V1)/(t×V2)×N
式中:U——酶活力单位,U/mL;C——pNP的浓度,mmol/L;V1——反应体系的体积,mL;V2——粗酶液的体积,mL;N——粗酶液稀释倍数;t——反应时间,min
1.4 高转化人参皂苷菌株的复筛
1.4.1菌种转化人参皂苷实验
准确称取人参粉末20 g,加入40 g水,添加菌液浓度为发酵体积的3%,置于37 ℃培养箱中发酵30 d。设置未发酵、自然发酵、植物乳杆菌发酵、肠膜明串珠菌发酵及复合菌发酵对比组,将发酵后二醇型皂苷Rb1、Rc、Rb2和Rb3的得率之和(mg/g)进行对比,选出最佳发酵菌株。
1.4.2人参皂苷的提取方法
准确称取适量发酵样品于烧杯中,加入三倍体积的甲醇溶液超声30 min,静置12 h后离心,倒出上清液,所剩样品继续加入相同量的甲醇超声30 min,静置离心,合并两次上清液,80 ℃水浴蒸发至原容量的一半,随后加入四倍体积的正丁醇溶液,摇匀,静置12 h,将上清液旋转蒸发至近干,加入色谱甲醇溶解,溶解液过0.22 μm滤膜,即得待测溶液。
1.5 发酵条件筛选及水平范围考察
准确称取一定量的人参粉末,固定人参质量与水的比例为1∶2(g/mL),接菌量为发酵体积的3%,搅拌均匀后灭菌,置于37 ℃培养箱中发酵30 d。设计发酵料液比(1∶0.5、1∶1、1∶1.5、1∶2、1∶2.5 g/mL)、发酵接菌量(1%、2%、3%、4%、5%)、发酵天数(1、3、5、7、10、15、23、30、37、45 d)三个因素对人参二醇型皂苷转化影响的实验,进而确定发酵条件。
1.6 RSM响应曲面法实验设计
在单因素实验结果的基础上,以二醇型人参皂苷Rb1、Rc、Rb2和Rb3的得率之和(mg/g)作为考察指标,根据软件Design-Expert 10并利用三因素三水平的Box-Behnken Design(BBD)设计评价最优的人参皂苷转化变量组合进而确定最佳发酵体系。
1.7 数据处理
数据表示为平均值±标准偏差,每组重复3次,取平均值,使用Microsoft Excel 2019、Originpro 8.5及SPSS 26数据分析。
2 结 果
2.1 高转化人参皂苷菌株的筛选
2.1.1产β-葡萄糖苷酶菌株的显色实验结果
七叶苷在β-葡萄糖苷酶的水解作用下产生葡萄糖和七叶苷元,七叶苷元与生化管培养基中3价铁离子作用会使管中培养基显现棕黑色,因此在七叶苷生化管中培养菌种时颜色变棕黑的就是能产β-葡萄糖苷酶的菌株。图1是接种发酵菌株后七叶苷生化管的变化,表明这4种发酵菌株均能产β-葡萄糖苷酶。

图1 七叶苷生化管培养结果
2.1.2β-葡萄糖苷酶酶活的测定
β-葡萄糖苷酶酶活定义为在37 ℃反应温度下,β-葡萄糖苷酶在单位体积内每分钟催化生成1 nmol pNP所需的酶量为一个酶活力单位(U)。4种菌种测定的β-葡萄糖苷酶酶活结果如图2所示(注:字母不同代表组间差异显著,全文同),发酵菌种的酶活力大小为植物乳杆菌>肠膜明串珠菌>嗜热链球菌>酵母菌,植物乳杆菌及肠膜明串珠菌酶活力相对较高,分别为533.65 U/mL和478.70 U/mL。因此,利用植物乳杆菌及肠膜明串珠菌进行下一步发酵菌种的复筛,以达到较好的人参皂苷转化效果。

图2 发酵菌种β-葡萄糖苷酶酶活
2.1.3发酵菌种转化人参皂苷结果分析
通过HPLC法测定皂苷含量,结果如图3。经过发酵后皂苷含量有着较大改变,与未发酵组对比,发酵后的人参皂苷Rb1、Rb2、Rc、Rb3的总含量显著降低。对比于自然发酵组和单一菌种发酵组,复合菌(植物乳杆菌∶肠膜明串珠菌=1∶1)组中Rb1+Rb2+Rc+Rb3含量显著低于其他组,对于二醇型主要皂苷的转化效果最好。因此本研究选择植物乳杆菌与肠膜明串珠菌复合的菌株作为发酵菌种。
2.2 单因素试验
2.2.1料液比的选择
由图4(A)可知当料液比低于1∶1.5(g/mL)时,人参中二醇型皂苷Rb1+Rc+Rb2+Rb3转化率随加水量增加逐渐增加;当超过1∶1.5(g/mL)时,皂苷的转化率上升趋势趋于平缓。猜测可能是因为加水量少,皂苷将无法转化,加水量多,则导致发酵菌种被稀释,发酵效果减弱,发酵时间延长。因此,选择的响应面试验料液比的水平为1∶1.5、1∶2和1∶2.5(g/mL)。
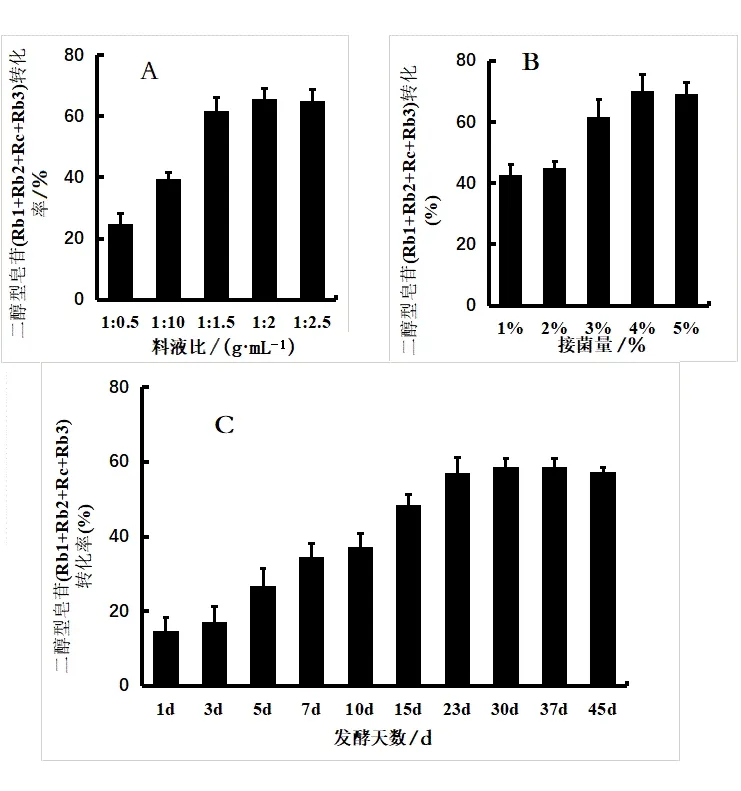
图4 单因素对二醇型皂苷转化率的影响
2.2.2接菌量的选择
由图4(B)可知当接菌量低于3%时,二醇型皂苷的转化率随接菌量增加逐渐升高;当超过3%时,皂苷的转化率上升趋势趋于平缓。猜测可能是因为人参皂苷的转化率随着菌种加入量的增加而增高,但接菌量达到一定浓度时,人参皂苷对菌种的利用达到最大化,转化率不再受接菌量的影响。因此,从节约资源的角度设计实验,选择的响应面试验接菌量的水平为3%、4%和5%。
2.2.3发酵时间的选择
由图4(C)可知当发酵时间低于23 d时,皂苷的含量随发酵天数逐渐增加;当超过23 d时,皂苷的转化率基本无明显变化。出现这样的结果可能是因为一方面发酵菌种已经到了衰亡期,不再对发酵结果产生作用;另一方面可能是人参天然皂苷转化率已达到最大值附近,即便天数增加,也不会对皂苷转化率有较大的提升。考虑到节省试验周期,因此,选择的响应面试验发酵天数水平为15、23和30 d。
2.3 RSM响应面优化工艺结果分析
2.3.1响应面试验结果及方差分析


表1 响应面试验因素水平和编码

表2 响应面试验因素水平和编码

表3 二醇型皂苷转化响应面拟合回归方程的方差分析结果
为进一步确定全局最优解,以各醇型皂苷转化率最大为优化目标,根据Design-Expert10软件运行结果(图5),二醇型皂苷转化率在液料比、接菌量、发酵天数共同影响下的最优工艺:料液比为2.17∶1(mL/g)、接菌量为4.29%、发酵天数为22.54 d,在此条件下模型预测的二醇型天然皂苷转化率为62.84%。
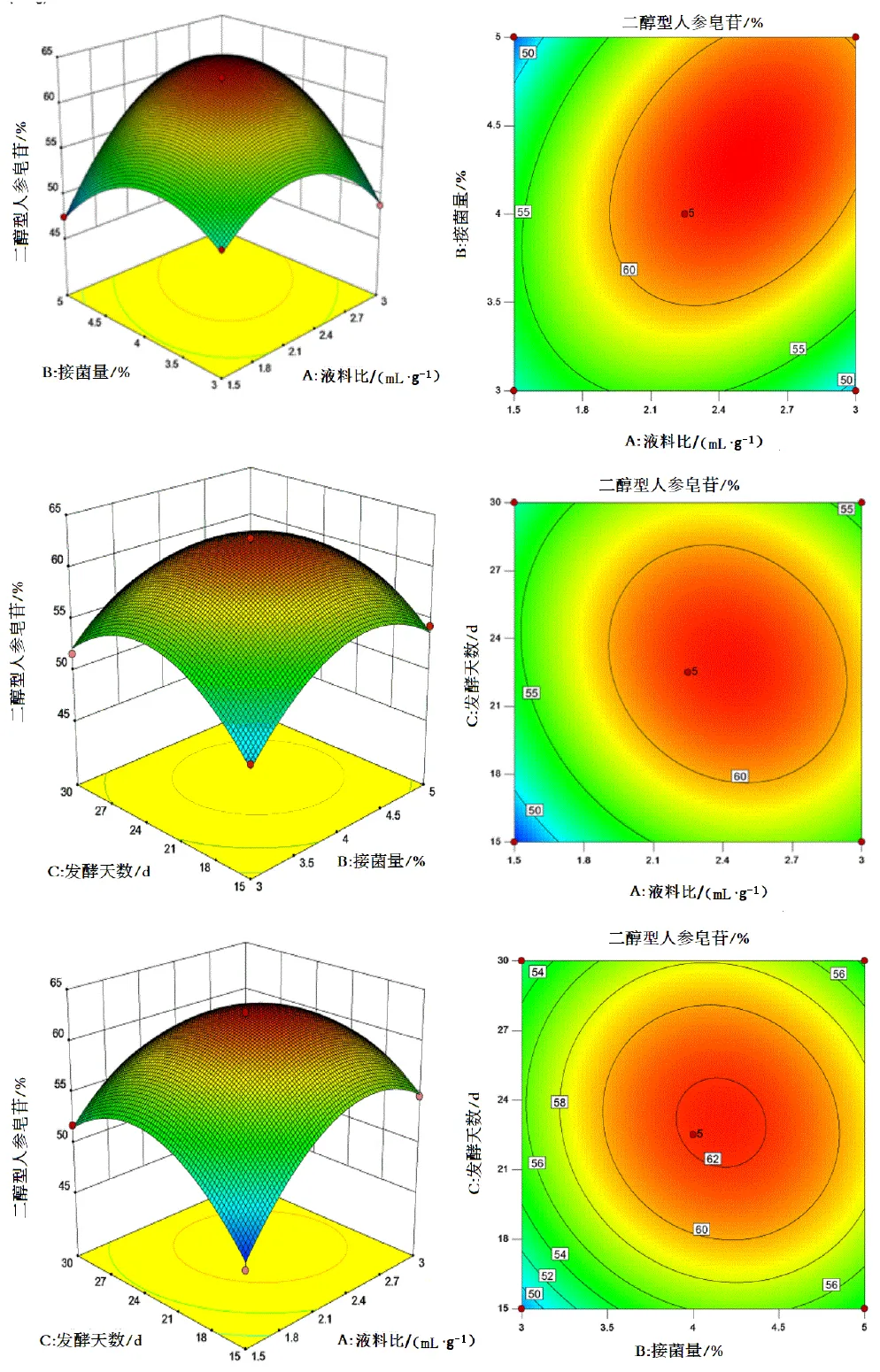
图5 因素的交互作用对二型皂苷转化率的影响
2.3.2最优工艺条件试验验证
结合软件预测结果和实际工艺设置的可行性,取液料比为2∶1(mL/mg)、接菌量为4%、发酵天数为23 d为条件进行3次平行重复试验,得平均二醇型转化率为62.17%,与模型预测结果接近,表明基于该响应面模型分析优化发酵转化人参皂苷的方法有效可行。
3 讨 论
人参中含量高的皂苷包括Rb1、Rb2、Rc、Re和Rg1等,占人参皂苷的80%以上,药理活性低,在人体吸收低。一些含量低的皂苷,如Rg3、Rh2、F2和CK,则具有更高的药理活性[16]。含量高的人参皂苷可通过加热、弱酸水解、碱水解、微生物等多种方法将原型人参皂苷转化为更具有药理活性的人参皂苷[17-18]。以前的研究利用各种微生物来转化人参皂苷,包括酿酒酵母、枯草芽孢杆菌、曲霉、乳酸杆菌。其主要的转化方式就是利用菌种代谢产生的酶作用于皂苷键上[19-20],使其主要人参皂苷Rb1、Rb2、Rb3、Rc、Re和Rg1等糖苷键水解断裂,生成Rg3、Rh2、F2等稀有人参皂苷[21-22]。因此,本研究从食品安全角度出发,选取4种食品级发酵菌株用于发酵人参,基于微生物转化稀有皂苷机理,通过测定菌种产生的β-葡萄糖苷酶酶活性及人参皂苷的转化率,结果表明酶活力大小为植物乳杆菌>肠膜明串珠菌>嗜热链球菌>酵母菌,植物乳杆菌及肠膜明串珠菌酶活力相对较高,分别为533.65 U/mL和478.70 U/mL。对比于自然发酵组和单一菌种发酵组,复合菌(植物乳杆菌+肠膜明串珠菌)组中Rb1+Rb2+Rc+Rb3含量显著低于其他组,对于二醇型皂苷的转化效果最好,因此本研究选择植物乳杆菌与肠膜明串珠菌复合的菌株作为发酵菌种。
发酵是利用微生物酶和微生物进行生化改变的理想过程。在发酵的过程中,发酵的合适条件决定着发酵能否达到预期效果[23-24]。在之前的研究中刘涛[25]得出人参粉∶浓缩苹果汁∶水设置为1∶1∶10,在37 ℃下发酵16 d,可以得到较高的二醇型皂苷转化率。本研究通过单因素实验以及响应曲面法优化人参的发酵工艺,结合实际工艺设置的可行性,取液料比为2∶1(mL/mg),4%的接菌量下发酵23 d为条件,得出最佳工艺,结果二醇型转化率为62.17%。最优的发酵体系,验证了发酵过程的可控性,为人参的加工提供了新方向。

