农杆菌介导四季秋海棠遗传转化体系建立
李逸菲,王瑞博,夏惠婷,任璞玉,赵丹丹,秦肖洁,李永华,张开明
(河南农业大学风景园林与艺术学院,郑州 450002)
四季秋海棠(Begonia semperflorens)别称四季海棠,是秋海棠科(Begoniaceae)秋海棠属(Begonia)多年生宿根草本开花植物,原产巴西热带地区,是一类优良的观赏景观花卉。花期长且开花繁茂,广泛应用于园林植物造景。四季秋海棠可通过扦插、播种、分株、组织培养等方法繁殖。叶片易受低温、高光、干旱等胁迫变红[1-2]。
对逆境胁迫响应和适应机制在一定程度上影响植物栽培繁育及园林价值。随着分子生物学技术发展,园林植物逆境胁迫机理研究由生理水平进入分子水平[3]。转基因技术是改良植物特性重要手段,但缺乏稳定高效的遗传转化体系仍是制约四季秋海棠转基因技术发展的重要因素。国内外关于四季秋海棠绿叶红花品系‘超级奥林匹克’遗传转化的研究鲜有报道,相关研究主要集中在秋海棠属为数不多的40 余个种中离体培养和再生体系初步研究方面。Karpova 等通过比较大花海棠离体培养与温室植物叶片色素含量与叶色参数,设计出再生和高效离体繁殖方案[4];张明等以四季秋海棠叶片为外植体建立离体再生体系,移栽成活率为96%[5];Aswathy 等经由组织解剖和遗传特征解读证实离体微繁是一种可靠的马拉巴尔秋海棠大规模繁殖模式[6];Hosseinabadi 等优化用于实现蟆叶秋海棠高效再生体外培养体系[7]。此类研究为秋海棠属植物快速繁殖培育及基因工程研究提供必要的材料体系与技术条件。目前,关于秋海棠属植物遗传转化体系与生物工程研究的报道较多,杨梦洁等借助叶盘转化法确立瓦氏秋海棠稳定遗传转化体系[8];赵志新以叶片为外植体初步建立四季秋海棠遗传转化体系[9];Xu 等研究竹节秋海棠中异位表达KNOX基因产生4 种观赏类型转基因植株[10];Kiyokawa等为3种商业秋海棠品种开发农杆菌介导的遗传转化体系[11]。此类研究对推进该属植物分子育种进程和基因功能鉴定具有重要意义。
借由基因工程技术开展分子育种将成为优良品种选育与物种资源提升的重要手段,而稳定高效的遗传转化体系将为植物基因功能研究提供丰富基因资源,推动植物遗传育种创新与新资源创制。Liang等基于农杆菌高效转化小麦幼胚的Pure⁃Wheat技术筛选得到再生能力与农艺性状更优的小麦品系,为小麦转基因与基因编辑研究提供合适的植物材料[12];王思凡等综合国内外大麻遗传转化研究进展发现,大麻种质资源改良与高价值品种创制有赖于稳定高效的遗传转化方法[13]。
因此,本研究在课题组前期已建立四季秋海棠离体再生体系基础上,以四季秋海棠无菌苗为试验材料,探究农杆菌介导遗传转化体系的建立,优化预培养、农杆菌侵染液浓度(OD600)、侵染时间与共培养等参数,初步建立四季秋海棠高效遗传转化体系,为四季秋海棠分子育种与基因功能研究提供技术支撑,对开展多层次多领域四季秋海棠逆境胁迫应答机制及植物新种质创制提供材料资源。
1 材料与方法
1.1 材料
1.1.1 植物材料
四季秋海棠绿叶红花品系‘超级奥林匹克’种子购自厦门爱垦园艺有限公司。种子播种于1/2MS基本培养基中,置于光照培养箱中培养,培养温度为昼25 ℃/夜23 ℃,光周期为昼14 h/夜10 h,光照强度为10 000 lx,相对湿度为60%,约25 d 后发芽。待无菌苗长至约有10 片展开叶时,选取生长健壮植株的叶片作为外植体材料。
1.1.2 菌株与载体
试验所需根癌农杆菌(Agrobacterium tumefa⁃ciens)菌株GV3101 购自北京擎科生物科技有限公司;pCanG-EGFP超表达载体为深圳仙湖植物园李凌飞老师馈赠,该载体含有35S启动子,NOS终止子,NPTⅡ基因(卡那霉素抗性基因)和EGFP基因(增强型绿色荧光蛋白基因);pCanG-EGFP-BsR⁃bohD过表达载体为实验室保存。
1.1.3 试剂与培养基
乙酰丁香酮(Acetosyringone,AS)、利福平(Rifampicin,Rif)、卡那霉素(Kanamycin,Kan)、羧苄青霉素(Carbenicillin,Carb)、6-苄氨基嘌呤(6-Benzylaminopurine,6-BA)、萘乙酸(1-naphthl⁃cetic acid,NAA)等激素购自郑州金图生物科技有限公司。反转录和荧光定量试剂盒购自杭州硕盟生物科技有限公司。
①LB(农杆菌培养基):酵母提取物5 g·L-1,胰蛋白胨10 g·L-1,NaCl 10 g·L-1;
②MS 培养基:MS 4.4 g·L-1,蔗糖30 g·L-1,琼脂7.8 g·L-1;
1/2MS(基本培养基):MS 2.2 g·L-1,蔗糖30 g·L-1,琼脂7.8 g·L-1;
③MS1(预培养基):MS+0.5 mg·L-16-BA+0.12 mg·L-1NAA;
④MS2(悬浮液):MS;
⑤MS3(共培养基):MS+0.5 mg·L-16-BA+0.12 mg·L-1NAA+AS 100 mol·L-1;
⑥MS4(过渡培养基):MS+0.5 mg·L-16-BA+0.12 mg·L-1NAA+Carb 400 mg·L-1;
⑦MS5(筛选培养基):MS+0.5 mg·L-16-BA+0.12 mg·L-1NAA+Carb 400 mg·L-1+Kan 25 mg·L-1;
⑧MS6(生根培养基):1/2MS+0.12 mg·L-1NAA+Carb 400 mg·L-1+Kan 25 mg·L-1。
用于四季秋海棠组织培养的培养基除MS2外,均加入蔗糖30 g·L-1,琼脂7.8 g·L-1,pH 5.8。121 ℃高温高压灭菌后备用。
1.2 方法
1.2.1 筛选抗生素Kan与抑菌剂Carb浓度的确定
以无菌培养的四季秋海棠叶片为外植体,切成1 cm×1 cm 大小,分别接种至含有不同浓度Kan(0,15,25,35,45 mg·L-1)初代培养基MS1 上。弱光培养每15 d继代一次,40 d后观察统计不同处理中外植体分化率,确定合适筛选浓度。每个处理重复2 次,每次重复接种30 个外植体。通过查阅文献分析农杆菌对Carb 抗性,确定最优抑菌浓度。
1.2.2 四季秋海棠叶片预培养
取无菌苗叶片切成1 cm×1 cm大小,接种至预培养基MS1中暗培养,设置温度23~25 ℃,保持其他条件一致,仅设置不同预培养时间分别为1、2与3 d,诱导外植体处于不同感受态,探究预培养时间对遗传转化效率的影响。
1.2.3 农杆菌侵染液浓度及侵染时间
将携带有目的载体质粒pCanG-EGFP-BsRbohD的根癌农杆菌GV3101 于LB 液体培养基中(含Kan 50 mg·L-1和Rif 50 mg·L-1)28 ℃、220 r·min-1摇菌培养36 h,MS2 悬浮液(MS 4.43 g·L-1)两次重悬农杆菌菌体,条件分别为25 ℃、4 000×g离心10 min收集菌液,弃上清,MS2 悬浮液重悬浮菌体并清洗,25 ℃、5 000×g 离心5 min 收集菌液,再次用MS2重悬液重悬菌体。方法参考刘红利[14]。
两次重悬菌体后,利用MS2 悬浮液分别调整农杆菌菌液终浓度OD600为0.6、0.7 与0.8,保持其他条件一致,加入AS(按体积比AS∶菌液=1∶500)摇匀,黑暗静置1~3 h后侵染叶片。选取预培养后形态完整且长势良好叶片置于侵染液中分别侵染10、12、14 min,侵染过程中不断摇晃使叶片与菌液充分接触,侵染后将叶片置于无菌滤纸上吸干多余菌液。40 d后统计诱导愈伤组织数量,探究遗传转化最适宜侵染时间。
为初步筛选遗传转化4个参数最佳条件,设置预培养2、3 d,共培养2、3、4 d,侵染液浓度OD600=0.6、0.7、0.8,侵染时间10、12、14 min,4个参数不同条件共54 个排列组合;根据初步筛选结果调整预培养和侵染时间设置后3组试验;最终得出遗传转化效率较高的参数组合。
1.2.4 四季秋海棠叶片各培养阶段
①共培养
将侵染后叶片外植体背面向下整齐接种于共培养基MS3 中暗培养,保持其他条件一致,共培养时间分别为2、3与4 d。60 d后统计产生抗性再生植株数量,探究遗传转化最适宜共培养时间。
②过渡培养
选择共培养后生长较好叶片外植体转移至过渡培养基MS4中,于23~25 ℃光照培养箱中弱光培养7 d。
③筛选培养
选择过渡培养后生长较好叶片外植体转移至筛选培养基MS5 中,诱导愈伤组织大量分化出芽。弱光培养每15~20 d继代一次。
④生根培养
30~35 d 后选择筛选培养基中长至一定大小且生长状态良好不定芽切下,转移至生根培养基MS6中,10~15 d可诱导生根。
⑤炼苗移栽
当生根培养基中再生植株生根达到一定数目时,将植株移栽至基质(蛭石∶泥炭土=1∶3)中,于温度23~25 ℃、光照强度10 000 lx光照培养箱中培养。待植株生长健壮后进行转基因植株鉴定。
1.2.5 转基因植株分子鉴定
使用十六烷基三甲基溴化铵法(来自华大基因)提取再生植株叶片DNA,设计引物作PCR 检测。BsRbohD基因(基因登录号MH784503)鉴定引物:BsRbohD-F1:5'CCAGCAGAACACCCCCATC3',BsRbohD-R1:5'CCCAATACACTCGCCGAAC3'(即载体一端引物pCanG-F和目的基因一端引物BsRbo⁃hD-R,扩增长度为799 bp)。PCR反应体系(25 μL):模板(DNA)1 μL,1×T3 Super PCR Mix 22 μL,上下游引物各1 μL。PCR 扩增程序(35 个循环):98 ℃2 min 预变性,98 ℃10 s 变性,60 ℃10 s 退火,72 ℃10 s 延伸,72 ℃2 min 延伸,4 ℃保存。1%琼脂糖凝胶电泳检测。
使用十六烷基三甲基溴化铵法(来自华大基因)提取野生型和转基因植株叶片总RNA,以反转录试剂盒(TOROIVD,RTQ-202P)提供方法获得各株系cDNA,并以此为模板,设计引物进行半定量PCR 检测。四季秋海棠内参基因Bs18S(基因登陆号No.KJ959633)引物:Bs18S-F:5'GCTACCAC ATCCAAGGAAGG3',Bs18S-R:5'CAATGGATCCT CGTTAAGGG3';BsRbohD基因半定量引物、PCR反应体系与扩增程序同DNA水平检测。1%琼脂糖凝胶电泳检测。
利用上段所述模板、内参,以野生型四季秋海棠中BsRbohD基因相对表达量为对照,根据荧光定量试剂盒(TOROIVD,QST-100P)提供方法检测野生型和转基因各株系中BsRbohD基因相对表达量。BsRbohD基因定量引物:BsRbohD-F2:5'AA TGAACGAGGTGGCTGAGA3',BsRbohD-R2:5' T CCTTTTGTACACTTGGCGC3'。PCR反应程序(45个循环):50 ℃2 min 反应,95 ℃1 min 预变性,95 ℃10 s 变性,60 ℃30 s 退火。采用2-ΔΔCT法计算目的基因相对表达量。
1.2.6 pCanG-EGFP转化四季秋海棠
采用pCanG-EGFP 载体代替重组质粒pCanGEGFP-BsRbohD,参照上述遗传转化方法将pCanGEGFP 空载转化四季秋海棠,根据EGFP基因序列设计引物作PCR检测,引物序列为:EGFP-F:5'A TGGTGAGCAAGGGCGAGGAGCTGT3',EGFP-R:5'G GATCCATCGATTTCGAACCCGGGG 3'(扩增长度为747 bp)。
2 结果与分析
2.1 筛选抗生素Kan与抑菌剂Carb浓度确定
在含有一定浓度Kan的MS1培养基上生长一段时间后外植体褐化死亡(见图1)。将外植体分别接种于梯度浓度Kan的MS1培养基上培养40 d后,不同浓度Kan 对叶片分化的影响见表1,四季秋海棠叶片对浓度15 mg·L-1以下Kan有一定适应能力,Kan浓度为15 mg·L-1时,愈伤组织分化率为16.7%,随Kan浓度增加,浓度25 mg·L-1及以上Kan不诱导愈伤组织不定芽分化,因此,25 mg·L-1Kan 作为抗性愈伤组织筛选最适浓度。

图1 卡那霉素对外植体生长的影响Fig.1 Effects of kanamycin on the growth of explants
Carb 在共培养后筛选培养中发挥抑制农杆菌生长的作用,同时,适宜浓度Carb 对受体细胞具有一定生物效应,Carb 分解产物是生长素和萘乙酸,可促进愈伤组织增殖。本研究中Carb 浓度选择400 mg·L-1[15],且经后期试验可知,400 mg·L-1Carb 浓度抑菌效果较好且无害于愈伤组织诱导生根。
2.2 四季秋海棠遗传转化体系条件筛选
54组不同遗传转化条件组合结果表明(见表2),预培养2 d,共培养4 d,侵染液浓度OD600=0.7,侵染时间为10 min 时,可获得成苗数为18,阳性率为11.1%。当预培养与侵染时间较长分别为3 d 与12、14 min时,阳性率均为0。为进一步提升遗传转化效率,在组合22 基础上缩短预培养和侵染时间设置后3组试验。由表2可知,预培养1 d,共培养4 d,侵染浓度OD600=0.7,侵染时间为8 min时,成苗数为17,阳性率较高为58.8%。从叶片外植体初代培养到诱导愈伤组织需30 d,继代培养15~20 d后愈伤组织分化产生大量不定芽,将不定芽移至生根培养基后需10 d生根,待2周后生根数量达到一定程度即可移栽培养(见图2)。

表2 遗传转化体系不同条件组合筛选Table 2 Combination screening of genetic transformation system under different conditions

图2 农杆菌介导四季秋海棠遗传转化过程Fig.2 Agrobacterium-mediated genetic transformation process of B.semperflorens
2.3 转基因植株分子鉴定
对转化试验中获得的两批携带Kan抗性再生植株及野生型植株分别提取叶片DNA,以BsRbohD基因鉴定引物(即载体一端引物pCanG-F和目的基因一端引物BsRbohD-R)作PCR 扩增检测,其中第一批共检测再生植株18 株,第二批共检测再生植株17株。转基因植株共有12株扩增出与阳性质粒一致的条带,非转基因植株与野生型植株均未扩增出条带(见图3)。将PCR扩增条带正确产物送至河南尚亚生物技术有限公司测序,序列比对正确,表明目的基因BsRbohD已整合至四季秋海棠基因组。
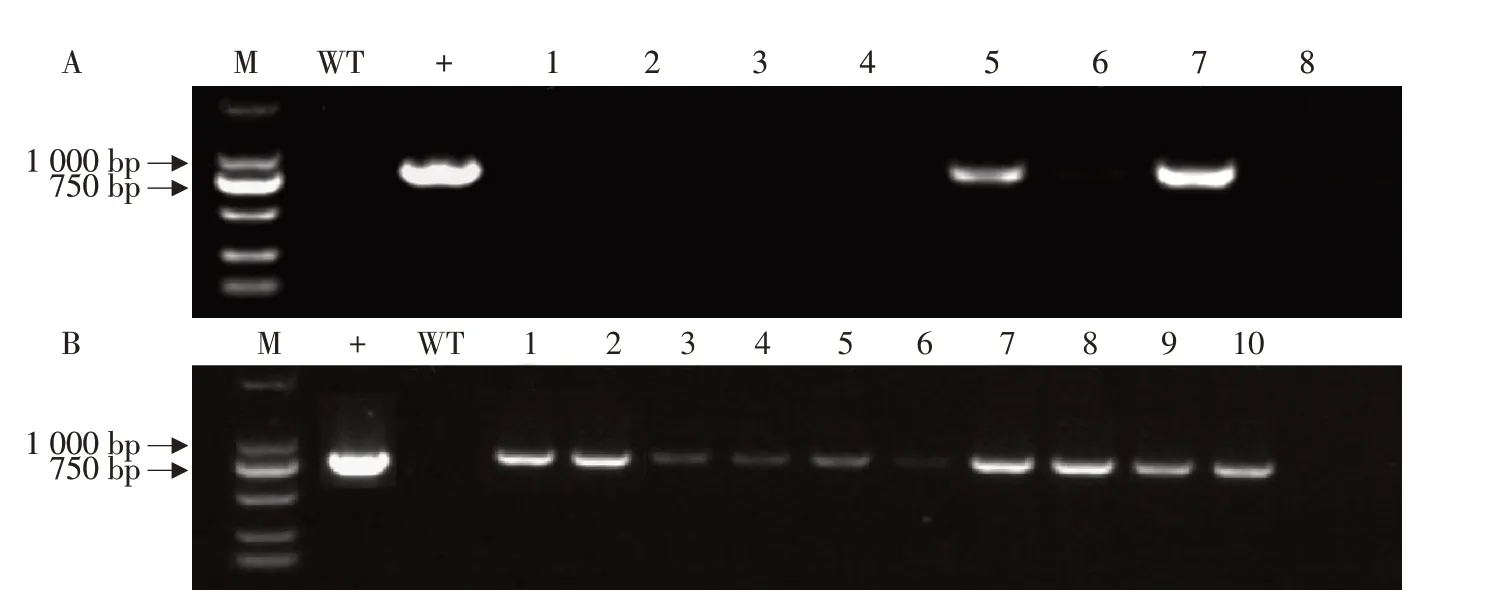
图3 转BsRbohD基因四季秋海棠幼苗DNA分子水平鉴定Fig.3 DNA molecular level identification of B.semperflorens seedlings with BsRbohD gene
为进一步检测目的基因BsRbohD在四季秋海棠转化植株中是否转录,对上述两批转基因阳性植株与野生型植株作半定量PCR 分析。内参基因Bs18S在转基因阳性植株与野生型植株中均表达,而使用特异性引物(载体一端引物pCanG-F和目的基因一端引物BsRbohD-R)检测时,转基因阳性植株均扩增出亮度不一的目标条带,野生型植株均未扩增出条带(见图4)。表明目的基因BsRbohD在四季秋海棠转化植株中转录表达。
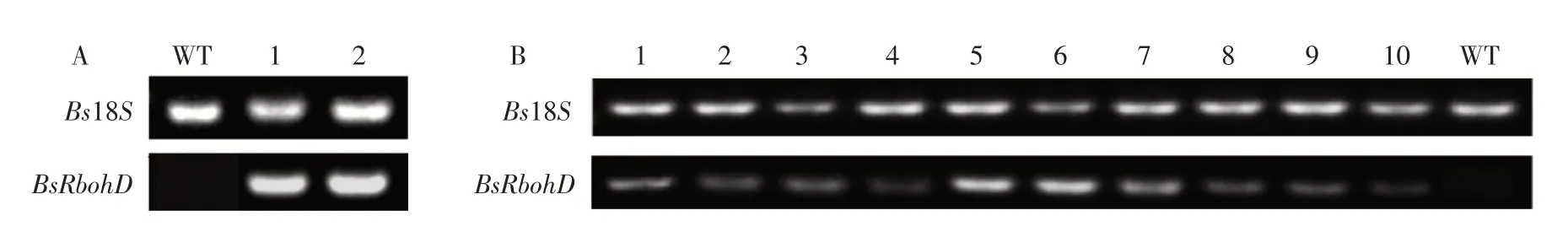
图4 转基因四季秋海棠BsRbohD半定量PCR检测Fig.4 Semi-quantitative PCR detection of BsRbohD in transgenic B.semperflorens
以野生型植株基因表达水平为对照,将12 株转基因阳性植株与野生型植株作实时荧光定量PCR分析。转基因阳性植株BsRbohD基因表达水平均高于野生型植株,为野生型植株5.38~57.74 倍(见图5)。表明BsRbohD基因已转入四季秋海棠并稳定表达,可用于后续试验。至此,农杆菌介导四季秋海棠遗传转化体系已成功建立。
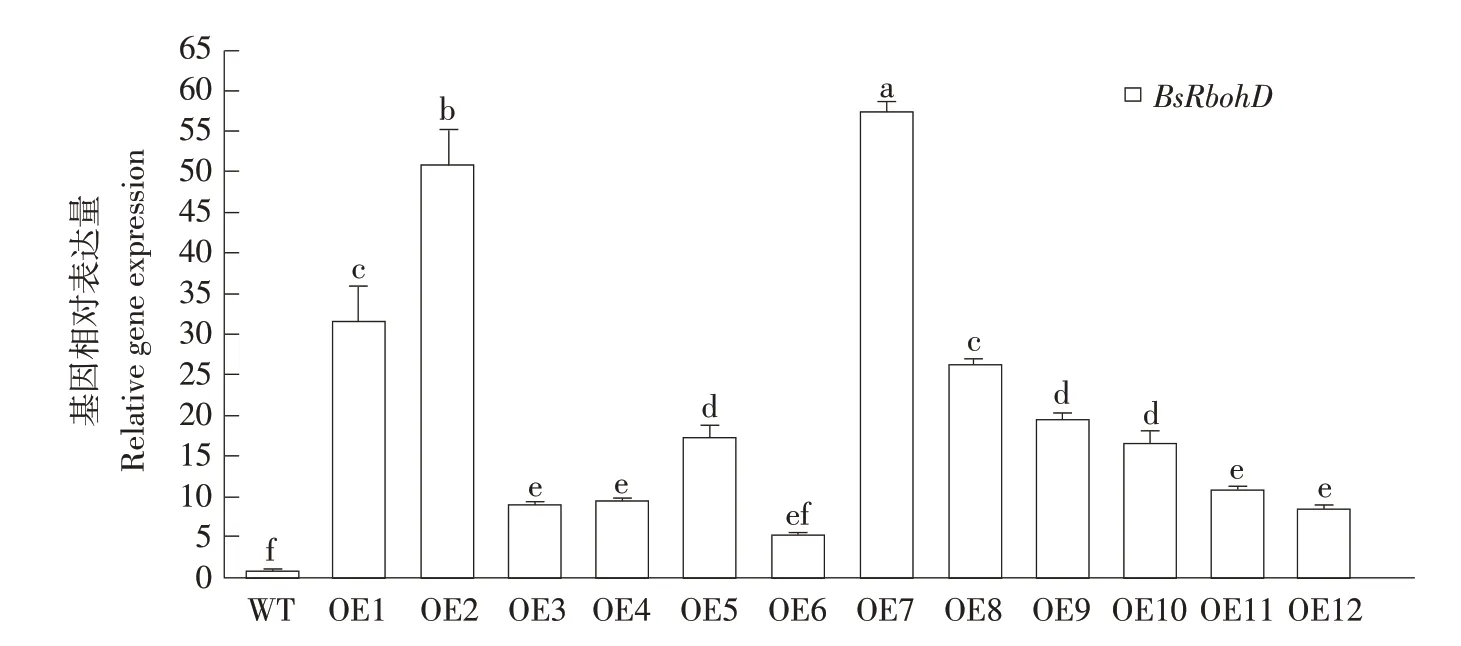
图5 转基因四季秋海棠BsRbohD荧光定量PCR检测Fig.5 Fluorescence quantitative PCR detection of BsRbohD in transgenic B.semperflorens
2.4 转pCanG-EGFP空载体植株获得
为排除载体对受体植物正常生命活动的影响,验证稳定遗传转化体系、检测转化效率并创建多种植物材料资源以利后续研究,通过农杆菌介导将pCanG-EGFP 空载体转化四季秋海棠,经历预培养、共培养、过渡培养、筛选生根和炼苗移栽等过程获得再生植株。以再生植株叶片总DNA 为模板,以EGFP-F/R为引物作PCR扩增检测,可扩增出相应片段8株,表明此pCanG-EGFP空载体已成功转入四季秋海棠基因组(见图6)。

图6 转pCanG-EGFP四季秋海棠幼苗DNA分子水平鉴定Fig.6 DNA molecular level identification of B.semperflorens seedlings transferred to pCanG-EGFP
3 讨 论
秋海棠属植物遗传转化受多种因素联合制约,影响农杆菌介导的四季秋海棠遗传转化效率因素主要包含以下方面:无菌苗状态、外植体类型、抗生素类型及配比、侵染液浓度及侵染、预培养、共培养时间等。
选择合适外植体用于基因转化是成功建立遗传转化体系前提,合适外植体需稳定高效的再生能力。不同植物品种、组织、器官之间分化能力具有较大差异,通常需选择处于生长初期或盛期植株幼嫩部位,此时外植体处于分裂旺盛期,再生能力强,更易于外源基因转化及再生植株培养[16]。秋海棠属植物离体和再生培养相对容易,目前用于其转化的受体体系有叶片、叶柄、芽尖、花梗、花瓣、花粉及嫩茎等。四季秋海棠主要以叶片为外植体,也有用茎段[17]。Aswathy 等研究表明,马拉巴尔秋海棠叶片外植体较茎段外植体愈伤组织产量更为显著[6];陈英转等研究表明,以盾叶秋海棠叶片作为外植体建立高效繁育离体再生体系,再生植株移栽成活率可达90.63%以上[18];Hirutani 等以四季秋海棠叶片为外植体成功实现植株再生与遗传转化[19]。从植物细胞全能性看,无论选取植物体哪一部分作为外植体均可诱导出完整植株,但诱导效果不同[20]。本试验在前人研究基础上,最终选择叶片作为诱导再生植株外植体。因四季秋海棠含水量较大,在菌液侵染过程中较易失水萎蔫,此时生长状态良好叶片外植体抵抗力相对较强,经侵染等过程后存活率更高。
在植物遗传转化过程中,需两种类型抗生素,分别作为抑制农杆菌生长的抑菌剂和筛选转化体的筛选剂,抗生素种类选择和配比是遗传转化体系建立关键环节。本研究中抑菌剂选择400 mg·L-1Carb,且经后期试验可知其抑菌效果较好且无害于愈伤组织诱导生根。筛选剂由转基因植株所携带的载体抗性决定,本试验选择目前植物基因工程中最早广泛使用的Kan,其浓度确定对抗性芽筛选发挥关键作用[21]。四季秋海棠对不同筛选剂敏感性具有差异,课题组前期遗传转化选用的载体抗性是潮霉素(Hygromycin,Hyg),是一种较强的细胞生长筛选剂,对四季秋海棠叶片产生高毒性,外植体在Hyg抗性筛选培养基上约15 d完全褐化死亡。本试验在更换载体后选用Kan作为筛选剂,25 mg·L-1及以上浓度Kan抑制愈伤组织不定芽分化,因此选择25 mg·L-1作为抗生素筛选最适浓度。
预培养与共培养时间对植物遗传转化效率具有一定影响。研究表明,预培养有利于外植体在切口处形成微愈伤,改变其生理生化状态,促进植物组织细胞结合并连接外源基因,提高农杆菌转化率。有部分研究认为,一些外植体遗传转化时无需预培养[22]。共培养为农杆菌提供合适生存环境,增加外植体与农杆菌接触,促使目的基因与受体基因组整合。共培养时间过短将导致农杆菌活化程度低,不利于外源基因整合;共培养时间过长导致农杆菌迅速繁殖,阻碍植物吸取养分从而抑菌困难或死亡[23]。本试验探讨不同预培养与共培养时间对遗传转化效率的影响,预培养时间为1 d、共培养时间为4 d时,遗传转化效果优。
农杆菌侵染液浓度和侵染时间也是遗传转化体系建立关键因素。如侵染液浓度过低,与外植体接触的菌液量就减少,致使转化效率降低;侵染液浓度过高,农杆菌细胞内部将产生相互拮抗使其无法生长转化。侵染时间是外植体含农杆菌数量的关键因素,侵染时间过短导致基因整合概率降低而无法获得转基因植株;侵染时间过长,外植体由于菌液持续侵害而失去分化能力,抑菌能力弱,降低转化效率。在选择农杆菌合适制备与应用方法的前提下,保证农杆菌侵染效率又避免农杆菌污染[24-25]。农杆菌菌液OD600=0.7、侵染时间8 min为最佳转化条件。
4 结 论
随着现代生物技术发展,稳定高效的植物再生和遗传转化体系的建立将克服在植物中开展基因工程研究的主要障碍,对阐明植物观赏性状分子机制和应用基因组编辑技术不可或缺。更为转基因技术体系应用于遗传学、基因组学与基因整合探析,将带来植物遗传学研究的革命。实现跨物种植物遗传转化体系的标准化与精简化将成为植物分子生物学进程推进的关键[26-27]。
本研究利用农杆菌介导法将四季秋海棠BsRbo⁃hD外源目的基因导入叶片外植体,对四季秋海棠‘超奥’品种进行一系列遗传转化过程探索。分别从预培养时间、侵染液浓度、侵染时间和共培养时间4个方面确立最佳转化条件,通过转基因植株分子鉴定获得12 株转基因阳性植株及8 株空载体植株。其中转基因阳性植株最高阳性率为58.8%,BsRbohD基因已转入四季秋海棠并稳定表达;转空载体植株的成功获得表明转染质粒对受体植物细胞无影响,表明该体系可用于四季秋海棠稳定遗传转化。未来可通过多种生物学技术确定受体材料最佳处理时期以获得更加稳定高效的遗传转化率[28],并借由四季秋海棠遗传转化体系深入构筑BsRbohD等基因分子调控网络。

