基于代谢组学与琥珀酸/血管内皮生长因子信号通路的雷公藤煨制增效机制研究
陈 殊,石宣宜,顾子娴,陈家毅,蒋红霞,张 亮,孙 群,刘建群
· 药理与临床•
基于代谢组学与琥珀酸/血管内皮生长因子信号通路的雷公藤煨制增效机制研究
陈 殊,石宣宜,顾子娴,陈家毅,蒋红霞,张 亮,孙 群,刘建群*
江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004
观察雷公藤煨制前后对胶原诱导型关节炎(collagen-induced arthritis,CIA)模型大鼠的影响,并基于代谢组学与琥珀酸/血管内皮生长因子(vascular endothelial growth factor,VEGF)炎症信号通路共同探索雷公藤煨制的增效机制。采用大鼠尾根部皮内注射牛II型胶原乳剂复制CIA大鼠模型,分别给予醋酸地塞米松、雷公藤生品总提取物、雷公藤煨制品总提取物治疗20 d。通过大鼠足肿胀度、关节炎评分、血清中白细胞介素-1β(interleukin-1β,IL-1β)水平、滑膜病理组织切片评估药效;采用代谢组学技术对各组间的代谢差异进行表征;检测滑膜中琥珀酸脱氢酶(succinate dehydrogenase,SDH)活力以及琥珀酸和富马酸的含量;采用免疫组化法检测滑膜组织VEGFA、血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1,CD31)表达。与模型组比较,雷公藤生品总提取物组和煨制品总提取物组大鼠足肿胀度和关节炎评分显著降低(<0.05),血清中IL-1β水平显著降低(<0.05),滑膜组织病理改变明显减轻,滑膜中琥珀酸含量显著降低(<0.05),SDH活力无明显改变,滑膜组织VEGFA和CD31表达均显著下调(<0.05)。与生品总提取物组比较,煨制品总提取物组SDH活力无明显改变,其余各项指标明显更向对照组接近(<0.05)。代谢组学结果表明,从模型组中共筛选出15个差异代谢物,经煨制总提取物治疗后,6个差异代谢物较模型组明显回调(<0.05),且与生品总提取物组相比明显更接近对照组(<0.05)。这些代谢物的变化涉及了缬氨酸、亮氨酸和异亮氨酸生物合成、色氨酸代谢、能量代谢、花生四烯酸代谢。煨制可显著提高雷公藤对CIA模型大鼠的治疗效果,其增效作用机制可能与调控缬氨酸、亮氨酸和异亮氨酸生物合成,色氨酸代谢,能量代谢,花生四烯酸代谢途径有关。雷公藤可通过调节琥珀酸/VEGF信号通路改善类风湿关节炎,煨制可增强雷公藤对该信号通路的调控从而发挥增效作用。
雷公藤;煨制;类风湿关节炎;代谢组学;琥珀酸/血管内皮生长因子炎症信号通路;1-羟基-2,5,8-三甲基-9-芴酮1-1-羟基-2,5,8-三甲基-9-芴酮;雷公藤甲素;tripfordine A;雷公藤内酯酮;雷公藤红素;雷公藤晋碱;雷公藤定碱;雷公藤次碱
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性自身免疫性疾病,以关节滑膜炎症和血管新生为主要病理特征,具有较高发病率与致残率[1]。据估计,高达80%的RA患者有一种或多种并发症,从而导致寿命缩短[2]。严重影响患者的健康和生活质量,造成了沉重的社会负担。目前,最常用于治疗RA的药物主要是改善病情类抗风湿药、新型生物制剂、非甾体抗炎药、糖皮质激素等,长期使用这些药物不良反应较多,且治疗周期较长,患者难以坚持,导致治疗效果不佳[3]。因此,开发高效低毒的药物来治疗RA具有重要意义。
雷公藤Hook. f.为卫矛科雷公藤属植物,具有祛风除湿、消除止痛、活血化瘀、解毒杀虫等功效[4]。雷公藤自1969年来被广泛应用于RA的治疗,疗效显著,是国内治疗RA的首选单味中药[5]。然而,雷公藤对肝、肾、心血管系统、泌尿系统、血液系统、生殖系统等有明确的损害,限制了其临床应用[6-7]。本课题组前期研究发现煨制雷公藤不良反应较小,治疗佐剂性关节炎的效果显著优于生药[8],然而煨制对雷公藤的增效作用机制尚不清楚。代谢组紊乱是RA发生发展过程中的重要事件,RA发病过程中会影响到代谢的多个途径,从而对机体代谢物产生影响,代谢组学可从系统生物学角度为RA的治疗提供新的思路[9-10]。琥珀酸是能量代谢中三羧酸循环的中间代谢产物,其在滑膜组织中的堆积是RA有别于其他关节炎的标志,也被认为是导致滑膜病理变化的关键因素之一[11]。研究表明,抑制琥珀酸的堆积可降低血管内皮生长因子(vascular endothelial growth factor,VEGF)的产生和滑膜组织中内皮细胞的活化,抑制血管新生,从而改善RA[12]。琥珀酸可作为一个潜在的信号分子将代谢与血管新生联系起来。基于此,本实验建立胶原诱导型关节炎(collagen-induced arthritis,CIA)大鼠模型以评价煨制前后雷公藤治疗RA的疗效差异,同时基于代谢组学与琥珀酸/VEGF炎症信号通路共同探讨雷公藤煨制抗RA的增效作用机制。
1 材料
1.1 动物
SPF级雄性SD大鼠35只,体质量170~190 g,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK(赣)2019-0004。动物适应性饲养7 d后用于实验,温度23~26 ℃,相对湿度50%~70%。动物实验经江西中医药大学实验动物伦理委员会批准(批准号JZLLSC20220515)。
1.2 药材
雷公藤根采自江西省萍乡市,经江西中医药大学刘建群教授鉴定为卫矛科植物雷公藤Hook. f.的根。
1.3 药品与试剂
醋酸地塞米松(批号20210601)购自新乡市常乐制药有限责任公司;对照品1-羟基-2,5,8-三甲基-9-芴酮、tripfordine A、雷公藤定碱、雷公藤晋碱均为本实验室自制,质量分数均>98%;对照品雷公藤红素(批号FY210927)、雷公藤甲素(批号FY140320)、雷公藤内酯酮(批号FY140325)及雷公藤次碱(批号FY140323)均购自郑州丰耀农业科技有限公司,质量分数均>98%;琥珀酸(批号MUST-11052307)购自成都曼斯特生物科技有限公司;富马酸(批号F-016-170426)购自成都瑞芬思生物科技有限公司;牛II型胶原(批号20022)、不完全弗氏佐剂(批号7002)均购自美国Chondrex公司;白细胞介素-1β(interleukin-1β,IL-1β)检测试剂盒(批号20221025)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)检测试剂盒(批号20221017)均购自南京建成生物工程研究所;乙腈(质谱级,批号C11976742)购自德国Merck公司;甲醇(质谱级,批号L2017082)、甲酸(质谱级,批号J2022123)均购自上海阿拉丁生化科技股份有限公司;VEGFA抗体(批号19003-1-AP)购自美国Proteintech公司;血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1,CD31)抗体(批号Bs-0468R)、生物素标记山羊抗兔抗体(批号bs-0295G-Bio)、HRP标记链霉亲和素(批号bs-0437P-HRP)均购自北京博奥森生物技术有限公司;二氨基联苯胺显色试剂盒(批号ZLI-9017)购自北京中杉金桥生物技术有限公司。
1.4 仪器
Acquity UPLC液相色谱系统、Q-TOF SYNAPT G2 HDMS型质谱仪(美国Waters公司);Milli-Q型超纯水仪(美国MilliPore公司);Agilent1260型高效液相色谱仪(美国Agilent公司);SPARK 10M型多功能酶标仪(瑞士TECAN公司);YLS-7B型足趾容积测量仪(济南益延科技发展有限公司);MF43型显微镜、MC50型数码成像测量分析系统(广州明美科技有限公司)。
2 方法
2.1 药物制备
按照本课题组前期研究方法制备雷公藤生品总提取物(total extract,TE)和煨制品总提取物(roasted total extract,RTE)[8]。将雷公藤根药材均分为2份,其中1份用黄泥均匀包裹,包层厚度约0.3 cm,于200 ℃的烘箱中煨制45 min,凉透后剥离黄泥。将经煨制处理的药材和未经处理的药材分别切碎,均采用5倍量70%乙醇回流提取3次(1.5、1.5、1 h)。提取液合并浓缩,减压蒸干,即得到TE和RTE。
2.2 TE和RTE成分分析及含量测定
研究表明,雷公藤甲素、雷公藤内酯酮、雷公藤红素以及生物碱是雷公藤的主要有效成分[13-15],课题组前期研究发现雷公藤红素及其煨制转化物1-羟基-2,5,8-三甲基-9-芴酮,以及生物碱是雷公藤煨制后显著变化的成分[16],故本研究选取雷公藤甲素、雷公藤内酯酮、雷公藤红素、雷公藤次碱、雷公藤晋碱、雷公藤定碱、tripfordine A(生物碱)、1-羟基-2,5,8-三甲基-9-芴酮8个成分对TE和RTE进行成分分析及含量测定。
2.2.1 对照品溶液的制备 精密称取对照品雷公藤甲素、雷公藤内酯酮、雷公藤红素、雷公藤次碱、雷公藤晋碱、雷公藤定碱、tripfordine A、1-羟基-2,5,8-三甲基-9-芴酮适量,加甲醇溶解并定容,均制成质量浓度为1 mg/mL的对照品储备液。上述对照品储备液各取0.5 mL于5 mL量瓶中,加甲醇定容,即得各对照品质量浓度为0.1 mg/mL的混合对照品溶液。
2.2.2 供试品溶液的制备 精密称取TE 0.1 g(相当于生药材0.794 g)、RTE 0.093 5 g(相当于生药材0.794 g),用甲醇溶解后定容于10 mL量瓶中,即得10 mg/mL TE供试品溶液和9.35 mg/mL RTE供试品溶液。
2.2.3 成分分析及含量测定 根据混合对照品溶液和供试品溶液的HPLC图谱,对比分析TE和RTE中的主要成分及煨制后显著变化的成分,采用外标法计算雷公藤甲素、雷公藤内酯酮、雷公藤红素、雷公藤次碱、雷公藤晋碱、雷公藤定碱、tripfordine A、1-羟基-2,5,8-三甲基-9-芴酮在TE和RTE中的含量。色谱条件:Diamonsil C18色谱柱(250 mm×4.6 mm,5 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~10 min,5%~25% B;10~12.5 min,25%~30.5% B;12.5~30 min,30.5%~47% B;30~47 min,47%~72% B;47~57 min,72%~100% B;57~60 min,100% B;体积流量1 mL/min;检测波长218 nm;进样量10 μL;柱温为室温。
2.3 CIA大鼠模型的制备
根据文献中的方法复制CIA大鼠模型[17]。将等体积的牛II型胶原溶液和不完全弗氏佐剂在冰浴上用手持式匀浆机充分混匀制备乳剂,质量浓度为1 mg/mL。大鼠尾根部皮内注射0.2 mL乳剂进行初次免疫,7 d后继续注射0.1 mL上述乳剂加强免疫。
2.4 动物分组及给药
取7只大鼠作为对照(control,CON)组,剩余大鼠均尾根部皮内注射胶原乳剂复制模型,CON组大鼠于同部位注射等体积生理盐水。加强免疫后挑选造模成功的大鼠随机均分为模型(model,MOD)组、醋酸地塞米松(dexamethasone acetate,DXMS)组、TE组和RTE组,每组7只。实验约第21天出现炎症症状后,开始连续ig给药20 d。CON组和MOD组ig等体积的5%羧甲基纤维素钠溶液,DXMS组ig醋酸地塞米松4.72 mg/kg(根据临床等效剂量换算),TE组和RTE组参照课题组前期研究给药剂量分别ig 4.5 g/kg各提取物(按生药量计)[8]。
2.5 样本的采集及处理
于末次给药后收集尿液样本,将大鼠放入代谢笼,禁食不禁水,收集6 h的尿液,收集后置于−80 ℃冰箱保存。将收集的尿液各取500 µL合并于干燥离心管中,涡旋60 s混合均匀,标记为质控样品。另外,所有样品各取500 µL,分别置于干燥离心管中,4 ℃、4000 r/min离心10 min,加甲醇3 mL,涡旋3 min,4 ℃、12 000 r/min离心15 min,取上清液3 mL,氮气吹干后加甲醇200 μL复溶。复溶液涡旋3 min后,4 ℃、12 000 r/min离心15 min,取上清液转移至自动进样瓶中进行UPLC-Q-TOF-MS分析。大鼠在收集完尿液后麻醉,采用腹主动脉取血,采血后室温静置1 h,3000 r/min离心15 min,分离血清用于炎症因子IL-1β的检测。最后取大鼠肝、肾以及滑膜组织于4%多聚甲醛中固定。
2.6 观察指标及检测方法
2.6.1 一般状况观察 分别于造模前、给药前、给药后观察并记录大鼠的饮食情况、毛色状态及行为变化等肉眼可见的特征。
2.6.2 足肿胀度检测及关节炎评分 给药后0、4、8、12、16、20 d用足趾容积测量仪测量大鼠足趾容积,并进行关节炎评分。关节炎评分标准[18]:0分为无肿胀、红肿;1分为跗骨或踝关节出现红肿;2分为从脚踝到跗骨出现肿胀和发红;3分为从脚踝到跖骨关节出现红肿;4分为脚踝、跗骨和跖骨周围红肿。大鼠的关节炎评分大于4分,则表示造模成功,大鼠单个肢体的得分不能超过4分,共计得分不能超过16分。
足趾肿胀度=造模后足趾容积平均值-造模前足趾容积平均值
2.6.3 IL-1β含量检测 严格按试剂盒说明书,采用ELISA法检测血清中IL-1β的含量。
2.6.4 代谢组学分析条件 Waters Acquity UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7 μm),流动相为0.1%甲酸水溶液(A)-含0.1%甲酸的乙腈溶液(B),梯度洗脱:0~2 min,5% B;2~16 min,5%~29% B;16~21 min,29%~47% B;21~24 min,47%~80% B;24~26 min,80%~95% B;26~32 min,95% B;32~32.1 min,95%~5% B;32.1~34 min,5% B;体积流量0.3 mL/min;进样量3 μL;柱温30 ℃;样品室温度10 ℃。
离子源温度为120 ℃,采用正离子扫描模式,毛细管电压为3.0 kV,锥孔电压为40 V,采集范围为/50~1000。为确保质量的准确性和重复性,利用亮氨酸脑啡肽进行实时质量校正。为保证整个分析系统的稳定性,在本实验中使用质控样品进行方法学验证,质控样品由每个正常样品各取500 μL混合而得。同一模式下,批量样品检测时以随机顺序进行,以减少误差。
2.6.5 肝、肾及滑膜组织病理学的检测 4%多聚甲醛固定后的肝、肾及滑膜组织进行常规的苏木素-伊红(HE)染色,在光镜下观察各组肝、肾及滑膜组织病变情况。
2.6.6 滑膜组织中SDH活性及琥珀酸含量测定
(1)SDH活性测定:将滑膜组织用液氮冻硬后立即研磨成粉,根据其质量加入10倍的生理盐水以制备匀浆。取滑膜组织匀浆液,参照说明书检测SDH活性。
(2)琥珀酸含量测定[19]:吸取300 μL滑膜匀浆加入等量的0.5 mol/L高氯酸混合均匀,样品冰浴10 min后,4 ℃、14 000 r/min离心20 min,上清液通过0.45 μm微孔膜过滤器滤过。制备浓度为1 000 μmol/L的标准溶液,用0.45 μm微孔膜过滤至注射瓶中。HPLC分析条件:Ultimate AQ-C18色谱柱,以0.02 mol/L磷酸二氢钾溶液(pH 2.5)为流动相进行等度洗脱,体积流量1 mL/min,波长210 nm,柱温25 ℃,进样量10 μL。
2.6.7 免疫组化法检测滑膜组织VEGFA、CD31表达 取“2.6.5”项下石蜡切片,经脱蜡、水化处理后,用pH 6.0的柠檬酸缓冲液修复抗原,3% H2O2室温孵育10 min以消除内源性过氧化氢酶活性,3%牛血清白蛋白溶液室温封闭15 min。随后滴加VEGFA(1∶200)、CD31(1∶200)一抗工作液,4 ℃孵育过夜;加入生物素标记的二抗,37 ℃孵育15 min;加入HRP标记链霉亲和素工作液,37 ℃孵育15 min。最后加二氨基联苯胺显色,苏木素复染,脱水、透明,中性树胶封片,于显微镜下观察并拍照,采用Image-Pro Plus 6.0软件读取平均吸光度()值进行统计分析。
2.7 数据处理与统计学分析

3 结果
3.1 TE和RTE HPLC分析
混合对照品溶液和供试品溶液的HPLC分析见图1,雷公藤甲素、雷公藤内酯酮、雷公藤红素、雷公藤次碱、雷公藤晋碱、雷公藤定碱、tripfordine A、1-羟基-2,5,8-三甲基-9-芴酮在TE和RTE中的含量见表1。
3.2 各组大鼠一般状况检查
各组大鼠在造模成功后出现进食减少,神态疲倦,常处于休息状态,大鼠足爪部位可见红斑与肿胀,关节功能活动障碍,活动迟缓,部分大鼠常因疼痛难忍而啃咬红肿部位。治疗结束后,CON组大鼠精神状况良好,毛色光泽,行为活跃,反应灵敏;MOD组与之前没有明显变化;TE组和RTE组大鼠食欲恢复,神态与活动皆正常,足肿胀度明显减轻;DXMS组大鼠神态与活动皆正常,足肿胀度明显减轻,但食欲仍未恢复。
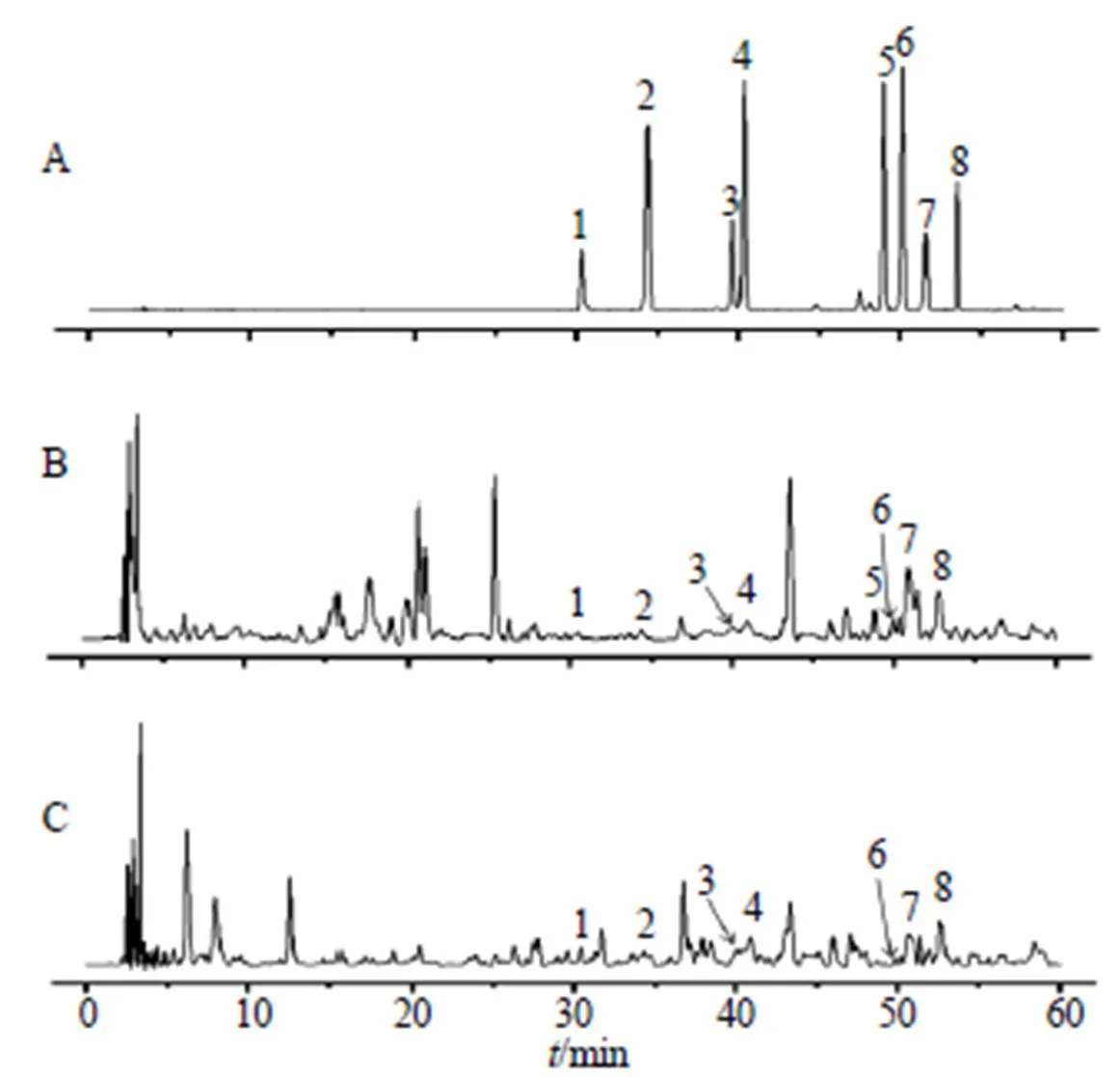
1-1-羟基-2,5,8-三甲基-9-芴酮 2-雷公藤甲素 3-tripfordine A 4-雷公藤内酯酮 5-雷公藤红素 6-雷公藤晋碱 7-雷公藤定碱 8-雷公藤次碱

表1 TE和RTE中8个成分的含量
3.3 各组大鼠肝、肾组织病理变化
如图2所示,各组大鼠肝组织结构正常,肝小叶结构清晰,肝索排列整齐,未见炎性细胞浸润和纤维组织增生,肝细胞正常,未见肝细胞变性、水肿、坏死。各组大鼠肾组织结构正常,细胞质和细胞核染色清晰,肾小管腔、肾小球和囊腔完整,无充血或炎性细胞浸润现象。肝肾组织切片结果表明,各药物在该剂量下连续给药20 d不产生明显的肝、肾毒性。
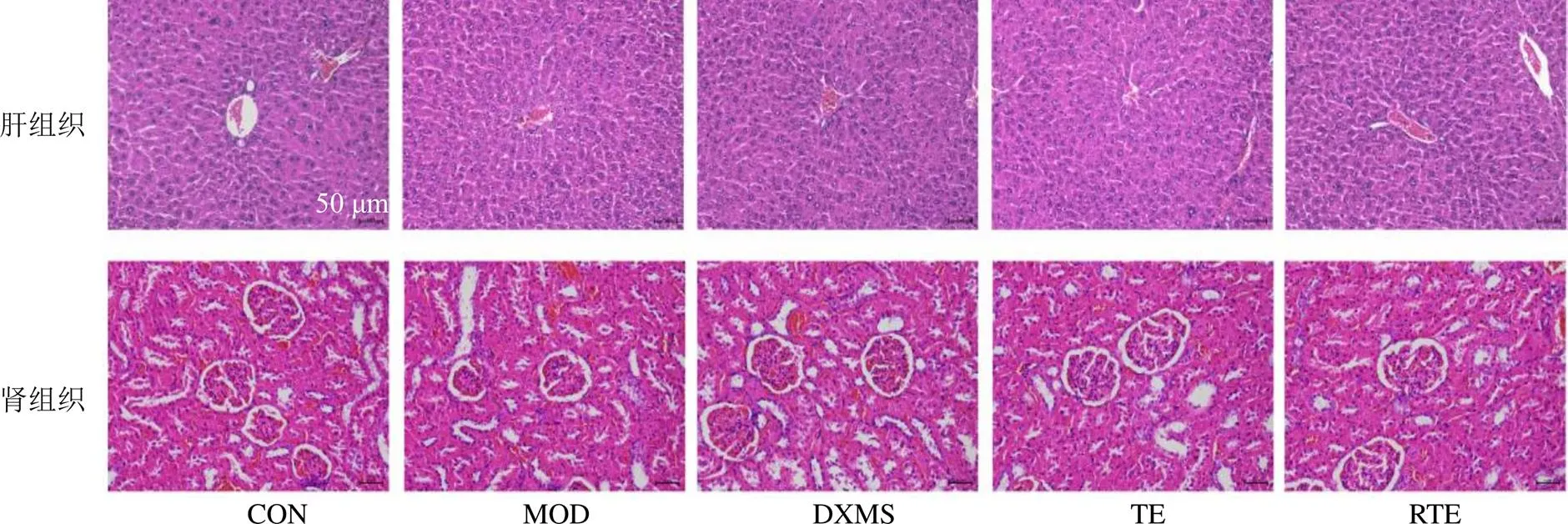
CON-对照组 MOD-模型组 DXMS-醋酸地塞米松组 TE-生品总提物组 RTE-煨制品总提物组,下图同
3.4 各组大鼠关节炎评分及足肿胀度
如图3所示,与CON组比较,MOD组足肿胀度和关节炎评分显著升高(<0.05);与MOD组比较,TE组和RTE组自给药第4天后足肿胀度显著降低(<0.05),自给药第12天后关节炎评分显著降低(<0.05)。RTE组自给药第12天后足肿胀度和给药第16天后关节炎评分显著低于TE组(<0.05),并且趋势更向CON组靠近。
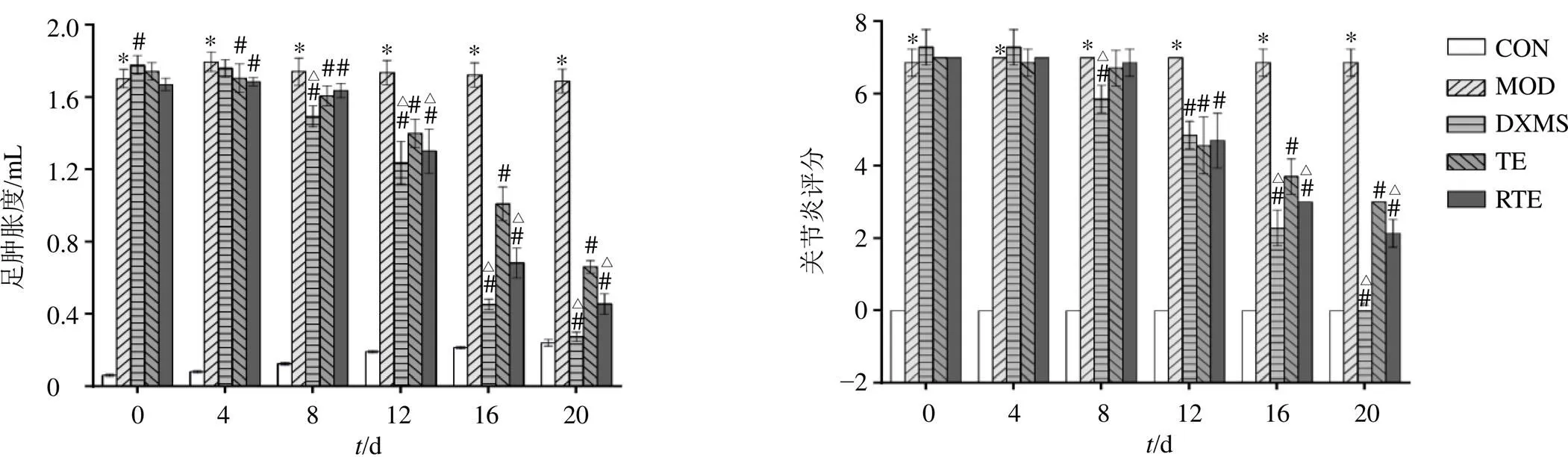
与CON组比较:*P<0.05;与MOD组比较:#P<0.05;与TE组比较:△P<0.05,下图同
3.5 雷公藤煨制前后对CIA大鼠血清中IL-1β水平的影响
如图4所示,与CON组比较,MOD组大鼠血清中IL-1β水平显著升高(<0.05);与MOD组比较,各给药组IL-1β水平均显著下降(<0.05);与TE组比较,RTE组IL-1β水平显著下降(<0.05)。
3.6 尿液代谢组学
3.6.1 大鼠尿液总离子流图 采用UPLC-Q-TOF-MS进行尿液样品的分离和数据采集,得到各组大鼠尿液的总离子流图(图5)。结果发现各组样品的总离子流图基本相似,但各组峰形及峰面积存在一定差异,表明大鼠体内部分代谢物发生变化。

图4 各组大鼠血清中IL-1β水平(, n = 7)

图5 正离子模式下大鼠尿液总离子流图
3.6.2 PCA和OPLS-DA分析 首先应用PCA散点图(图6)过滤异常值,然后采用OPLS-DA(图7)对数据进行分析以突出组间差异,便于后续寻找潜在差异生物标志物。PCA结果显示,各组样本之间存在一定的交叉,但CON组与MOD组样本可较明显地分开,表明CIA大鼠尿液中的代谢物发生了明显的变化。OPLS‐DA结果显示,CON组和MOD组、DXMS组与MOD组、TE组与MOD组、RTE组与MOD组以及TE组和RTE组分离明显,显示了良好的模型适应性。为了避免过度拟合,本研究还进行了OPLS-DA模型验证(置换检验=200)。结果见图7,模型具有较好的稳定性且不存在过拟合现象。

图6 各组大鼠尿液PCA散点图
3.6.3 生物标志物的筛选 通过VIP值(VIP>1)及值(<0.05)筛选出差异性化合物。将差异性化合物精确的分子离子在HMDB数据库中进行数据识别,找出对应物质,见表2。通过对比CON组和MOD组,最终从尿液中筛选出5-羟基吲哚乙酸、白三烯B4、尿苷5′-单磷酸等15个与RA相关的生物标志物。9个生物标志物在TE治疗后明显回调,为TE潜在的抗RA生物标志物,包括 ()-2-乙酰-2-羟基丁酸、肌酸、5-羟基吲哚乙酸、-乙酰色氨酸、-棕榈酰色氨酸、5-甲酰胞嘧啶、白三烯B4、磷脂酸(8∶0/10∶0)、3-羟基-4,6-庚二炔-1-yl-1-葡萄糖苷。其中RTE组 ()-2-乙酰-2-羟基丁酸、5-羟基吲哚乙酸、-乙酰色氨酸、肌酸、磷脂酸(8∶0/10∶0)、白三烯B4等代谢物水平与TE组相比具有显著性差异(<0.05),并向CON组回调,为RTE潜在的抗RA增效生物标志物,见图8。

图7 各组大鼠尿液OPLS-DA及相应模型验证图

表2 各组大鼠尿液中内源性差异代谢物
表示MOD组相对于CON组上调,表示MOD组相对于CON组下调;Û表示TE组相对于MOD组上调,¤表示TE组相对于MOD组下调;Î表示RTE组相对于MOD组上调,Ð表示RTE组相对于MOD组下调
means MOD groupCON group increase, means MOD groupCON group decrease; Û means TE groupMOD group increase, ¤ means TEMOD group decrease; Î means RTE groupMOD group increase, Ð means RTE groupMOD group decrease

图8 与煨制增效相关的差异代谢物含量(, n = 7)
3.6.4 代谢通路分析 将筛选出的差异代谢物进行代谢途径通路分析,结果见图9。缬氨酸、亮氨酸和异亮氨酸生物合成,能量代谢,色氨酸代谢,花生四烯酸代谢,嘧啶代谢与RA的发生发展有关。RTE可通过调节缬氨酸、亮氨酸和异亮氨酸生物合成,能量代谢,色氨酸代谢,花生四烯酸代谢途径来减轻炎症反应,并且通过这些途径发挥其增效作用。
3.7 琥珀酸/VEGF信号通路
3.7.1 滑膜组织病理切片 如图10所示,CON组、DXMS组和RTE组可见滑膜细胞排列规则,滑膜内纤维间质排列疏松,无炎性细胞浸润;MOD组可见滑膜增生明显,内衬细胞层次增加明显,间质纤维增生,伴有大量炎性细胞浸润;TE组可见滑膜增生,间质纤维增生,伴有少量炎性细胞浸润。

红色表示相对于模型组上调,绿色表示相对于模型组下调

图10 各组大鼠滑膜组织病理变化(HE, ×100)
3.7.2 对SDH活性及琥珀酸、富马酸含量的影响 如图11所示,与CON组比较,MOD组SDH活力、富马酸含量明显下降(<0.05),琥珀酸含量明显上升(<0.05);与MOD组比较,各给药组SDH活力、富马酸含量均无显著性差异,琥珀酸含量明显下降(<0.05);与TE组比较,DXMS组和RTE组SDH活力、富马酸含量均无显著性差异,琥珀酸含量明显下降(<0.05)。
3.7.3 对VEGFA、CD31表达的影响 如图12所示,与CON组比较,MOD组CD31和VEGFA表达明显增加(<0.05);与MOD组比较,各给药组CD31和VEGFA表达均明显减少(<0.05);与TE组比较,DXMS组和RTE组CD31和VEGFA表达均明显减少(<0.05)。

图11 雷公藤煨制前后对CIA大鼠滑膜组织中SDH活力以及琥珀酸、富马酸含量的影响(, n = 6)
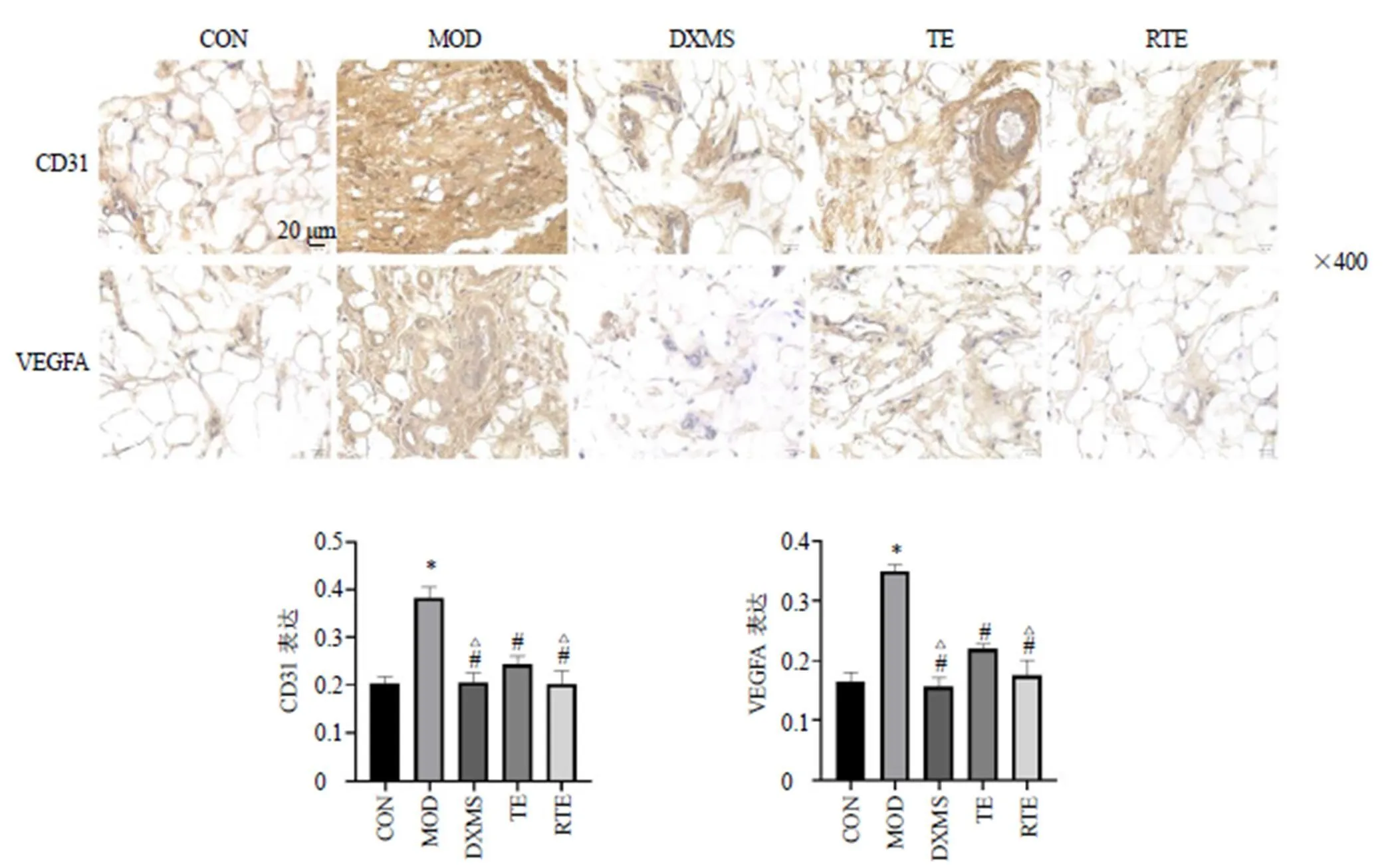
图12 雷公藤煨制前后对CIA大鼠滑膜组织CD31和VEGFA表达的影响 (, n = 6)
4 讨论
CIA模型是一种经典的临床前模型,与人类RA的发病机制最为相似,是目前公认研究RA病理机制和评价治疗药物的最佳动物模型[20]。模型大鼠的足肿胀程度和关节滑膜病理形态学的改变可以反映药物的疗效和作用强度,常用于药物有效性评价和药物筛选。IL-1β是与RA的发生发展过程中关系密切的促炎症细胞因子,在RA患者及CIA大鼠血清中的水平显著高于健康组[21-22]。本研究发现RTE可明显降低CIA大鼠足肿胀程度、关节炎评分、血清中IL-1β水平,改善关节滑膜增生和炎性细胞浸润,且效果显著优于TE,说明煨制对雷公藤具有确切的增效作用。
4.1 代谢组学分析
代谢组学是一种可在机体内快速筛选药物疗效或毒性的系统生物学技术,采用“自上而下”的策略,在整体环境中反映生物系统代谢网络的最终症状,与中药治病整体性、动态性原则极其相似,可为评估中药的疗效和机制提供一种新思路[23-24]。本研究基于代谢组学技术分析了雷公藤煨制前后对CIA模型大鼠的尿液代谢产物的影响,共筛选出15个潜在的RA生物标志物,其中5-羟基吲哚乙酸、尿苷5′-单磷酸、肌酸、白三烯B4、-乙酰色氨酸据以往的报道证明为可靠的RA生物标志物,对于疾病的发生具有重要意义。而 ()-2-乙酰-2-羟基丁酸、环状-乙酰羟色胺葡萄糖醛酸苷、β-胍基丙酸、-棕榈酰色氨酸、5-甲酰胞嘧啶在以往的研究中鲜有报道,为本研究新发现的RA相关生物标志物。在TE组中鉴定出9个与抗RA相关的生物标志物,在RTE组鉴定出6个与抗RA相关的生物标志物。通过对比分析发现,RTE组中的6个抗RA生物标志物与TE组高度重合,且与TE组相比明显更向CON组回调。代谢通路分析显示,TE和RTE均通过调节缬氨酸、亮氨酸和异亮氨酸生物合成,能量代谢,色氨酸代谢,花生四烯酸代谢发挥抗RA作用,煨制增效的机制可能与调控这些途径有关。
()-2-乙酰-2-羟基丁酸是一种短链酮酸,参与缬氨酸、亮氨酸和异亮氨酸生物合成代谢途径,其中主要影响异亮氨酸的生物合成。异亮氨酸是一种支链氨基酸,研究显示支链氨基酸可以刺激肿瘤坏死因子、细胞因子(如IL-1β)的产生[25],这与本研究中CIA大鼠血清中IL-1β升高结果一致。此外,异亮氨酸可以影响5-羟色胺(5-hydroxytryptamine,5-HT)前体物质的运转,造成中枢神经的疲劳[26],这与本研究中模型大鼠神态疲倦相符合。本研究中,与CON组相比,MOD组中 ()-2-乙酰-2-羟基丁酸含量显著下降。()-2-乙酰-2-羟基丁酸含量的变化影响了异亮氨酸的合成,从而刺激了CIA大鼠相关因子与5-HT前体物质,引发了炎症反应和关节破坏,造成了机体的疲乏感。在给予TE和RTE后,()-2-乙酰-2-羟基丁酸含量较CON组显著上升。说明TE和RTE可以通过调节缬氨酸、亮氨酸和异亮氨酸生物合成抑制RA的炎症反应。
5-羟基吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)是5-HT的分解产物,参与色氨酸代谢中的5-羟色胺途径。当机体处于炎症状态时中或细胞受到损伤后,5-HT会被释放并通过单胺氧化酶和醛脱氢酶转化为5-HIAA[27]。研究发现,佐剂性关节炎大鼠血清中5-HIAA水平显著上调[28]。在本研究中,致炎的大鼠体内大量5-HT被释放转化为5-HIAA并随尿液排出,导致MOD组大鼠尿液中5-HIAA含量显著上升。TE和RTE干预后,抑制了5-HT的释放,减少了5-HIAA的产生,导致尿液中的5-HIAA含量较MOD组显著下降。-乙酰色氨酸是肠道微生物群产生的色氨酸的分解代谢物。研究发现,RA患者存在色氨酸代谢异常,体内-乙酰色氨酸含量与RA发病率有关[29]。本实验中MOD组较CON组-乙酰色氨酸的含量变化说明了CIA大鼠体内的色氨酸代谢被扰乱,而TE和RTE通过回调-乙酰色氨酸水平来改善色氨酸代谢异常,从而发挥治疗作用。
在许多疾病的过程中,随着炎症的发生和发展,体内能量的消耗会反映在代谢产物中。肌酸是一种含氮氨基酸,在机体内由精氨酸、甘氨酸及甲硫氨酸3种氨基酸所合成。肌酸可在肌酸激酶的作用下形成磷酸化肌酸,参与三磷酸腺苷(adenosine triphosphate,ATP)循环,在细胞内能量的转运过程中具有重要作用[30]。现代医学认为RA患者关节局部存在低氧、缺氧和低血糖状态,低氧导致氧化磷酸化途径ATP的生成障碍[31]。在CIA大鼠中,低氧导致肌酸通过氧化磷酸化途径生成ATP的过程受到阻碍,能量反应受到抑制,从而导致肌酸在机体内的含量升高。在经TE和RTE治疗后,肌酸含量明显较MOD组下降,提示TE和RTE可能通过调节能量代谢发挥抗炎作用。
白三烯B4是一种炎症脂质介体,可激活并且聚集多种炎性和免疫效应细胞,作用于T淋巴细胞释放各种细胞因子[32]。研究发现,在RA机体中含有较高浓度的白三烯B4,并且中性粒细胞释放白三烯B4的能力增强[25]。白三烯B4通过抑制中性粒细胞凋亡并诱导其定向迁移、致关节疼痛过敏、调控免疫细胞分化和细胞因子表达等引发RA病人关节肿痛、骨质破坏等炎症反应[33]。本实验中MOD组大鼠尿液中白三烯B4含量显著升高,与文献一致。经TE和RTE治疗后,白三烯B4含量显著下降,提示TE和RTE通过调控白三烯B4在体内的代谢和转化从而下调炎症因子的释放,进而发挥对CIA大鼠的治疗作用。
尿苷5′-单磷酸是一种单磷酸盐形式的尿嘧啶核苷酸,能够由从头途径或体内核苷酸和核酸的降解产物获得。在RA患者的关节中有大量活化的T细胞,它们需要大量嘧啶以维持其增殖[34]。研究表明,在佐剂性关节炎模型大鼠中尿苷5′-单磷酸含量显著降低,是潜在的RA生物标志物[35]。本实验结果与文献一致[35],可能是活化的T细胞的增殖消耗了大量嘧啶,导致其含量的下降。
4.2 对琥珀酸/VEGF炎症信号通路的影响分析
RA的发病机制目前尚不明确,关节滑膜炎症和血管新生是其基本病理特征。血管新生发生在炎症关节组织的早期,可以促进炎性细胞向关节的浸润,在RA的发展中起着重要作用[36]。VEGFA作为效果突出的促血管生成因子,在RA滑膜组织中高表达[37],可促进滑膜内皮细胞活化以诱导炎症,从而在RA中建立血管新生和关节炎症之间的相互作用[38]。炎性介质CD31被视为内皮细胞和血管细胞的表面分子标志,主要高表达于血管内皮细胞的胞质中,在血管的生成中起到重要的作用[39]。在本研究中TE和RTE可明显下调VEGFA和CD31的表达,RTE下调的趋势较TE更加明显,提示雷公藤可调节血管新生改善RA,煨制增效作用与血管新生有关。
琥珀酸是能量代谢中三羧酸循环的中间产物,可由SDH水解为富马酸。研究表明,琥珀酸在RA患者关节滑膜液中大量堆积可加剧关节滑膜炎症和血管新生,阻断琥珀酸在滑膜中的堆积可抑制血管新生和滑膜炎症,从而改善RA[12]。本实验发现TE和RTE均可抑制模型大鼠的琥珀酸堆积,煨制品抑制效果显著优于生品。在三羧酸循环中抑制SDH活力会导致琥珀酸过度堆积[40]。然而本研究中CIA大鼠中SDH活性显著高于健康大鼠且雷公藤煨制前后大鼠滑膜中SDH活性、富马酸含量无显著差异。结合文献发现,琥珀酸的积累可能是SDH活性逆转的结果[12]。而雷公藤并未参与对SDH活性的调控,煨制增效机制也与SDH活性无关。
综上,煨制可有效提高雷公藤对CIA大鼠的治疗效果,其增效机制与调节缬氨酸、亮氨酸和异亮氨酸生物合成,能量代谢,色氨酸代谢有关。在与RA发病相关的差异代谢物中,5-羟基吲哚乙酸、尿苷5′-单磷酸、肌酸、白三烯B4、-乙酰色氨酸经文献研究证明为可靠的RA生物标志物,对于疾病的发生具有重要意义。而 ()-2-乙酰-2-羟基丁酸、环状-乙酰羟色胺葡萄糖醛酸苷、β-胍基丙酸、-棕榈酰色氨酸、5-甲酰胞嘧啶在RA的研究中鲜有报道,为本研究新发现的RA相关生物标志物。经进一步的研究发现,雷公藤可调节琥珀酸/VEGF炎症信号通路阻止琥珀酸堆积和抑制血管新生,从而改善RA,煨制可增强雷公藤对该信号通路的调控从而发挥增效作用。本研究首次从代谢组学的角度及琥珀酸/VEGF炎症信号通路阐释了煨制雷公藤抗RA增效机制,为煨制在雷公藤中的应用提供了科学依据,为雷公藤的深入研究提供了参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 叶敏, 万军, 王李俊, 等. 中药通过调节肠道菌群治疗类风湿关节炎的研究进展[J]. 中草药, 2022, 53(22): 7279-7284.
[2] Yu K H, Chen H H, Cheng T T,. Consensus recommendations on managing the selected comorbidities including cardiovascular disease, osteoporosis, and interstitial lung disease in rheumatoid arthritis [J]., 2022, 101(1): e28501.
[3] 杨琴, 杨进锋, 杨玉涛, 等. 类风湿关节炎药物及手术治疗的研究进展 [J]. 中华中医药学刊, 2023, 41(1): 133-136.
[4] 蒋红霞, 伍秋珊, 刘莉, 等. 雷公藤三萜类成分及其药理活性研究进展 [J]. 中成药, 2022, 44(4): 1223-1231.
[5] 黄谣. 基于Treg/Th17细胞失衡探讨雷公藤甲素治疗RA的作用和机制研究 [D]. 武汉: 华中科技大学, 2021.
[6] 姜淼, 张海波, 张霞, 等. 雷公藤多苷不良反应及配伍减毒研究进展 [J]. 中华中医药学刊, 2021, 39(5): 64-66.
[7] 陈殊, 刘莉, 蒋红霞, 等. 雷公藤药理与毒理机制代谢组学研究进展 [J]. 海峡药学, 2022, 34(2): 1-6.
[8] 刘建群, 张国华, 高俊博. 烘箱煨制雷公藤药效毒性及成分变化研究 [J]. 亚太传统医药, 2015, 11(10): 7-9.
[9] Xu L X, Chang C, Jiang P,. Metabolomics in rheumatoid arthritis: Advances and review [J]., 2022, 13: 961708.
[10] Hanlon M M, Canavan M, Barker B E,. Metabolites as drivers and targets in rheumatoid arthritis [J]., 2022, 208(2): 167-180.
[11] Kim S, Hwang J, Xuan J H,. Global metabolite profiling of synovial fluid for the specific diagnosis of rheumatoid arthritis from other inflammatory arthritis [J]., 2014, 9(6): e97501.
[12] Li Y, Liu Y, Wang C,. Succinate induces synovial angiogenesis in rheumatoid arthritis through metabolic remodeling and HIF-1α/VEGF axis [J]., 2018, 126: 1-14.
[13] 姬翔宇, 张子雯, 陈姿伊, 等. 一测多评法同时测定雷公藤药材及制剂雷公藤多苷片中7个质控成分 [J]. 中草药, 2022, 53(17): 5338-5347.
[14] 刘莉, 闫君, 舒积成, 等. 雷公藤生物碱类成分及其药理活性研究进展 [J]. 天然产物研究与开发, 2019, 31(12): 2170-2181.
[15] 白雪, 付瑞嘉, 乐世俊, 等. 雷公藤治疗类风湿性关节炎研究进展 [J]. 中草药, 2020, 51(1): 265-275.
[16] 刘建群, 罗素花, 张锐, 等. 基于UPLC-Q-TOF MS研究煨制对雷公藤化学成分的影响 [J]. 质谱学报, 2018, 39(5): 573-582.
[17] 梁瑞峰, 李兵杰, 葛文静, 等. 防风不同提取部位的燥性差异及其对胶原诱导性关节炎大鼠滑膜水通道蛋白的影响[J]. 中草药, 2021, 52(11): 3312-3320.
[18] 张妍, 王健英, 陈晓云, 等. 基于NF-κB通路探讨杜仲皮、叶醇提物对胶原诱导型关节炎大鼠炎症性骨破坏的影响 [J]. 中草药, 2021, 52(6): 1645-1653.
[19] Li Y, Zheng J Y, Liu J Q,. Succinate/NLRP3 inflammasome induces synovial fibroblast activation: Therapeutical effects of clematichinenoside AR on arthritis [J]., 2016, 7: 532.
[20] 李利青, 张逢, 彭馥芝, 等. 类风湿关节炎实验性动物模型研究进展 [J]. 中国药理学通报, 2021, 37(11): 1492-1497.
[21] 王艳, 尹伟洲. 类风湿性关节炎患者血清IL-1β、IL-32的表达及其与临床预后的关系 [J]. 河南医学研究, 2022, 31(21): 3885-3888.
[22] 李东薇, 穆柏辰, 窦德强, 等. 甘草附子汤对胶原诱导性关节炎大鼠血清和关节液中IL-1β、IL-10及TNF-α含量的影响 [J]. 中华中医药杂志, 2020, 35(12): 6355-6358.
[23] Nicholson J K, Lindon J C, Holmes E. Metabonomics: Understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data [J]., 1999, 29(11): 1181-1189.
[24] 李偲. “成分—药效—代谢—靶标”多维关联模式下特色中药耳聋胶囊防治庆大霉素致听力损失的药效物质基础及作用机制研究 [D]. 天津: 天津中医药大学, 2022.
[25] 杜小正, 袁博, 张星华, 等. 基于代谢组学研究热补针法治疗类风湿关节炎寒证家兔的作用机制 [J]. 针刺研究, 2017, 42(3): 202-208.
[26] 张永怡. 基于代谢组学技术研究艾灸干预类风湿关节炎大鼠的效应机制 [D]. 南京: 南京中医药大学, 2018.
[27] Lyu S, Rao Y, Liu P,. Metabolomics analysis reveals four biomarkers associated with the gouty arthritis progression in patients with sequential stages [J]., 2022, 55: 152022.
[28] 沈彩红. 茜草醇提物治疗类风湿性关节炎的代谢组学研究 [D]. 广州: 广州中医药大学, 2018.
[29] Pavlova T, Vidova V, Bienertova-Vasku J,. Urinary intermediates of tryptophan as indicators of the gut microbial metabolism [J]., 2017, 987: 72-80.
[30] 王誉杰, 张进威, 王讯, 等. 胍基乙酸及代谢产物肌酸的研究进展 [J]. 畜牧兽医学报, 2018, 49(8): 1577-1584.
[31] 李永祥, 刘剑. 肌酸激酶与血压关系及其在高血压治疗中的研究进展 [J]. 现代医药卫生, 2015, 31(14): 2143-2146.
[32] 许丹. 类叶牡丹有效部位干预胶原诱导型关节炎大鼠的代谢组学研究 [D]. 哈尔滨: 黑龙江中医药大学, 2018.
[33] 魏志萍. LTB4和BLT1在类风湿关节炎中的作用 [J]. 中国医药科学, 2020, 10(12): 50-52.
[34] 王俏. 类风湿性关节炎患者对来氟米特反应的预后模型构建 [D]. 沈阳: 中国医科大学, 2021.
[35] Xie Y F, Feng W W, Liu M C,. Investigation of efficacy enhancing and toxicity reducing mechanism of combination ofandin adjuvant-induced arthritis rats by metabolomics [J]., 2019, 2019: 9864841.
[36] Balogh E, Biniecka M, Fearon U,. Angiogenesis in inflammatory arthritis [J]., 2019, 21(5): 345-352.
[37] 褚小磊. 槲皮素对胶原诱导性关节炎大鼠滑膜VEGFA表达影响及血管新生靶点筛选 [D]. 蚌埠: 蚌埠医学院, 2021.
[38] Gong Y Y, Yu Z Y, Wang Y N,. Effect of moxibustion on HIF-1α and VEGF levels in patients with rheumatoid arthritis [J]., 2019, 2019: 4705247.
[39] 夏士涛, 王培宇, 魏静, 等. 海风藤醇提物抑制CD31因子对CSDH模型大鼠血肿外膜血管炎症影响的研究 [J]. 中医药学报, 2022, 50(11): 37-41.
[40] Chouchani E T, Pell V R, Gaude E,. Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS [J]., 2014, 515(7527): 431-435.
Enhancing efficacy mechanism of roastedbased on metabolomics and succinate/VEGF signal pathway
CHEN Shu, SHI Xuan-yi, GU zi-xian, CHEN Jia-yi, JIANG Hong-xia, ZHANG Liang, SUN Qun, LIU Jian-qun
Key Laboratory of Modern Preparation of Traditional Chinese Medicine, Ministry of Education, Jiangxi University of Chinese Medicine, Nanchang 330004, China
To explore the enhancing efficacy mechanism of roasted(TW) based on metabolomics and succinate/vascular endothelial growth factor (VEGF) signal pathway by observing the effect of TW before and after roasting on collagen-induced arthritis (CIA) model rats.CIA model rats were induced by hypodermic injecting with bovine type II collagen emulsion into the tails of rats and then treated with dexamethasone acetate, total extract of TW and total extract of roasted TW for 20 d. The curative effect was assessed by paw swelling, arthritis scores, serum levels of interleukin-1β (IL-1β) and pathological sections of synovial tissue. The differences in metabolic expression profiles among groups were characterized based on metabolomics. Succinate dehydrogenase (SDH) viability as well as succinate and fumarate content in synovial tissue were detected. The expressions of VEGFA and platelet endothelial cell adhesion molecule-1 (CD31) in synovial tissue was measured by immunohistochemistry.Compared with model group, paw swelling and arthritis scores in total extract and roasted total extract groups were significantly decreased (< 0.05), interleukin-1β level in serum was significantly decreased (< 0.05), synovial histopathological changes were ameliorated, content of succinate in synovium was significantly decreased (< 0.05), SDH activity was not significantly changed, expressions of VEGFA and CD31 in synovium were significantly decreased (< 0.05). Compared with total extract group, SDH activity in roasted total extract group had no obvious change, and the other indexes were obviously closer to the control group (< 0.05). The metabolomics results showed that a total of 15 differential metabolites were screened from the model group. Among them, six differential metabolites were significantly callback compared to the model group after treatment with roasted total extract. Moreover, the levels of these six metabolites in roasted total extract group were significantly closer to the levels in control group than in total extract group (< 0.05). The results indicated that these metabolite changes involved valine, leucine and isoleucine biosynthesis, tryptophan metabolism, energy metabolism and arachidonic acid metabolism.Roasting is able to improve the therapeutic effect of TW on CIA model rats. The enhancing efficacy mechanism may be related to the regulation of valine, leucine and isoleucine biosynthesis, tryptophan metabolism, energy metabolism and arachidonic acid metabolic pathways. TW modulates the succinate/VEGF inflammatory signal pathway to improve rheumatoid arthritis. Roasting enhances the anti-rheumatoid arthritis effect of TW by regulating succinate/VEGF signal pathway.
Hook. f.; roasting; rheumatoid arthritis; metabolomics; succinate/vascular endothelial growth factor inflammatory signal pathway; 1-hydroxy-2,5,8-trimethyl-9-fluorenone; triptolide; tripfordine A; triptonide; tripterine; wilforgine; wilfordine; wilforine
R285.5
A
0253 - 2670(2023)12 - 3851 - 14
10.7501/j.issn.0253-2670.2023.12.012
2023-02-05
国家自然科学基金资助项目(81860686);江西省主要学科学术和技术带头人资助项目(20182BCB22004);江西中医药大学校级科技创新团队发展计划(CXTD22007)
陈 殊,硕士研究生,从事中药药效物质基础及质量评价研究。E-mail: 804118328@qq.com
通信作者:刘建群,博士,教授,博士生导师,从事中药药效物质基础及质量评价研究。Tel: (0791)87118786 E-mail: liu5308@sina.com
[责任编辑 李亚楠]

